Международный неврологический журнал Том 20, №2, 2024
Вернуться к номеру
Концепція багатофункціональних препаратів на прикладі ефектів тразодону
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Вступ
У сучасній психофармакології швидко поширилася та закріпилася концепція багатофункціональних препаратів — таких, які мають більше ніж один передбачуваний механізм терапевтичної дії. Більшість з таких препаратів демонструють різні ефекти в різних дозах, тобто ефект, який препарат проявляє, залежить від призначеної дози. Одним із яскравих представників багатофункціональних препаратів із дозозалежною фармакологічною дією є тразодон. У низьких дозах він є снодійним завдяки блокаді 5-НТ2А-рецепторів,
Н1-рецепторів гістаміну та альфа1-адренорецепторів. Вищі дози блокують транспортер серотоніну (SERT) і перетворюють тразодон на антидепресант. Раніше тразодон традиційно використовувався переважно в низьких дозах як снодійний засіб, але поява форми з контрольованим вивільненням, яка потенційно має поліпшену переносимість високих доз, надає можливість також розглядати тразодон як антидепресант.
Фармакологія тразодону
Найпотужнішою зв’язуючою властивістю тразодону є антагонізм до 5-HT2A-рецепторів. Його здатність блокувати SERTs у 100 разів менша за здатність блокувати рецептори 5-HT2A (рис. 1, 2) [6–11]. Оскільки обидві ці дії вважаються необхідними для ефективності антидепресантів, багатофункціональність тразодону іноді класифікують як «антагоніст серотоніну — інгібітор зворотного захоплення» (SARI) (рис. 3A) [9]. Але для того, щоб тразодон діяв як SARI, його потрібно вводити в дозі, що в десять-п’ятдесят разів перевищує дозу, необхідну для блокування рецепторів 5-HT2A (рис. 2) [6–11].
Інші клінічно значущі фармакологічні дії тразодону стосуються рецепторів, до яких тразодон має помірну афінність, а саме зв’язуючий ефект, вираженість якого перебуває між його здатністю блокувати рецептори 5-HT2A та SERT. Ці властивості тразодону включають блокування aльфа1-адренергічних рецепторів і гістамінових H1-рецепторів (рис. 1, 2) [6–11]. У високих дозах, необхідних для блокування SERT, дія тразодону на інші рецептори зі спорідненістю в діапазоні блокади SERT також може бути клінічно значущою, наприклад блокада aльфа2-адренергічних рецепторів і 5-HT2C-рецепторів (рис. 1). Такі дії можуть сприяти антидепресивній ефективності тразодону.
Наразі відомо, що антагонізм 5-HT2C є властивістю кількох сучасних антидепресантів, зокрема тразодону, міртазапіну, декількох трициклічних антидепресантів та активного метаболіту кветіапіну — норкветіапіну [9, 12]. Антагонізм 5-HT2C також є властивістю кількох нових антидепресантів, включно з агомелатином [9, 12–15]. Альфа2-антагонізм є властивістю відомого антидепресанта міртазапіну [9]. Дія тразодону на інші транспортери моноамінів, як-от транспортер дофаміну (DAT) і транспортер норадреналіну (NET), ймовірно, надто слабка, щоб мати клінічне значення (рис. 1).
/36.jpg)
В організмі тразодон перетворюється на активний метаболіт, відомий як мета-хлорфенілпіперазин (mCPP) [16–20]. Цей агент має високу спорідненість до низки серотонінових рецепторів: 5HT2C > 5HT3 > 5HT2A > 5HT1B > 5HT1A > 5HT1D, де він функціонує здебільшого як агоніст [18–20] на відміну від тразодону, який діє як антагоніст 5-HT2A- і 5-HT2C-рецепторів [6–11]. Ці фармакологічні ефекти mCPP можуть підсилити фармакологічні ефекти тразодону та теоретично можуть послабити пряму дію тразодону як антагоніста на рецептори 5-HT2A і 5-HT2C. Однак рівень mCPP у плазмі та мозку становить менше ніж 10 % від рівня самого тразодону [21, 22]. Таким чином, антагоністична дія тразодону, швидше за все, перекриває будь-які ефекти mCPP і блокує будь-які агоністичні дії mCPP на 5HT2A- і 5-HT2C-рецептори.
Чим тразодон відрізняється від SSRI/SNRI
Тразодон при призначенні його в дозі для лікування депресії (рис. 2, 3), діючи як SARI, блокує SERT так само, як селективні інгібітори зворотного захоплення серотоніну (SSRI) і інгібітори зворотного захоплення серотоніну та норадреналіну (SNRI). Однак, на відміну від SSRI та SNRI, тразодон одночасно блокує рецептори 5-HT2A і, меншою мірою, рецептори 5-HT2C (рис. 1), що є його ключовою відмінною ознакою з великим клінічним значенням з точки зору переносимості.
Існує понад 14 відомих підтипів рецепторів серотоніну [9], і у разі блокування SERT серотонін стимулює всі ці рецептори в будь-якому місці, де рівень серотоніну підвищений. Численні доклінічні дані свідчать про те, що саме агоністична дія серотоніну на рецептори 5-HT1A пояснює терапевтичні ефекти SSRI/SNRI (табл. 1; рис. 4A, 6) [9]. На жаль, агоністична дія серотоніну щодо інших підтипів рецепторів є причиною численних побічних ефектів блокаторів SERT (табл. 1; рис. 4B, 4C, 6). Ці потенційно небажані агоністичні дії на небажані підтипи серотонінових рецепторів можуть впливати на дію SSRI/SNRI. На щастя, з часом нерідко відбувається десенситизація цих рецепторів, принаймні у деяких пацієнтів, із розвитком толерантності до деяких побічних ефектів, які викликає стимуляція цих рецепторів.
Уявлення про конкретні наслідки стимуляції або блокування різних підтипів рецепторів серотоніну походить з досліджень, які пов’язують специфічні функції з кожним окремим підтипом рецепторів (табл. 1) [9]. Стимуляція рецепторів 5-HT1A теоретично призводить до антидепресивних ефектів (рис. 4A, 6, 7). Антидепресивна дія препаратів, які пригнічують SERT, можливо, опосередковується пресинаптичними та постсинаптичними 5-HT1A-рецепторами (рис. 4A) [9]. Гіпотетично з часом після введення інгібітора SERT спостерігається десенситизація пресинаптичних 5-HT1A соматодендритних авторецепторів, що призводить до посилення вивільнення 5HT [9]. Це врешті-решт призводить до доставки більшої кількості серотоніну в синапс із подальшою антидепресивною дією. Оскільки немає десенситизації постсинаптичних 5-HT1A-рецепторів, ефективність антидепресантів загалом є стійкою. Однак антидепресивна ефективність SSRI/SNRI у деяких пацієнтів з часом втрачається, це явище іноді називають «випаданням». Гіпотетично небажана десенситизація постсинаптичних рецепторів 5-HT1A може бути пов’язана з втратою ефективності після тривалого застосування препарату.
У багатьох пацієнтів після тривалого застосування SSRI/SNRI десенситизуються постсинаптичні рецептори 5-HT2A і 5-HT2C, що гіпотетично призводить до зменшення деяких побічних ефектів, пов’язаних із цими рецепторами, особливо тривоги (рис. 4B, 4C). З іншого боку, після тривалого лікування SSRI/SNRI безсоння зникає не так легко, і фактично воно є найпоширенішим залишковим симптомом після лікування цими препаратами [9]. Також при тривалому застосуванні SSRI/SNRI може зменшуватися сексуальна дисфункція, але у багатьох пацієнтів вона залишається і є постійною проблемою.
Таким чином, можна сказати, що підвищуючи рівень серотоніну для всіх серотонінових рецепторів та в усіх ділянках мозку, інгібітори SERT, як-от SSRI/SNRI, одночасно спричиняють антидепресивну дію, стимулюючи рецептори 5-HT1A, але мають побічні ефекти, що виникають внаслідок стимуляції рецепторів 5-HT2A та 5-HT2C (рис. 4, 6). Однак коли інгібування SERT поєднується з інгібуванням 5-HT2A/2C, це призводить до антидепресивної дії без розвитку сексуальної дисфункції, тривоги чи безсоння (рис. 7). Одночасне блокування рецепторів 5-HT2A та 5-HT2C тразодоном під час застосування SSRI/SNRI може потенційно лікувати безсоння та тривогу, пов’язані з депресією, а також запобігати депресії, викликаній пригніченням SERT. Клінічний досвід застосування SSRI/SNRI підтвердив їх поліпшену переносимість завдяки одночасному блокуванню рецепторів 5-HT2A/5-HT2C, і це може пояснити, чому тразодон у низьких дозах є одним із препаратів, які здебільшого призначаються разом із SSRI/SNRI [9].
Механізм дії тразодону як низькодозового снодійного засобу
Тразодон схвалений як антидепресант у високих дозах, але частіше використовується «не за призначенням», як снодійний засіб у низьких дозах [9, 23].Фактично призначення низьких доз тразодону як снодійного може бути найпоширенішим використанням препарату поза призначенням [23]. Поняття «використання поза призначенням» не означає, що це погано. Це означає тільки те, що Управління з харчових продуктів і медикаментів (FDA) не схвалило використання за такими показаннями. Але FDA регулює продаж ліків, а не медичну практику, і не забороняє використання тразодону як снодійного. Натомість медична практика функціонує на основі стандартів лікування, рекомендацій експертів та настанов, і в клінічній практиці тразодон є, можливо, найпопулярнішим снодійним засобом у США [23].
Оскільки тразодон є найпотужнішим у блокуванні рецепторів 5-HT2A, можна вирішити, що лише ця дія пояснює його снодійний ефект у низькій дозі. Насправді тразодон дійсно сприяє засинанню, а також підтримує сон, але в дозах, значно вищих за ті, які необхідні для насичення рецепторів 5-HT2A. Приблизно половина рецепторів 5-HT2A в мозку блокується 1 мг тразодону (рис. 2, верхня пунктирна лінія), усі рецептори 5-HT2A насичуються дозою тразодону 10 мг, але клінічно ефективні снодійні дози тразодону знаходяться в діапазоні 25–100 мг (рис. 2, друга пунктирна лінія зверху). Таким чином, виявляється, що для снодійної дії тразодону необхідні дози, вищі за ті, які викликають селективну антагоністичну дію на 5-HT2A-рецептори. Профіль зв’язування тразодону з рецепторами показує, що збільшення дози понад таку, що необхідна для насичення рецепторів 5-HT2A, викликає додаткові фармакологічні дії, зокрема блокаду альфа1-адренергічних рецепторів і Н1-гістамінових рецепторів. Це робить тразодон у низькій дозі багатофункціональним препаратом із властивостями 5-HT2A, антагоніста альфа1-адренергічних і H1-гістамінових рецепторів (рис. 3B).
Теоретично такий профіль дійсно повинен характеризувати тразодон як ефективний снодійний засіб, оскільки відомо, що механізми збудження включають дії кількох нейромедіаторних систем на додаток до дії серотоніну, зокрема норадреналіну, дофаміну, ацетилхоліну і гістаміну [5, 9, 25]. Блокування деяких із них може одночасно зменшувати збудження та викликати сон. Насправді для потужного снодійного ефекту може бути достатньо лише селективної блокади гістамінової системи [5]. Додаткові антагоністичні дії щодо aльфа1-адренергічних та 5-HT2A-рецепторів мають посилити цей ефект блокади Н1-рецепторів, що викликає сон [5, 9, 25].
Таким чином, снодійної дози тразодону достатньо для насичення всіх рецепторів 5-HT2A і блокування половини або більше рецепторів H1 і aльфа1 (рис. 2). Блокування половини цих рецепторів, безперечно, сприяє снодійному ефекту [26]. Хоча тразодон у снодійній дозі також блокує SERT приблизно на 50 % (рис. 2), цього недостатньо для прояву його антидепресантної дії. У багатьох дослідженнях показано, що для досягнення антидепресивного ефекту у пацієнтів з депресією SSRI/SNRI необхідно дозувати так, щоб SERT був майже повністю перевантаженим [9]. Для такого ступеня дії на SERT недостатньо снодійної дози, оскільки вона занадто низька для того, щоб справити антидепресивний ефект.
Таким чином, антагонізм до 5-HT2A-рецепторів разом із Н1-антигістамінним та альфа1-адренергічним антагоністичним ефектом теоретично пояснюють терапевтичну дію тразодону як снодійного в діапазоні доз 25–150 мг (рис. 2 і 3B). Якщо до цього додати, що тразодон не викликає залежності та має відносно короткий період напіввиведення, можна вважати тразодон ідеальним снодійним засобом.
Механізм дії тразодону як високодозового антидепресанту
Для перетворення тразодону на потужний інгібітор SERT потрібні високі дози 150–600 мг (рис. 1, 2, 3A) [9, 23]. У таких високих дозах SERT пригнічується до рівня, необхідного для антидепресивної дії. Інакше кажучи, високі дози посилюють додаткову дію інгібування SERT на антагонізм 5-HT2A, додаючи ще один фармакологічний механізм до переліку багатофункціональних властивостей тразодону в цій дозі.
Є теоретичні підстави припускати, що антагоністи 5-HT2A та 5-HT2C також можуть мати антидепресивну дію. Таким чином, сумарне інгібування SERT плюс антагонізм 5-HT2A/2C матиме синергічну антидепресивну дію [27–38]. Один із потенційних ней-робіологічних субстратів синергії антидепресантів між антагонізмом 5-HT2A та інгібуванням SERT походить від протилежних дій серотоніну у пірамідних нейронах префронтальної кори головного мозку [9, 36]. Коли SSRI/SNRI посилюють вивільнення серотоніну в префронтальній корі, це призводить до протилежної дії серотоніну на постсинаптичні рецептори 5-HT1A та 5-HT2A [9, 36]. Таким чином, серотонін інгібує рецептори 5-HT1A в пірамідних нейронах префронтальної кори і збуджує рецептори 5-HT2A на тих самих нейронах. Баланс між цими двома діями визначає, чи є чисте збудження чи чисте гальмування пірамідного нейрона серотоніном. Теоретично терапевтична дія серотонінергічних антидепресантів може бути пов’язана зі зниженням гіперактивності пірамідних нейронів кори головного мозку при депресії [9], і, отже, антидепресанти можуть діяти частково шляхом інгібування цих пірамідних нейронів префронтальної кори, зменшуючи вивільнення глутамату.
Таким чином, коли рівень серотоніну підвищується після інгібування SERT, рецептори 5-HT2A збуджуватимуть пірамідні нейрони і пом’якшуватимуть теоретично бажане опосередковане інгібування 5-HT1A-рецепторів цих нейронів. З іншого боку, коли рецептори 5-HT2A блокуються одночасно з активацією рецепторів 5HT1A, це посилює інгібування коркових пірамідних нейронів, гіпотетично опосередковуючи синергічні ефекти антидепресантів [9, 27–30].
Іншим механізмом, за допомогою якого антагоністи 5-HT2A/2С можуть опосередковувати антидепресивні ефекти, є підвищення рівня нейромедіаторів дофаміну та норадреналіну в префронтальній корі [4, 9, 12, 15, 31–35]. Вважається, що цей механізм частково пояснює антидепресивну дію деяких атипових антипсихотичних засобів із властивостями антагоністів 5-HT2A [2, 9, 12, 28], а також антидепресантними властивостями антагоністів 5-HT2C агомелатину та кветіапіну (через його активний метаболіт норкветіапін) [4, 9, 12]. Рецептори 5-HT2A та 5-HT2C регулюють вивільнення дофаміну та норадреналіну в корі головного мозку, загалом пригнічуючи вивільнення цих нейромедіаторів, іноді через гальмівний ГАМКергічний інтернейрон [31–38]. Коли це гальмування блокується антагоністом 5-HT2A/2C, як-от тразодон, це пригнічує вивільнення як дофаміну, так і норадреналіну в префронтальній корі, потенційно опосередковуючи антидепресивні ефекти [9].
Ці різні фармакологічні механізми, які вказують на те, як антагоністи 5-HT2A/2C самі по собі можуть бути антидепресантами, і особливо можливість того, що ці механізми можуть справляти синергічну антидепресивну дію разом із одночасним інгібуванням SERT, все ще є лише теоретичними міркуваннями. Жодні клінічні дослідження не підтверджують, що додавання антагонізму 5-HT2A/2C до дії SSRI/SNRI посилює антидепресивні ефекти у пацієнтів з депресією. Однак це уявлення узгоджується зі спостереженнями про те, що атипові антипсихотики, які мають антагоністичний ефект 5-HT2A, справді потенціюють дії SSRI/SNRI у деяких пацієнтів з депресією [9, 23], особливо у випадках депресії, резистентної до лікування [23].
Фармакокінетика тразодону: порівняння механізмів негайного та подовженого вивільнення
Якщо високі дози викликають критичне пригнічення SERT, через що тразодон має антидепресивну дію, а також високі дози викликають антагонізм 5-HT2C, який у поєднанні з антагонізмом 5-HT2A посилює антидепресивну дію та переносимість пригнічення SERT, то чому клініцисти просто не підвищують дозу тразодону для того, щоб призначити його як антидепресант? Чому натомість тразодон набагато частіше призначають у низьких дозах разом із SSRI/SNRI, ніж як монотерапію у високих дозах?
Існує головна клінічна причина, чому для лікування депресії тразодон не використовується як монотерапія у високих дозах: в антидепресивних дозах він часто має надто седативну дію протягом дня.
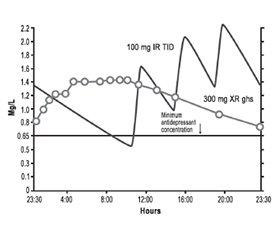
Традиційний тразодон існує у формі короткої дії з негайним вивільненням (IR), що швидко генерує пікові рівні препарату, які швидко знижуються (рис. 10) [16, 17, 21, 22, 39]. На рис. 10 показані розраховані за допомогою фармакокінетичного моделювання рівні тразодону IR у стабільному стані через 9 днів прийому в дозах 50, 75 і 100 мг на ніч [39]. Швидке підвищення пікових рівнів між 0,65 і 1,3 мг/л [39] пов’язане з потужними снодійними ефектами, які, очевидно, не формують з часом толерантності та нечасто викликають «післядію» внаслідок седації наступного ранку [23]. Швидкі, непостійні рівні тразодону в плазмі є ідеальними для снодійного ефекту, а пульсуюча система доставки препарату є бажаною властивістю для запобігання розвитку толерантності до препарату [9]. Не дивно, що тразодон IR є чудовим снодійним засобом.
На рис. 10 також показано мінімальну концентрацію тразодону, яка, за деякими дослідженнями, необхідна для досягнення антидепресивної дії (лінія 0,65 мг/л) [21, 22, 40]. Снодійні дози досягають цих рівнів на короткий термін, тому такі дози не є адекватними для антидепресивного ефекту. Для порівняння показані рівні препарату в плазмі у разі введення тразодону пролонгованого вивільнення (XR) один раз на добу в дозі 300 мг (рис. 10, 11) [39]. По-перше, концентрація препарату у формі XR повільно зростає і повільно знижується, при цьому забезпечуючи його стійкі рівні, що перевищують мінімальну концентрацію антидепресанту, і з піковими рівнями тразодону в плазмі в тому ж діапазоні, що створюється лише дозою 100 мг тразодону IR [39]. Таким чином, тразодон XR у дозі 300 мг повинен забезпечити достатній та постійний рівень тразодону в крові, необхідний для антидепресивної дії, але він не має справляти седативну дію, більш виражену, ніж та, що виникає при введенні 100 мг тразодону IR. Крім того, стійкі рівні тразодону в крові, створювані його формою XR, теоретично є ідеальними для того, щоб викликати толерантність до побічного седативного ефекту, на відміну від випадків короткочасної пульсуючої доставки тразодону IR, коли не потрібна толерантність до седативного ефекту.
/39.jpg)
Кількісне визначення фармакокінетики тразодону IR в антидепресантній дозі 300 мг на добу при введенні його по 100 мг тричі на добу показано на рис. 11 [39]. У цьому випадку крива концентрацій тразодону в плазмі має зубчастоподібний вигляд: рівень тразодону протягом більшої частини дня загалом вищий, ніж мінімально необхідна концентрація для антидепресивного ефекту, але при цьому протягом ночі, перед введенням нової ранкової дози, рівень препарату в плазмі зменшується нижче від мінімально необхідної концентрації для антидепресивної дії [39]. Дуже високі рівні тразодону протягом деяких періодів дня є у два-три рази вищими від прогнозованих рівнів (порівняйте піки тразодону IR на рис. 10 і 11). Не дивно, що тразодон IR, який призначають у дозі 100 мг тричі на добу, у деяких пацієнтів може викликати неприйнятний седативний ефект. Якщо до цього додати незручність багаторазового прийому препарату протягом доби, стає зрозумілим, чому використання тразодону IR у дозах, адекватних для забезпечення антидепресивного ефекту, було обмеженим. Для порівняння рівні тразодону в плазмі у випадку застосування форми XR у дозі 300 мг також показані на рис. 11 [39].
Фармакокінетичний профіль тразодону XR свідчить про те, що він повинен мати менше побічних ефектів при піковій дозі, але його антидепресивний ефект схожий з таким, що розвивається при застосуванні 100 мг тразодону IR тричі на добу.
Висновки
Тразодон, препарат, який давно використовується в психофармакології, тепер розглядається як багатофункціональний препарат із снодійним фармакологічним ефектом у низьких дозах та додатковою багатофункціональною фармакологічною дією, що у високих дозах робить його антидепресантом. Тразодон у формі негайного вивільнення є кращим для застосування як снодійний засіб, тоді як його форма подовженого контрольованого вивільнення може бути кращою для застосування його як антидепресанту. Як антидепресант тразодон має бути таким же ефективним, як SSRI та SNRI [42, 43], але при цьому мати низьку частоту таких побічних ефектів, як тривога, безсоння та сексуальна дисфункція, властивостей, очікуваних для багатофункціонального SARI.
Підготовлено за матеріалами статті
Stahl SM. Mechanism of action of trazodone: a multifunc-
tional drug. CNS Spectr. 2009 Oct;14(10):536-46.
doi: 10.1017/s1092852900024020. PMID: 20095366.
Друкується скорочено
Список литературы
1. Stahl SM. Multifunctional Drugs: A Novel Concept for Psychopharmacology. CNS Spectr. 2009;14:71-73.
2. Kim DH, Maneen MJ, Stahl SM. Building a Better Antipsychotic: Receptor Targets for the Treatment of Multiple Symptom Dimensions of Schizophrenia. Neurotherapeutics. 2009;6:78-85.
3. Van der Schyf CJ, Youdim MB. Multifunctional Drugs as Neurotherapeutics. Neurotherapeutics. 2009;6:1-3.
4. Millan MJ. Dual and triple acting agents for treating core and comorbid symptoms of major depression: novel concept, new drugs. Neurotherapeutics. 2009;6:53-77.
5. Stahl SM. Selective Histamine H1 Antagonism: Novel Hypnotic and Pharmacologic Actions Challenge Classical Notions of Antihistamines. CNS Spectr. 2008;13:1027-1038.
6. Cusack B, Nelson A, Richelson E. Binding of antidepressants to human brain receptors: focus on newer generation compounds. Psychopharmacology (Berl). 1994;114:559-564.
7. Tatsumi M, Groshan K, Blakely RD, Richelson E. Pharmacological profile of antidepressants and related compounds at human monoamine transporters. Eur J Pharmacol. 1997;340:249-258.
8. Richelson E, Souder T. Binding of antipsychotic drugs to human brain receptors focus on newer generations compounds. Life Sci. 2000;68:29-39.
9. Stahl SM. Stahls Essential Psychopharmacology. 3rd ed. New York, NY: Cambridge University Press; 2008.
10. Owens MJ, Morgan WN, Plott SJ, Nemeroff CB. Neurotransmitter receptor and transporter binding profile of antidepressants and their metabolites. J Pharmacol Exp Ther. 1997;283:1305-1322.
11. Knight AR, Misra A, Quirk K, et al. Pharmacological cha-racterisation of the agonist radioligand binding site of 5-HT(2A), 5-HT(2B) and 5-HT(2C) receptors. Naunyn Schmiedebergs Arch Pharmacol. 2004;370:114-123.
12. Millan MJ. Serotonin 5-HT2C receptors as a target for the treatment of depressive and anxious states: focus on novel therapeutic strategies. Therapie. 2005;60:441-460.
13. Dekeyne A, Mannoury la Cour C, et al. S32006, a novel 5HT2C receptor antagonist displaying broad-based antidepressant and anxiolytic properties in rodent models. Psychopharmacology (Berl). 2008;199:549-568.
14. Rosenzweig-Lipson S, Sabb A, Stack G, et al. Antidepressant like effects of the novel, selective 5HT2C receptor agonist WAY-163909 in rodents. Psychopharmacology (Berl). 2007;192:159-170.
15. Stahl SM. Novel mechanism of antidepressant action: norepinephrine and dopamine disinhibition (NDDI) plus melatonergic agonism. Int J Neuropsychopharmacol. 2007;10:575-578.
16. Maes M, Westenberg H, Vandoolaeghe E, et al. Effects of trazodone and fluoxetine in the treatment of major depression: therapeutic pharmacokinetic and pharmacodynamic interactions through formation of meta-chlorophenylpiperazine. J Clin Psychopharmacol. 1997;17:358-364.
17. Raffa RH, Shank RP, Vaught JL. Etioperidone, trazodone and mCPP: in vitro and in vivo identification of serotonin 5HT1A (antagonistic) activity. Psychopharmacology (Berl). 1992;108:320-326.
18. Schoeffter P, Hoyer D. Interaction of arylpiperazines with 5HT1A, 5HT1B, 5HT1C and 5HT1D receptors: do discriminatory 5HT1B receptor ligands exist. Naunyn Schmiedebergs Arch Pharmacol. 1989;339:675-683.
19. Sills MA, Wolfe BB, Frazer A. Determination of selective and non-selective compounds for the 5HT1A and 5HT1B receptor subtypes in rat frontal cortex. J Pharmacol Exp Ther. 1984:231:480-487.
20. Conn PJ, Sanders-Buse E. Relative efficacies of piperazines at the phosphoinositide hydrolysis-linked serotonergic 5HT2 and 5HT1C receptors. J Pharmacol Exp Ther. 1987;242:552-557.
21. Cheng FC, Tsai TH, Wu YS, Kuo JS, Chen CF. Pharmacokinetic and pharmacodynamic analyses of trazodone in rat striatum by in vivo microdialysis. J Pharm Biomed Anal. 1999;19:293-300.
22. Mihara K, Yasui-Furukori N, Kondo T, et al. Relationship between plasma concentrations of trazodone and its active metabolite, m-chlorophenylpiperazine, and its clinical effect in depressed patients. Ther Drug Monit. 2002;24:563-566.
23. Stahl SM. Stahls Essential Psychopharmacology Prescribers Guide. 3rd ed. New York, NY: Cambridge University Press; 2009.
24. Efficacy and Safety of Eplivanserin Treatment for Sleep Maintenance Insomnia Followed by Optional Extension up to 1 Year (EPLILONG). Available at: http://clini-caltrials.gov/ct2/show/NCT00253903.
25. Saper CB, Chou TC, Scammell TE. The sleep switch: hypothalamic control of sleep and wakefulness. Trends Neurosci. 2001;24:726-731.
26. Shigemoto Y, Fujii Y, Shinomiya K, Kamei C. Participation of histaminergic H1 and noradrenergic alpha 1 receptors in orexin A-induced wakefulness in rats. Brain Res. 2004;1023:121-125.
27. Pazzagli M, Gionvannini MG, Pepeu G. Traodone increases extracellular serotonin levels in the frontal cortex of rats. Eur J Pharmacol. 1999;383:249-257.
28. Marek GJ, Carpenter LL, McDougle CJ, Price LH. Synergistic action of 5HT2A antagonists and selectve serotonin reuptake inhibitors in neuropsychiatric disorders. Neuropsychopharmacology. 2003;28:402-412.
29. Cremers T, Rea K, Bosker FJ, et al. Augmentation of SSRI effects on serotonin by 5HT2C antagonists: mechanistic studies. Neuropsychopharmacology. 2007;32:1550-1557.
30. Nierenberg AA, Cole JO, Glass L. Possible trazodone potentiation of fluoxetine: a case series. J Clin Psychiatry. 1992;53:83-85.
31. DiMatteo V, DeBlasi A, DiGiulio C, Esposito E. Role of 5HT2C receptors in the control of central dopamine function. Trends Pharmacol Sci. 2001;22:229-232.
32. DeDeurwaerdere P, Navailles S, Berg KA, Claarke WP, Spampinato U. Constitutive activity of the serotonin2C receptor inhibits in vivo dopamine release in the rat striatum and nucleus accumbens. J Neurosci. 2004;24:3235-3241.
33. Alex KD, Pehek EA. Pharmacologic mechanisms of serotonergic regulation of dopamine neurotransmission. Pharmacol Ther. 2007;113:296-320.
34. Alex KD, Yavanian GJ, McFarlane HG, Pluto CP, Pehek EA. Modulation of dopamine release by striatal 5HT2C receptors. Synapse. 2005;55:242-251.
35. Porras G, DiMatteo V, Fracasso C, et al. 5HT2A and 5HT2C/2B receptor subtypes modulate dopamine release induced in vivo by amphetamine and morphine in both the rat nucleus accumbens and striatum. Neuropsychopharmacology. 2002;26:311-324.
36. Santana N, Bortolozzi A, Serrats J, Guadalupe M, Artigas F. Expression of serotonin 1A and serotonin 2A receptor in pyramidal and GABAergic neurons of the rat prefrontal cortex. Cereb Cortex. 2004;14:1100-1109.
37. Invernizzi RW, Pierucci M, Calcagno E, et al. Selective activation of 5HT2C receptors stimulates GABA-ergic function in the rat substantia nigra pars reticulate: a combined in vivo electrophysiological and neurochemical study. Neuroscience. 2007;144:1523-1535.
38. Abi-Saab WM, Bubser M, Roth RH, Deutch AY. 5HT2 receptor regulation of extracellular GABA levels in the prefrontal cortex. Neuropsychopharmacology. 1999;20:92-96.
39. Lemaire V, Benquet C, LeGarrec D, Robertson S, Smith D, Stahl SM. Modeling and simulation to optimize efficacy and tolerability for once a day trazodone formulation. Abstract presented at: The European College of Neuropsychopharmacology meeting; September 12-16, 2009; Istanbul, Turkey.
40. Monteleone P, Gnocchi G, Delrio G. Plasma trazodone concentrations and clinical response in elderly depressed patients: a preliminary study. J Clin Psychopharmacol. 1989;9:284-287.
41. Sheehan DV, Croft HA, Gossen R, et al. Extended release trazodone in major depressive disorder: a randomized, double blind, placebo-controlled study. Psychiatry (Edgemont). 2009;6:20-33.
42. Gartlehner G, Gaynes BN, Hansen RA, et al. Comparative benefits and harms of second-generation antidepressants: background paper for the American College of Physicians. Ann Intern Med. 2008;149:734-750.
43. Papakostas GI, Fava M. A meta-analysis of clinical trials comparing the serotonin (5HT)-2 receptor antagonists trazodone and nefazodone with selective serotonin reuptake inhibitors for the treatment of major depressive disorder. Eur Psychiatry. 2007:22:444-447.

/37.jpg)