Журнал «Здоровье ребенка» 1 (22) 2010
Вернуться к номеру
Роль современных методов визуализации в диагностике сложных врожденных пороков сердца у детей
Авторы: Сухарева Г.Э.*, Емец И.Н.**, Каладзе Н.Н.*, Руденко Н.Н.**, Ялынская Т.А.**, Рокицкая Н.В.**, *Кафедра педиатрии ФПО с курсом физиотерапии Крымского государственного медицинского университета им. С.И. Георгиевского, г. Симферополь, **Научно-практический медицинский центр детской кардиологии и кардиохирургии МЗ Украины, г. Киев
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье представлены современные подходы к визуализационной диагностике врожденных пороков сердца (ВПС) у детей. Показана роль рентгеновской компьютерной томографии с внутривенным контрастированием в диагностике врожденной сердечно-сосудистой патологии и произведена качественная оценка КТ-ангиографической картины сложных ВПС у 45 больных.
Врожденные пороки сердца, дети, компьютерная томография.
Хирургия — это корона медицины,
но самый яркий бриллиант в этой короне — рентгенология.
А.Н. Бакулев
Хирургия врожденных пороков сердца (ВПС) направлена на возможно более раннюю их диагностику и радикальную коррекцию, особенно тех пороков, при которых естественное течение заболевания приводит к ранней смерти ребенка. Поэтому в современной кардиологии и кардиохирургии постоянно идет поиск оптимальных алгоритмов использования различных методов медицинской визуализации, которые отличались бы прежде всего высокой информативностью и наименьшей инвазивностью.
В настоящее время в кардиологических и кардиохирургических клиниках используется достаточно обширный арсенал методов диагностики ВПС. Каждый из них обладает как преимуществами, так и недостатками. Рентгенография грудной клетки, традиционно широко использующаяся в предоперационном обследовании, по существу, не дает достоверных морфометрических показателей сердца и сосудов. Эхокардиография, бесспорно, в настоящее время самая распространенная, неинвазивная и относительно доступная методика исследования сердца при ВПС. Но, помимо технических ЭхоКГ-ограничений, особую роль приобретают так называемые субъективные факторы. Несмотря на все технологические новинки, ЭхоКГ остается во многом «оператор-зависимой» технологией визуализации. Катетеризация полостей сердца и ангиокардиография — золотой до недавнего времени стандарт в диагностике ВПС, в настоящее время уже таковым не является. Кроме всех хирургических рисков, особенно актуальных у новорожденных и детей раннего возраста, высокой степени инвазии, в том числе и радиационного плана, внутрисердечное введение контрастного вещества нередко усугубляет тяжесть состояния пациента. В связи с этим вполне понятен интерес кардиологов к поиску более информативных, чувствительных, а также менее инвазивных методов диагностики ВПС. Одним из наиболее перспективных в этом плане методов является рентгеновская компьютерная томография (РКТ) [2–4, 7, 9].
В основе РКТ лежит вычисление коэффициентов линейного ослабления рентгеновского излучения в каждой конкретной точке объема, имеющей известные координаты, при использовании, как правило, аксиальных проекций при сканировании объекта. Появление РКТ связано прежде всего с работой 1962 года Е. Kuhl и P. Edwards по использованию математической реконструкции для получения трансаксиального изображения черепа. Однако окончательным своим появлением РКТ обязана инженеру электроники англичанину G. Hounsfield и профессору математики А. М. Cormack, которые независимо друг от друга предложили идею нового метода получения изображения. В 1979 году это открытие было удостоено Нобелевской премии. На основании этих работ в 1970 году был создан первый компьютерный томограф для исследования головного мозга. Однако исследования сердца на таких томографах были практически невозможны из-за технологического конфликта между скоростью сканирования и скоростью сокращения сердца, приводящего к появлению ярко выраженных артефактов движения. Прорывом в этом направлении стало изобретение в начале 1980-х годов сверхбыстрой компьютерной томографии с возможностью синхронизации сканирования с сердечным ритмом пациента (ЭКГ-синхронизация). Синхронизация с ЭКГ требует больше времени и тем самым увеличивает облучение пациента. 4D-данные, полученные при синхронизации с ЭКГ, можно использовать для получения информации при движениях сердца и благодаря этому оценить его функциональные показатели.
Идея методики принадлежит доктору D. Boyd из Калифорнийского университета. Однако электронно-лучевая КТ, которую еще называют сверхбыстрой КТ, не получила широкого применения, за исключением определения количества коронарного кальция, так как стоимость такого томографа была слишком высокой и при этом на нем возможно было лишь «заморозить» движение сердца. Многосрезовая КТ, несмотря на ее короткую историю, получила быстрое признание. Это можно объяснить ее высокой разрешающей способностью, а также тем, что такие томографы имеют общее назначение и в том числе могут использоваться для изучения сердца. С этого времени начинается бурное, практически революционное развитие быстрых и сверхбыстрых технологий компьютерной томографии, что наряду с обширными возможностями компьютерной обработки диагностических изображений обусловило лавинообразный интерес кардиологов и кардиохирургов во всем мире. Также лавинообразно растет число научных публикаций по использованию данных технологий в диагностике разнообразной патологии сердца и сосудов у взрослых [5, 6, 11–13]. Вместе с тем очень мало сообщений о применении этой методики в Украине при изучении ВПС у детей, и особенно детей раннего возраста и новорожденных [1, 10, 14].
Интерес кардиологов и кардиохирургов к РКТ вызван прежде всего наглядностью и относительной простотой получения изображений сердца и сосудов. Во-первых, РКТ дает возможность одномоментного изучения сердца и грудной клетки в целом. Во-вторых, благодаря высокой пространственной разрешающей способности, широкому полю визуализации РКТ позволяет с высокой точностью получить достоверные морфометрические показатели не только магистральных и периферических сосудов, но и внутрисердечных структур. В-третьих, применение РКТ позволяет быстро построить мультипланарные реконструкции и трехмерные изображения, близкие и понятные врачам разных специальностей [4]. Недостатком метода является то, что РКТ требует введения контрастных препаратов и несет лучевую нагрузку. Спиральная компьютерная томография с внутривенным болюсным контрастированием революционно изменила лучевую диагностику патологии сосудов. В 90-х годах прошлого века впервые появилась реальная возможность использования неинвазивного по характеру исследования сосудистого русла, превышающего по информативности рентгеноконтрастную ангиокардиографию [8, 15].
Поэтому нам представляется крайне актуальным и весьма перспективным изучение роли рентгеновской компьютерной томографии с внутривенным контрастированием в диагностике ВПС у детей.
Цель: оценить значение РКТ с внутривенным контрастированием для дифференциальной диагностики сложных ВПС на этапе предоперационной подготовки, выбора хирургической тактики, а также для диагностики осложнений, в том числе послеоперационных.
Задачи: определить роль и место РКТ в общем ряду инструментальных методов диагностики врожденной патологии сердечно-сосудистой системы, изучить КТ-семиотику некоторых сложных врожденных пороков сердца у детей, в том числе детей раннего возраста и новорожденных.
Материалы и методы
В отделениях Республиканской детской клинической больницы (г. Симферополь) под нашим наблюдением находилось 45 детей в возрасте от 0 до 18 лет с ВПС, которым в течение 2006–2009 гг. в Научно-практическом центре детской кардиологии и кардиохирургии МЗ Украины (г. Киев) было проведено хирургическое лечение. Наблюдения охватывают дооперационный и отдаленный послеоперационный периоды.
Всем детям было проведено общеклиническое обследование. Функциональные методы обследования включали: ЭКГ, ХМЭКГ, рентгенографию органов грудной клетки, ДЭхоКГ. Эхокардиографию проводили с помощью аппарата HDI-1500 (ATL) неоднократно до и в различные сроки после операции. В Научно-практическом центре детской кардиологии и кардиохирургии МЗ Украины (г. Киев) детям была проведена рентгеновская компьютерная томография с внутривенным контрастированием (ангио-КТ). Использовался 16-срезовый компьютерный томограф Somatom Sensatiоn 16 фирмы Siemens AG (Германия) в комплекте с системами цифровой обработки, рабочими станциями Wizard и Leonardo. Оценка внутрисердечной анатомии или функции сердца, как и возможность построения различного рода реконструкций изображения сердца или его структур, возможна только при КТ с внутривенным контрастированием. Методика введения контрастного препарата и его дозировки до настоящего времени совершенствуются. В наших исследованиях проводилось внутривенное болюсное введение контрастного вещества (использовались неионные йодсодержащие контрасты из расчета 1,8–2,0 мл/кг массы тела ребенка). Все исследования у детей раннего возраста выполнялись на фоне медикаментозной седации. Последующая постпроцессинговая обработка полученных данных проводилась на рабочей станции с применением стандартного пакета программ для графической обработки изображений. Анализ изображений, полученных при рентгеновской компьютерной ангиографии, включал изучение анатомии порока по аксиальным томограммам, а также построение мультипланарных реконструкций в проекциях, подобных используемым при ангиографии и ЭхоКГ.
Результаты, обсуждение
Под нашим наблюдением находилось 45 детей со сложными ВПС, которые требовали уточнения топики порока при неадекватной эхо-визуализации сердца. Среди обследованных было выявлено: тетрада Фалло (ТФ) — 21 случай (46,7 %), коарктация аорты (КоА) — 17 случаев (37,7 %), единственный желудочек сердца (ЕЖС) — 3 ребенка (6,8 %), атрезия легочной артерии (ЛА) — 2 ребенка (4,4 %), общий артериальный ствол (ОАС) — 2 ребенка (4,4 %).
С тетрадой Фалло был обследован 21 (46,7 %) пациент. Крайняя форма ТФ с атрезией ЛА наблюдалась у 3 (14,3 %) детей. Преобладали (75 %) мальчики. У пациентов с ТФ на этапе предоперационной подготовки крайне важно оценить морфометрию ЛА, морфологию выводного отдела правого желудочка и объемы как правого, так и левого желудочка. Это особенно важно для выбора тактики хирургического вмешательства — выполнения ранней радикальной или вначале гемодинамической коррекции порока. Для ранней радикальной коррекции ТФ необходимо оценить степень гипоплазии легочного сосудистого русла. Легочные артерии оценивали как на аксиальных, так и на мультипланарных реконструкциях, анализ полученных изображений включал в себя изучение клапана и ствола ЛА, уровня бифуркации ствола, правой и левой ЛА, изучались проксимальные и дистальные отделы ЛА и уровень бифуркации ЛА на первые долевые ветви. Гипоплазия ствола и ветвей ЛА выявлена в 52 % случаев, атрезия ЛА с гипоплазией ствола ЛА — в 3 случаях. У 2 пациентов с атрезией ЛА определялось наличие больших аортолегочных коллатеральных артерий, отходящих от нисходящей аорты и идущих к корню левого или правого легкого. В 10 % случаев определялся функционирующий системно-легочный анастомоз. В двух случаях выявлены аберрантные подключичные артерии. Метод РКТ с внутривенным болюсным контрастированием во всех наших наблюдениях позволил визуализировать всю систему легочных артерий, проксимальные и дистальные отделы, дополнительные аортолегочные коллатерали, врожденные аномалии отхождения сосудов головы и шеи. Иллюстрацией может служить следующий клинический пример.
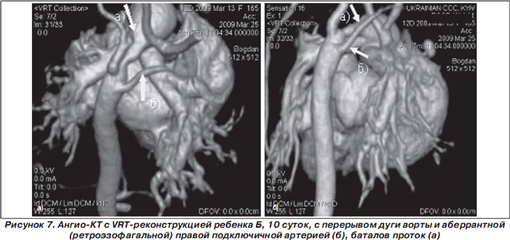
Ребенок В., 7 лет. Наблюдается у детского кардиолога с рождения с диагнозом: тетрада Фалло, бледная форма. Выраженный инфундибулярный и клапанный стеноз легочной артерии. Фетальный алкогольный синдром. Ребенок из социально неблагополучной семьи (на протяжении нескольких лет родители отказывались от операции). Состояние девочки прогрессивно ухудшалось, и в возрасте 6 лет она поступила в НПМЦ ДКК МЗ Украины для хирургической коррекции ВПС. На этапе предоперационной подготовки девочке была проведена РКТ органов грудной полости с внутривенным контрастированием, которая выявила наличие левой аберрантной подключичной артерии с образованием сосудистого кольца. Дополнительная левосторонняя верхняя полая вена впадала в коронарный синус. Диаметр легочного ствола 1,35 см . Диаметр правой ЛА — 0,75 см , диаметр левой ЛА в среднем отделе — 0,7 см , у места бифуркации сужена до 0,53 см (рис. 1а). Первой от дуги аорты отходит левая сонная артерия, проходит спереди от трахеи, второй — правая общая сонная артерия, третьей — подключичная артерия, четвертой — левая подключичная артерия, проходящая позади трахеи и пищевода (рис. 1б). Таким образом, у ребенка была уточнена анатомия тетрады Фалло и выявлена врожденная аномалия прекраниальных сосудов, что очень важно для кардиохирурга на этапе хирургического вмешательства.
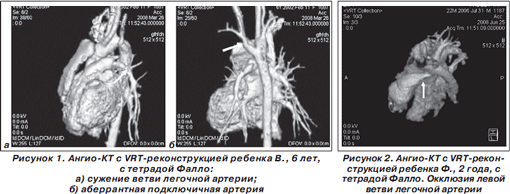
В послеоперационном периоде (по показаниям) помимо анатомии порока и морфометрических показателей сердца оценивалась проходимость системно-легочного анастомоза, выявлялись послеоперационные осложнения, что иллюстрирует следующий клинический пример.
Ребенку Ф., 3,5 года, с диагнозом «тетрада Фалло с гипоплазией клапана, ствола ЛА» в возрасте 2 месяцев была проведена РЭД клапана и ствола, в возрасте 7 месяцев — радикальная коррекция тетрады Фалло: инфундибулэктомия, заплата из аутоперикарда на левую ветвь, ствол ЛА. Однако состояние ребенка значительно не улучшилось, систолический градиент на ЛА возрос до 70 мм рт.ст. В возрасте 1,5 года он вновь был обследован с проведением РКТ с в/в контрастированием: диаметр легочного ствола в проксимальных отделах 1,25 см , дистальнее — 0,55 см. Диаметр правой ЛА — 0,88 см , долевые ветви расширены, левая ветвь ЛА не контрастируется. Легочный рисунок слева резко обеднен, справа усилен за счет артериальных ветвей. Таким образом, у больного при ангио-КТ был выявлен стеноз левой ветви легочной артерии, что повлияло на дальнейшую тактику хирургического лечения. Ребенку было выполнено стентирование ЛА с хорошим результатом (рис. 2).
РКТ играет важную роль в диагностике критических ВПС у новорожденных, например атрезии легочной артерии.
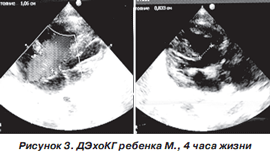
Клинический пример. Ребенок М., 5 часов жизни. Ребенок от 2-й беременности, протекавшей на фоне гипоплазии плаценты, многоводия.
Старшему ребенку 10 месяцев, здоров. Пренатально у плода был диагностирован ВПС, однако от дальнейшего обследования в условиях экспертной клиники (НПМЦ ДКК МЗ Украины) и родов в условиях родильного дома, приближенного к кардиохирургическому центру, семья отказалась. Роды в срок, физиологические. Масса при рождении 3380 г , состояние по шкале Апгар оценено в 8–9 баллов. Учитывая пренатально диагностированный ВПС, роды были проведены по месту жительства в специализированном родильном доме и беременная находилась под особым наблюдением акушеров-гинекологов и детских кардиологов. Это позволило оперативно перевести новорожденного в отделение реанимации, так как через 2 часа после рождения состояние ребенка ухудшилось до тяжелого: появился цианоз, снизилась сатурация О 2 до 84 %, гипероксидный тест отрицательный. Было проведено ДЭхоКГ-исследование (рис. 3), после которого, тем не менее, не был сформулирован окончательный диагноз: нельзя исключить атрезию ЛА I типа? Общий артериальный ствол I типа?
В возрасте 1 суток ребенок был переведен в НПМЦ ДКК МЗ Украины, где ему была проведена РКТ, которая позволила определить дальнейшую тактику ведения пациента: атрезия легочной артерии I–II типа. Определяются четыре большие аортолегочные коллатерали (MAPCA) — две к правому и две к левому легкому (рис. 4).
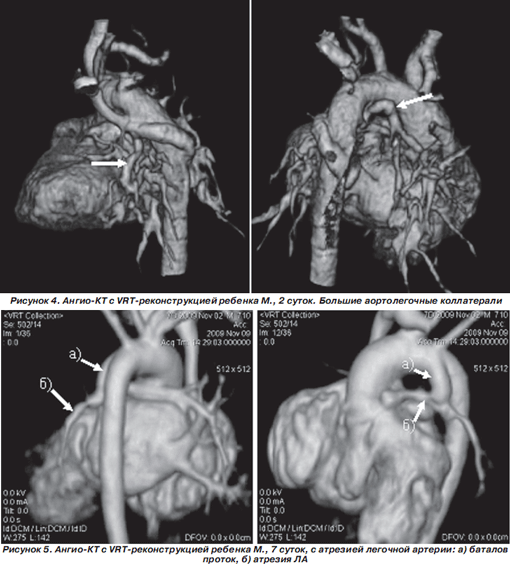
Таким образом, учитывая наличие больших коллатералей, экстренное хирургическое вмешательство ребенку не проводилось.
Клинический пример. Ребенок М., 1 сутки жизни. Диагноз атрезии ЛА был выставлен пренатально. Роды в специализированном родильном доме (г. Киев). В первые сутки переведен в кардиохирургический центр, где для уточнения анатомии и физиологии ВПС проведена РКТ, которая подтвердила диагноз «атрезия ЛА II типа» (рис. 5), и ребенку экстренно был выполнен правосторонний модифицированный анастомоз Блелока — Тауссиг.
Данные примеры показывают, как у двух новорожденных при одинаковом диагнозе (атрезия легочной артерии) благодаря проведенной на этапе предоперационной диагностики РКТ была выбрана различная тактика ведения пациента.
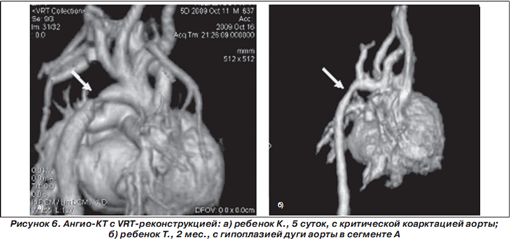
Большую роль играет РКТ также в диагностике патологии дуги аорты для уточнения анатомии дуги аорты, врожденной патологии сосудов головы и шеи, аномалий ствола, ветвей ЛА и др. Патология дуги аорты включает: КоА, перерыв дуги аорты, двойную дугу аорты, гипоплазию дуги аорты. Под нашим наблюдением было 17 (37,6 %) детей с патологией дуги аорты (16 — с КоА (рис. 6а) и 1 ребенок — с перерывом дуги аорты (рис. 7)), которым на до- и некоторым детям на послеоперационном этапе была выполнена РКТ. В результате обследования было выявлено: в 18 % случаев КоА сопровождалась гипоплазией различных сегментов дуги аорты (рис. 6б), в 42 % случаев выявлен аномальный ход сосудов головы и шеи. У одного ребенка была диагностирована агенезия левой почки.
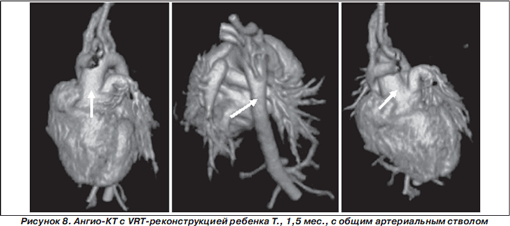
Сложность для ЭхоКГ-визуализации представляет такой ВПС, как общий артериальный ствол — порок конотрункуса, при котором от основания сердца отходит один сосуд, обеспечивающий системное, легочное и коронарное кровообращение. На этапе хирургической коррекции кардиохирургу крайне необходимо знание анатомических вариантов данного порока, в чем неоценима роль рентгеновской компьютерной томографии. Мы наблюдали 2 (4,4 %) детей с ОАС (рис. 8).
Единственный желудочек сердца относится к числу наиболее сложных и клинически тяжело протекающих ВПС. Характерной его особенностью является нарушение соединения предсердий с желудочками, когда предсердия соединяются лишь с одним, хорошо развитым и доминирующим желудочком. ЕЖС является сложным ВПС, имеющим разнообразные анатомические варианты, топическая диагностика которых с помощью ангио-КТ чрезвычайно важна для выбора тактики гемодинамической коррекции данной патологии, а также для оценки результатов хирургического лечения. Под наблюдением было 3 (6,7 %) ребенка с ЕЖС.
Клинический пример. Ребенок К., 13 лет. В первые месяцы жизни был поставлен диагноз: Нeterotaxy syndrome, situs ambiguous, asplenia. Единственный желудочек сердца. Полная атриовентрикулярная коммуникация, несбалансированная форма; двойное отхождение магистральных сосудов от ПЖ с гипоплазией ствола ЛА. Неоднократно обследовался в кардиохирургических клиниках. В возрасте 3 лет в США был выполнен двусторонний анастомоз Глена, в возрасте 6 лет — проведена операция Фонтена в модификации с экстракардиальным кондуитом (рис. 9).
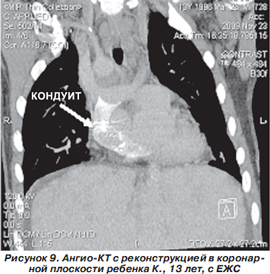
В данном примере применение РКТ позволило оценить функцию кондуита.
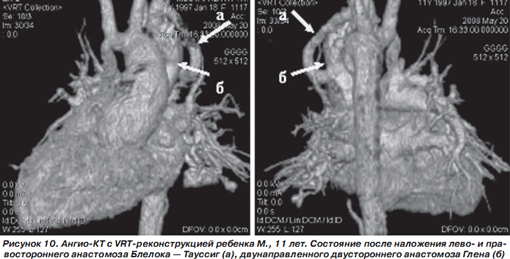
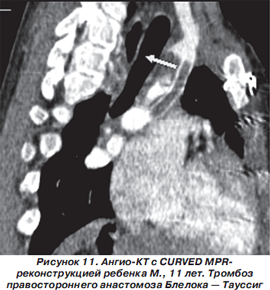
Клинический пример. Ребенок М., 11 лет. Диагноз : Н eterotaxy syndrome, situs viscerus inversus, asplenia. Единственный желудочек сердца. Полная атриовентрикулярная коммуникация. Атрезия ЛА II типа. С рождения находит ся под наблюдением детского кардиолога. В возрасте 3 недель ребенку был выполнен правосторонний анастомоз Блелока — Тауссиг, затем в возрасте 2 лет — двусторонний двунаправленный анастомоз Глена (рис. 10). Состояние девочки на протяжении нескольких лет было компенсированным, однако в последнее время резко ухудшилось, что потребовало углубленного обследования с проведением ангио-КТ. Было установлено, что правосторонний анастомоз между брахиоцефальным стволом (на уровне отхождения правой подключичной артерии) и правой ЛА не функционирует, в просвете определяется тромб (рис. 11). Анастомоз Глена — без особенностей. Таким образом, выявленный при исследовании тромбоз правостороннего анастомоза определил дальнейшую тактику лечения ребенка: больной было проведено наложение левостороннего анастомоза Блелока — Тауссиг. В настоящее время состояние девочки компенсированное.
Таким образом, рентгеновская компьютерная томография с внутривенным контрастированием в последние годы составила серьезную конкуренцию инвазивным рентгеновским методам диагностики врожденных аномалий сердечно-сосудистой системы у детей, а также диагностики осложнений, в том числе послеоперационных. Наш опыт применения рентгеновской компьютерной томографии при обследовании детей, особенно грудного и раннего возраста, со сложными ВПС показывает, что метод в большинстве случаев может дать более ценную диагностическую информацию, чем традиционный комплекс исследований, включающий рентгенографию, эхокардиографию и катетерную ангиокардиографию. Это касается детализации анатомии порока, достоверных морфометрических показателей, уточнения взаиморасположения органов средостения, а также оценки состояния сосудов малого круга кровообращения, бронхиального дерева и паренхимы легких. «Компьютерная томография стала рабочей лошадью рентгенологии наших дней» (R. Baron).
Заключение
Рентгеновская компьютерная томография с внутривенным контрастированием — современный высокоинформативный неинвазивный метод диагностики врожденной патологии сердечно-сосудистой системы у детей, дифференциальной диагностики и верификации анатомических вариантов, качественной оценки послеоперационных результатов, а также диагностики осложнений, в том числе послеоперационных. Рентгеновская компьютерная томография предоставляет возможность одномоментной комплексной оценки анатомии сердца с крупными сосудами и бронхолегочной патологии.
1. Вишнякова М.В. Комплексное рентгенологическое исследование детей первого года жизни с врожденными пороками сердца и сопутствующими поражениями легких: Автореф. дис... д-ра мед. наук. — М., 2005. — 55 с.
2. Габуния Р.И., Колесникова Е.К. Компьютерная томография в клинической диагностике. — М.: Медицина, 1995. — 96 с.
3. Габуния Р.И., Колесникова Е.К. Основы компьютерной томографии // Клиническая рентгенорадиология. — М.: Медицина, 1985. — Т. 4. — С. 281-353.
4. Кармазановский Г.Г. Компьютерная томография — основа мощи современной рентгенологии // Медицинская визуализация. — 2005. — № 6. — С. 139-143.
5. Келендер В. Компьютерная томография. Основы, техника, качество изображений и области клинического использования. — М.: Техносфера, 2006. — 62 с.
6. Макаренко В.Н. Диагностика хирургических заболеваний аорты и ее ветвей при помощи спиральной компьютерной томографии: Автореф. дис... д-ра мед. наук. — М., 2001. — 35 с.
7. Позмогов А.И., Терновой С.К., Бабий А.С., Лепихин Н.М. Томография грудной клетки. — Киев: Здоровье, 1992. — С. 288.
8. Прокоп М., Галански М. Спиральная и многослойная компьютерная томография: Учебное пособие: В 2 т.: Пер. с англ. — М.: МЕДпресс-информ, 2006. — Т. 1.
9. Хофер М. Компьютерная томография: базовое руководство: Пер. с англ. / Под ред. Г.Е. Труфанова. — М.: Мед. лит., 2006. — 367 с.
10. Юрпольская Л.А., Макаренко В.Н., Бокерия Л.А. Лучевая диагностика врожденных пороков сердца и сосудов. Этапы эволюции от классической рентгенологии до современных методов компьютерной томографии // Детские болезни сердца и сосудов. — 2007. — № 3. — С. 17-28.
11. Bean M.J., Pannu H., Fishman E.K. Three-dimensional computed tomographic imaging of complex congenital cardiovascular abnormalities // J. Comput. Assist. Tomogr. — 2005. — 29. — 721-4.
12. Cademartiri F. Cardiac CT: the missing of the puzzle // J. European. radiology. — 2009. — V. 19(11). — P. 2584-2595.
13. Goo H.W., Park I.S., Ko J.K. et al. CT of congenital heart disease: normal anatomy and typical pathologic conditions // Radiographics. — 2003. — 23. — S147-65.
14. Kawano T., Ishii M., Takagi J. et al. Three-dimensional helical computed tomographic angiography in neonates and infants with complex congenital heart disease // Am. Heart. J. — 2000. — 139. — 654-60.
15. Kuiper J.W., Geleijns J., Matheijssen N.A. et al. Radiation exposure of multi-row detector spiral computed tomography of the pulmonary arteries: comparison with digital subtraction pulmonary angiography // Eur. Radiol. — 2003. — 13. — 1496-500.
