Журнал «Здоровье ребенка» 1 (22) 2010
Вернуться к номеру
Значение определения асимметричного диметиларгинина при хроническом заболевании почек у детей
Авторы: Одинец Ю.В., Кононенко Е.В., Харьковский национальный медицинский университет
Рубрики: Педиатрия/Неонатология
Версия для печати
С целью изучения наличия асимметричного диметиларгинина в плазме крови и его возможного влияния на течение болезней почек у детей было обследовано 80 детей с различными острыми и хроническими заболеваниями почек, основную часть которых составили больные с острыми и хроническими гломерулонефритами — 50 детей, а также 30 детей, которые составили контрольную группу. Оценивались уровни асимметричного диметиларгинина, оксида азота по уровням стабильных метаболитов нитрита и нитрата, функциональное состояние почек по уровню креатинина крови и скорости клубочковой фильтрации, уровень общих фосфолипидов и коэффициент атерогенности. Выявлено повышение уровня асимметричного диметиларгинина, а также его возможная причастность к прогрессированию заболеваний почек у детей.
Асимметричный диметиларгинин, хроническое заболевание почек, дети.
Введение
На сегодняшний день заболевания почек занимают одно из ведущих мест в структуре заболеваемости у детей. В последние десятилетия наблюдается фактическое увеличение количества больных с хронической почечной патологией именно в педиатрической практике, постоянно увеличивается количество заболеваний почек у детей на фоне врожденных патологий развития почек. Рост числа заболеваний такого характера можно объяснить общим ухудшением состояния окружающей среды, а также улучшением диагностики подобных заболеваний. Несвоевременное диагностирование подобной патологии может привести к развитию хронического заболевания почек (ХЗП). Актуальность проблемы повышается с учетом высокого риска формирования хронической почечной недостаточности (ХПН), что, в свою очередь приведет к дальнейшей инвалидности ребенка, невозможности для него вести нормальную жизнь. ХПН — конечная стадия заболеваний почек, частота которых составляет 5–6 % в структуре общей заболеваемости. По статистическим данным, число больных, страдающих ХПН, растет [3]. В настоящее время много внимания уделяется проблеме ранней диагностики ХЗП. Поздняя диагностика ХЗП непосредственно ассоциирована с более высокой смертностью, с более тяжелым течением сопутствующих состояний. Разработаны рекомендации для выявления ХЗП на ранних этапах, одной из задач разработки данных рекомендаций является раннее выявление латентно протекающих нефрологических заболеваний. Раннее выявление ХЗП позволяет замедлить прогрессирование нефропатии, а в ряде случаев даже предотвратить утрату функции почек. В настоящее время достигнуты значительные успехи в раскрытии патогенетических механизмов прогрессирования хронических заболеваний почек. При этом особое внимание уделяется так называемым неиммунным факторам (функционально-адаптивным, метаболическим и др.). Такие механизмы в той или иной степени действуют при хронических поражениях почек любой этиологии [7]. Пристального внимания заслуживает изучение эндотелиальной дисфункции как одного из звеньев формирования сердечно-сосудистого континуума у почечных больных.
Уже на ранних стадиях ХПН возникают нарушения электролитного состава крови, ацидоз, нарушается обмен белка в организме, задерживаются продукты обмена: мочевина, креатинин, мочевая кислота. На сегодняшний день выявлено более 200 веществ, обмен которых в организме нарушается при почечной недостаточности.
В 1992 году Р. Vallance впервые показал, что у больных терминальной ХПН значительно повышено содержание в плазме крови асимметричного диметиларгинина (АДМА) (рис. 1) — аминокислоты, являющейся эндогенным конкурентным ингибитором синтеза оксида азота (NO) [5]. AДMA вырабатывается во многих типах клеток, включая эндотелиальные [4], хотя до настоящего времени точные пути синтеза AДMA не были установлены. При этом симметричный диметиларгинин, стереоизомер AДMA, не оказывает прямого влияния на активность NO-синтаз (NOS). Деградация AДMA осуществляется при помощи внутриклеточного фермента диметиларгинин-диметиламиногидролазы, который метаболизирует АДМА в диметиламин и цитрулин, последний выводится почками. На основании данных о связи между повышением уровня AДMA и факторами риска атеросклероза — гиперхолестеринемией, повышенным уровнем артериального давления R. Boger [1, 2] высказал мысль, что AДMA — новый индуктор атеросклероза, возможно играющий одну из самых важных ролей в патогенезе эндотелиальной дисфункции. Содержание АДМА значительно повышается при терминальной ХПН у взрослых пациентов, его накопление способствует быстрому прогрессированию атеросклероза при ХЗП и ускоряет прогрессирование почечной недостаточности. Возможно, АДМА можно считать ранним предиктором ХПН, основываясь на его способности ускорять процессы атеросклероза и усиливать эндотелиальную дисфункцию путем снижения биодоступности NO, который, в свою очередь, обладает выраженными антисклеротическими свойствами [6]. У взрослых пациентов было показано участие АДМА в прогрессировании нефропатий. По данным литературы, у детей и подростков с нефропатиями исследования уровня АДМА не проводились, хотя ХЗП в детском возрасте нередко являются основными поставщиками инвалидизации и формирования ХПН, в том числе и терминальной.
Учитывая вышеизложенное, целью нашей работы явилось повышение эффективности и усовершенствование диагностики острых и хронических заболеваний почек у детей на ранних этапах на основании изучения в плазме крови уровня АДМА.
Материалы и методы
Нами обследовано 80 детей в возрасте от 4 месяцев до 17 лет (в среднем 10,99 ± 0,52 года): из них 32 девочки (40 %), 48 мальчиков (60 %) с различными синдромами острого (16), формами хронического (35), быстропрогрессирующим гломерулонефритом (3), хроническим пиелонефритом (10), интерстициальным нефритом (9), люпус-нефритом (2), с синдромом Альпорта (3), поликистозом почек (3), аномалией мочевыводящей системы (АМВС) (10). Из них у 56 детей (70 %) установлено наличие хронического заболевания почек, у 24 (30 %) детей диагностирован острый процесс, в том числе 3 детей с острой почечной недостаточностью. У 19 детей диагностирована ХПН разной степени, из них 6 детей с терминальной ХПН находились на программном гемодиализе. Причиной ХПН явились быстропрогрессирующий гломерулонефрит (2), хронический гломерулонефрит (ГХН) (6), наследственный нефрит (2), хронический пиелонефрит на фоне АМВС, в том числе поликистоза почек (6), СКВ (1), дисплазия почек (2). В среднем длительность заболевания составила 3,5 года (42,6 ± ± 5,8 мес.), при этом у 34 детей (42,5 %) длительность заболевания составила менее года, у 46 (57,5 %) — более года. Выделение данной группы продиктовано особенностями течения патологического процесса в почках, в частности гломерулонефритов, поскольку лишь к концу первого года можно предполагать о возможной хронизации заболевания. В процессе работы не установлено существенной разницы в основных параметрах функционального состояния, азотвыделительной функции почек, в показателях электролитов крови, протеинограммы и липидного спектра у детей разного возраста, поэтому мы сочли возможным объединить возрастные группы. Также была выделена группа детей с острыми (ОГН) и хроническими гломерулонефритами, так как данная патология встречалась чаще других — 50 случаев (62,5 %).
В контрольную группу были включены 30 соматически здоровых детей аналогичного возраста.
Больным проводился комплекс общеклинических исследований (анализы крови и мочи, суточная протеинурия, проба по Зимницкому), исследовался белковый (общий белок и белковые фракции), липидный (холестерин, b -липопротеиды, общие фосфолипиды) спектры крови, электролитный состав крови (Na, K), функция почек определялась по уровню мочевины, креатинина сыворотки крови и скорости клубочковой фильтрации (СКФ), рассчитанной по формуле Шварца. Также определялись концентрации АДМА методом высокоэффективной жидкостной хроматографии (жидкостный хроматограф «Милихром», длина волны — 340 нм, в изократическом режиме, для твердофазовой экстракции (очистки и концентрирования) применяли картриджи Abselut Nexus фирмы Varian); L-аргинина, S-нитрозотиола в плазме крови, уровень концентрации оксида азота в плазме крови по концентрации стабильных метаболитов нитрита (NO 2 ) и нитрата (NO 3 ) — калориметрическим методом, используя реактивы Грисса.
Результаты и обсуждение
Проведенный анализ содержания АДМА в плазме крови показал, что у детей основной группы, имеющих различные, как острые, так и хронические, заболевания почек, уровень АДМА в плазме крови колебался от 0,07 мкмоль/л до 0,65 мкмоль/л.
Концентрация АДМА в плазме крови детей с длительностью заболевания почек больше года имела тенденцию к повышению по сравнению с уровнем АДМА в крови у детей с длительностью заболевания менее года, соответственно, снижались концентрации L-аргинина, S-нитрозотиола, NO 2 и NO 3 , а также снижалось соотношение «L-аргинин/АДМА». Отмечено повышение уровня общих фосфолипидов у детей, страдающих заболеваниями почек более года (табл. 1).
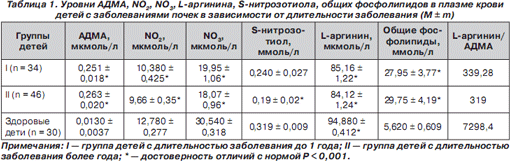
У детей с ОГН и ХГН данной закономерности не выявлено, что может быть обусловлено высокой активностью патологического процесса у детей с ОГН. Исключение составил уровень АДМА, который повышался у детей с ХГН, снижалось соотношение L-аргинин/АДМА, отмечалось повышение уровня общих фосфолипидов, что может быть обусловлено постепенным развитием атеросклероза и латентной хронизацией процесса у детей с ХГН (табл. 2).
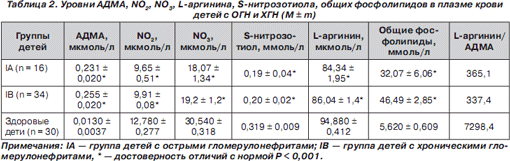
Обращало на себя внимание, что в основной группе детей по сравнению с контрольной уровень АДМА был значительно выше, уровень NO (по уровню стабильных метаболитов NO 2 и NO 3 ) и соотношение «L-аргинин/АДМА» — ниже, также был значительно выше нормы уровень общих фосфолипидов.
В результате обследования в I группе выявлена достоверная отрицательная корреляционная связь показателей плазменных концентраций АДМА и L-аргинина (r = –0,3, P < 0,05), концентраций АДМА и NO 2 (r = –0,46, P < 0,05), АДМА и NO 3 (r = –0,5, P < 0,05), отрицательная корреляционная связь показателей плазменных концентраций АДМА и S-нитрозотиола (r = –0,14, P < 0,05), АДМА и уровня креатинина (r = –0,24, P < 0,05); достоверная положительная корреляционная связь концентрации АДМА и уровня общих фосфолипидов (r = 0,40, P < 0,05), АДМА и СКФ (r = 0,32, P < 0,05), положительная корреляционная связь уровней АДМА и коэффициента атерогенности (КА) (r = 0,22, P < 0,05).
Во II группе отмечалась похожая тенденция: обратная зависимость уровней АДМА и L-аргинина (r = –0,44, P < 0,05), АДМА и NO 2 (r = –0,71, P < 0,05), АДМА и NO 3 (r = –0,67, P < 0,05), АДМА и S-нитрозотиола (r = –0,34, P < 0,05), АДМА и уровня креатинина (r = –0,2, P < 0,05), прямая зависимость концентрации АДМА и уровня общих фосфолипидов (r = 0,39, P < 0,05), АДМА и СКФ (r = 0,32, P < 0,05), уровней АДМА и суточной протеинурии (r = 0,43, P < 0,05). Похожие результаты были получены в группах детей с ОГН и ХГН.
С учетом вышеизложенных фактов проведено изучение взаимосвязи между уровнем эндогенного ингибитора синтеза NO — АДМА и факторами риска развития атеросклероза — общими фосфолипидами, коэффициентом атерогенности, АДМА и показателями функциональной способности почек (креатинином и СКФ), АДМА и фактором, являющимся маркером прогрессирования заболеваний почек — протеинурией. Показана зависимость уровней стабильных метаболитов NO от уровня АДМА, что подтверждает ингибирующее влияние данной аминокислоты на синтез NO, являющегося одним из основных антисклеротических и вазодилатирующих веществ. Также выявлена зависимость уровня АДМА, креатинина и СКФ, что может косвенно свидетельствовать о причастности АДМА к нарушению функции почек. Взаимосвязь уровней общих фосфолипидов, КА и АДМА может свидетельствовать о причастности АДМА к атеросклеротическому процессу, что, в свою очередь может вести к хронизации болезней почек. Повышение уровня АДМА, уровня общих фосфолипидов, снижение уровня стабильных метаболитов NO, S-нитрозотиола, соотношения «L-аргинин/АДМА» в группе детей, страдающих заболеванием почек более года, по сравнению с детьми, болеющими не более года, а также в группе детей с хроническими гломерулонефритами позволяет предположить участие АДМА в ускорении атеросклеротических процессов за счет угнетения cинтеза NO, следовательно, прогрессировании данных состояний. Также, учитывая повышение уровня АДМА в плазме крови детей с острыми процессами в почках, в частности, с острым гломерулонефритом, по сравнению с контрольной группой, можно предположить использование АДМА в качестве диагностического критерия этих состояний.
Выводы
1. Выявлено наличие АДМА в плазме крови детей с острыми и хроническими заболеваниями почек, уровень которого не зависит от возраста больного, однако зависит от длительности и остроты патологического процесса.
2. Наличие взаимосвязи уровня АДМА, уровня общих фосфолипидов крови и КА позволяет говорить о причастности данной аминокислоты к прогрессированию атеросклероза и возможной хронизации болезней почек у детей.
3. Повышение уровня АДМА может свидетельствовать о нарушении и степени нарушения функции почек, подтвержденными другими методами исследования.
4. Наличие положительной связи уровня АДМА и протеинурии как маркера прогрессирования нефропатий позволяет думать о причастности АДМА к прогрессированию данных состояний.
5. Выявленное изменение соотношения «L-аргинин/АДМА» дает основание полагать о возможной коррекции уровня АДМА путем увеличения данного соотношения за счет внешнего поступления L-аргинина в качестве лекарственного средства.
1. Boger R.H. Asymmetric dimethylarginine, an endogenous inhibitor of nitric oxide synthase, explains the «L-arginine paradox» and acts as a novel cardiovascular risk factor // Nutrition. — 2004. — Vol. 134. — P. 2842S-2847S.
2. Boger R.H., Sydow K., Borlak J. LDL cholesterol upregulates synthesis of asymmetrical dimethylarginine in human endothelial cells. Involvement of S-adenosylmethionine-dependent methyltransferases // Circ. Res. — 2000. — Vol. 87. — P. 99-105.
3. Expert from United States Renal States. Data System. 1999. Annual Date Report // Am. J. Kidney Dis. — 1999. — Vol. 34. — P. 10-176.
4. Landray M.J. Inflammation, Endothelial dysfunction and platelet activation in patients with chronic kidney disease: the chronic renal impairment in Birmingham (CRIB) // Study. Am. J. Kidney. Dis. — 2004. — Vol. 43. — P. 244-253.
5. Vallance P., Leone A., Calver A. et al. Accumulation of an endogenous inhibitor of nitric oxide synthesis in chronic renal failure // Lancet. — 1992. — Vol. 339. — P. 572-575.
6. Зотова И.В., Затейщиков Д.А., Сидоренко Б.А. Синтез оксида азота и развитие атеросклероза // Кардиология. — 2002. — № 4. — С. 58-67.
7. Іванов Д., Акчурін О. Хронічне захворювання нирок у дітей // Врачебная практика. — 2005. — № 2. — С. 27-33.
