Журнал «Здоровье ребенка» 1 (22) 2010
Вернуться к номеру
Антиоксидантный статус у детей, проживающих в экологически неблагоприятных условиях, и возможности его коррекции
Авторы: Нагорная Н.В., Четверик Н.А., Дубовая А.В., Федорова А.А., Муравская И.Ю., Донецкий национальный медицинский университет им. М. Горького
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье представлены данные о наличии оксидативного стресса и дисбаланса антиоксидантной системы у всех детей, проживающих в условиях влияния факторов экологически неблагоприятного региона. Выявлены эффективность 1-месячного курса Нейровитана в снижении уровня тканевой гипоксии и нормализации оксидативного баланса у детей 12–18 лет, сохранение достигнутого эффекта более чем 1 мес. у 72,0 ± 6,3 % чел., что доказывает целесообразность широкого применения препарата в первичной и вторичной профилактике экозависимой патологии у детей.
Оксидативный стресс, экологически неблагоприятные факторы, Нейровитан, дети.
Согласно результатам анализа статистических данных, за последние пять лет показатели заболеваемости населения Украины, в том числе и Донбасса, негативно изменились во всех возрастных группах по 18 из 19 классов болезней [2, 4, 5, 19]. По данным Е.М. Лукьяновой, уже 70 % дошкольников имеют различные нарушения состояния здоровья, при этом 30 % из них — хроническую патологию [6]. К моменту окончания школы только 8 % детей являются здоровыми. В.И. Агарков и соавт. [5], обследовав в Донбассе 402 школьника 14–17 лет, выявили у 91 % девочек и у 84 % мальчиков снижение физической работоспособности, напряженность антитоксических механизмов, иммунный дисбаланс.
Доказано, что среди причин, определяющих уровень заболеваемости, около 20 % составляют неблагоприятные факторы окружающей среды [3, 16]. В настоящее время, несмотря на уменьшение количества работающих предприятий, промышленные выбросы химических загрязнителей в атмосферу Украины достигают ежегодно около 11 млн тонн, что составляет 20–25 % суммарного выброса в целом по странам СНГ при условии, что наша страна занимает только 3 % ее территории. На одного жителя Украины приходится 300 кг вредных техногенных веществ в год [3]. Выявлено, что за последние десять лет значительно выросла доля автотранспорта в загрязнении окружающей среды, достигая в промышленных регионах 30–32 % [5]. В настоящее время в различных сферах промышленности используются более 70 элементов периодической системы, 43 из которых — тяжелые металлы. Значительный вклад в загрязнение окружающей среды вносит химизация сельского хозяйства [3]. Ежегодно в грунты Украины вносится 1 700 000 центнеров пестицидов, 150 000 центнеров минеральных удобрений. С ними поступают в почву 1800 тонн свинца, 400 тонн кадмия, 2200 тонн цинка, 200 тонн меди [4]. Обоснованную тревогу вызывает использование генетически модифицированных веществ, красителей, консервантов при производстве продуктов питания [6].
Остается актуальной проблема радиационного загрязнения различных областей Украины и его патогенного влияния на организм детей. Согласно данным исследования Ю.Г. Антипкина, у детей, проживающих в регионах с повышенным радиационным фоном, патология костной системы встречается в два раза чаще, чем у детей из «условно чистых» регионов [2].
Источником различных вредных веществ, попадающих в окружающий воздух, является табачный дым.
Попадая в организм через дыхательную и пищеварительную системы, кожу, многочисленные патогенные факторы оказывают разнообразные воздействия, одним из которых является образование большого числа активных форм кислорода, приводящих к развитию гипоксии и окислительного (оксидативного) стресса [25].
Как известно, при гипоксии снижается поступление кислорода в клетку и, как следствие, в митохондрии. В результате развивается нарушение митохондриального окисления, что приводит к разобщению сопряженного с ним фосфорилирования и, следовательно, вызывает прогрессирующий дефицит АТФ [8, 9, 20]. В условиях энергодефицита клетка поддерживает собственные энергетические потребности за счет активации процессов анаэробного гликолиза, который частично компенсирует недостаток АТФ, однако быстро вызывает накопление лактата и развитие ацидоза [12, 13]. При этом активизируется протеолиз, усиливается внутриклеточный ацидоз, что, в свою очередь, вызывает повреждение цитомембран, сопровождающееся инициацией перекисного окисления липидов (ПОЛ) и накоплением в жидких средах его продуктов: малонового диальдегида (МДА), диеновых и триеновых конъюгат, гидроперекисей липидов, диенкетонов. Результатами этого являются деструкция клеточных мембран, разрушение клеток и появление клинической симптоматики различных заболеваний [7, 8, 10, 11, 21].
Противостоит повышенной активности свободнорадикальных процессов в организме антиоксидантная система. Сохранение равновесия между этими двумя составляющими удерживает перекисное окисление на определенном уровне, препятствуя развитию цепной реакции окисления [1, 14, 25]. Без этой универсальной эндогенной системы защиты нормальное существование организма в условиях загрязненной атмосферы, естественного радиационного фона и ультрафиолетового излучения солнца было бы невозможным [14, 15].
Доказано, что ослабление антиоксидантной защиты и неконтролируемая активность процессов перекисного окисления липидов является одним из ведущих звеньев патогенеза атопического дерматита, патологии суставов, сахарного диабета, болезней желудочно-кишечного тракта, почек, органов зрения, вегетативной дисфункции, стоматологической патологии и др. [14, 22, 23, 24].
В связи с вышеуказанным целью настоящей работы явилось изучение показателей оксидативного стресса у детей, проживающих в экологически неблагоприятных условиях и поиск путей снижения его уровня.
Материалы и методы
На первом этапе было проведено комплексное обследование 50 школьников в возрасте 12–18 лет обоих полов (27 мальчиков и 23 девочки) из различных регионов Донецкой области. Дети были выбраны методом случайного отбора.
Общеклиническое обследование (визит 1, исходное состояние) включало углубленный сбор и анализ жалоб по специально разработанному опроснику с визуальной аналоговой 4-балльной шкалой, заполняемой врачом, где за 0 принимали отсутствие жалоб, а отметка 4 соответствовала максимальной степени проявления. Сведения об анамнезе получали по данным медицинской документации и у родителей.
Энергетическое состояние клеток оценивали по уровню лактата в плазме крови и активности лактатдегидрогеназы (ЛДГ) в эритроцитах. Об активности перекисного окисления липидов судили по изменению концентрации малонового диальдегида в плазме крови, об антиоксидантной защите — по уровню восстановленного глутатиона в эритроцитах (GSH). Забор материала и его исследование проводилось в сертифицированной клинико-диагностической лаборатории.
Для определения концентрации лактата и активности ЛДГ использовали колориметрический метод на автоматическом анализаторе (A.R. Henderson, 2001).
Содержание МДА в крови измеряли биохимическим методом по В.В. Рогожину, Т.Т. Курилюку (1998).
Восстановленный глутатион определяли спектрофотометрическим методом по Н. Beutler (1990).
Статистическую обработку результатов исследования проводили классическими математическими методами вариационной статистики с применением пакета анализа программы MedStat.
Результаты исследования и их обсуждение
Изучение жалоб свидетельствовало об их наличии у 78,0 ± 5,9 % чел., при этом 22 ребенка (44,0 ± 7,0 %) предъявляли их активно, у 17 детей (34,0 ± 6,7 %) нарушение самочувствия было выявлено при дополнительном опросе.
Сведения о характере и частоте жалоб у обследованных школьников представлены в табл. 1.
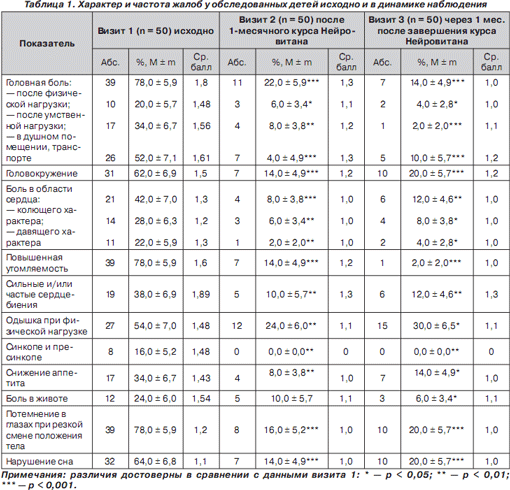
Как следует из табл. 1 (визит 1), наиболее частыми жалобами у детей были головная боль, потемнение в глазах при резкой смене положения тела и повышенная утомляемость, которые отмечали более 2/3 обследованных (78,0 ± 5,9), при этом цефалгии в душном помещении и транспорте беспокоили более половины учащихся (52,0 ± 7,1 %, средний балл качественной оценки — 1,61). Второй по частоте жалобой являлось нарушение сна (позднее засыпание, раннее пробуждение, беспокойный сон), наблюдавшееся у 64,0 ± 6,8 % детей (средний балл качественной оценки — 1,1). Третьей по частоте предъявляемой жалобой было головокружение (62,0 ± 6,9 % детей, средний балл качественной оценки — 1,5). Одышка при физической нагрузке беспокоила 54,0 ± 7,0 % учащихся (средний балл качественной оценки — 1,48), кардиалгии имели место у 42,0 ± 7,0 % обследованных (средний балл качественной оценки — 1,3), ощущения сердцебиений у 38,0 ± 6,9 % чел. (средний балл качественной оценки — 1,89), снижение аппетита — у 34,0 ± 6,7 % (средний балл качественной оценки — 1,43), боль в животе отмечали 24,0 ± 6,0 % чел. (средний балл качественной оценки — 1,54). Обращало внимание, что у 16,0 ± 5,2 % обследованных наблюдались синкопальные и пресинкопальные состояния.
Анализ анамнеза свидетельствовал о наличии у 27 (54,0 ± 7,0 %) чел. частых респираторных заболеваний. Очаги хронической инфекции имелись у 17 (34,0 ± 6,7 %) обследованных, при этом хронический тонзиллит — у 10 (20,0 ± 5,7 %) чел., хронический этмоидит — у 3 (6,0 ± 3,4 %) чел., множественный кариес — у 4 (8,0 ± 3,8 %) чел. На диспансерном учете по поводу вегетативной дисфункции по гипотензивному типу состояли 14 (28,0 ± 6,3 %) чел., по гипертензивному типу — 8 (16,0 ± 5,2 %) чел. Функциональную диспепсию в анамнезе имели 12 (24,0 ± 6,0 %) обследованных, патология органов зрения выявлена у 22 (44,0 ± 7,0 % чел., нарушение осанки — у 34 (68,0 ± 6,6 %) учащихся. Различные проявления соединительнотканной дисплазии установлены у 38 (76,0 ± 6,0 %) детей.
Результаты исследования показателей оксидантно-антиоксидантной системы представлены в табл. 2.
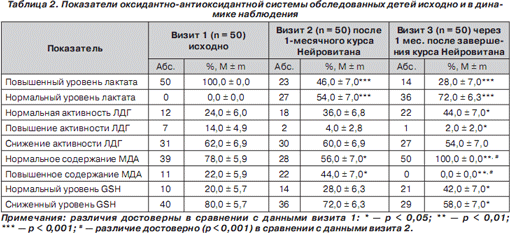
Как следует из табл. 2 (визит 1), исходно у всех детей выявлено повышение уровня лактата, свидетельствующее о наличии гипоксии тканей. Вместе с тем обращало внимание снижение активности ЛДГ у 62,0 ± 6,9 % обследованных, что отражает активизацию аэробного пути образования АТФ, замедление скорости анаэробного гликолиза и образования лактата.
У 22,0 ± 5,9 % школьников было повышено образование малонового диальдегида, что позволяло сделать вывод об усилении процессов перекисного окисления липидов. Важно отметить, что у 80,0 ± 5,7 % пациентов уровень восстановленного глутатиона был снижен, при этом у четверти обследованных (25,0 ± ± 8,2 %) более чем в 2 раза. Снижение содержания GSН в группе детей, проживающих в экологически неблагоприятном регионе, может быть обусловлено увеличением его потребления на метаболические процессы (защиту клетки от действия кислородных радикалов, липоперекисных процессов, окислительной модификации белков и др.), а также для обеспечения физиологического течения реакций, катализируемых глутатион-зависимыми ферментами, которые участвуют в утилизации перекиси водорода, липоперекисей и ксенобиотиков.
Достоверных различий в показателях оксидантно-антиоксидантной системы у детей c нарушениями самочувствия и без них не было.
На втором этапе в поиске путей снижения уровня оксидативного стресса наше внимание привлек препарат Нейровитан (регистрационное свидетельство № П.12.02/05583), в составе которого имеется SH-группа у альфа-липоевой кислоты, обладающая антиоксидативной активностью [18, 26]. Наряду с указанным Нейровитан содержит сбалансированный комплекс витаминов группы В (В 1 , В 2 , В 6 , В 12 ). Особенностью данного препарата является то, что он создан по уникальной технологии, благодаря которой каждый из компонентов, входящих в его состав, находится в микрокапсулах, не позволяющих витаминам взаимодействовать друг с другом, тем самым не вызывая нежелательные для организма пациента реакции [26, 27]. Нейровитан синтезирован компанией «Фуджисава Фармасьютикалз» (Япония), в Украине представлен компанией «Мегаком». Разрешен к применению с 3 лет [17, 27].
Все дети получали Нейровитан в возрастной дозе в течение 1 мес., после чего повторно исследовалось состояние энергетического обмена и антиоксидантной защиты клеток (визит 2), а для изучения сохранения полученного эффекта вышеуказанные показатели исследовали повторно через 1 мес. после завершения курса (визит 3).
Статистическую обработку результатов исследования проводили классическими математическими методами вариационной статистики с применением пакета анализа программы MedStat.
Как следует из табл. 1 (визит 2), после проведенного курса Нейровитана отмечено достоверное улучшение показателей самочувствия у детей: в 3,5 раза уменьшилось количество жалоб на цефалгии (78,0 ± 5,9 % и 22,0 ± 5,9 %, р < 0,001), в 4,4 раза — на головокружение и потемнение в глазах при резкой смене положения тела (62,0 ± 6,9 % и 14,0 ± 4,9 %, р < 0,001); в 5,6 раза уменьшилось количество учащихся со сниженной работоспособностью (14,0 ± 4,9 % и 78,0 ± 5,9 %, р < 0,001), в 5,25 раза уменьшилось количество детей с жалобами на кардиалгии (42,0 ± 7,0 % и 8,0 ± 3,8 %, р < 0,001), в 3,8 раза — на приступы учащенного сердцебиения и одышку при физической нагрузке (38,0 ± 6,9 % и 10,0 ± 5,7 %, р < 0,01). В 4,5 раза уменьшилось количество детей со сниженным аппетитом (34,0 ± 6,7 % и 8,0 ± 3,8 %, р < 0,01), в 2,4 раза реже беспокоил болевой абдоминальный синдром (24,0 ± 6,0 % и 10,0 ± 5,7 %, р < 0,05), улучшение сна отметили 50,0 ± 7,1 % учащихся, р < 0,001. Синкопальных состояний за период наблюдения не было.
Вместе с тем уменьшилась не только количественная, но и качественная характеристика жалоб (средний балл визуальной аналоговой шкалы уменьшился по каждому показателю на 30–40 %).
Динамика показателей оксидативного стресса представлена в табл. 2.
Как видно из табл. 2 (визит 2), отмечено достоверное изменение показателей оксидативного стресса. Так, количество детей с тканевой гипоксией уменьшилось в 2,2 раза (100,0 % и 46,0 ± 7,0 % соответственно, р < 0,001). Важно отметить, что после приема Нейровитана концентрация лактата достоверно снизилась у всех пациентов (р < 0,001), а в течение последующего месяца его уровень нормализовался еще у 18,0 ± 7,0 % обследованных. Обращало внимание, что снижение уровня лактата у 68,2 ± 9,9 % чел. сопровождалось снижением ЛДГ, а у 27,3 ± 9,5 % — его нормализацией, что свидетельствует о более рациональном использовании лактата в процессах глюконеогенеза и аминокислотного обмена.
На фоне приема Нейровитана в 2 раза увеличилось количество детей с повышенным уровнем МДА (22,0 ± 5,9 % и 44,0 ± 7,0 % соответственно, р < 0,05) и практически не изменилось количество учащихся с низким уровнем GSH (80,0 ± 5,7 % и 72,0 ± 6,3 % соответственно). Мы интерпретировали это следующим образом: повышение энергетического обмена привело к реперфузионным явлениям, способствующим повышенному образованию активных форм кислорода, обезвреживание которых не смог обеспечить исходно низкий уровень восстановленного глутатиона.
Нами констатировано, что полученный положительный эффект Нейровитана сохранялся в течение более чем 1 месяца у 72,0 ± 6,3 % обследованных детей.
Во время лечения Нейровитаном нежелательных побочных эффектов не выявлено. Во всех случаях детьми и их родителями отмечена хорошая переносимость препарата и удобство его применения, дана положительная оценка результатам лечения, что отражено в специально разработанной анкете «Оценка эффективности и удовлетворенности пациента лечением».
Таким образом, результаты проведенного исследования выявили наличие оксидативного стресса и дисбаланса антиоксидантной системы у всех детей, проживающих в условиях экологически неблагоприятного региона Донбасса. Снижение уровня лактат-ацидоза у 100 % обследованных, нормализация оксидативного баланса у 54,0 ± 7,0 % учащихся свидетельствуют о позитивном влиянии Нейровитана на энергетический обмен клеток. Указанное, а также длительное сохранение эффекта, полученного от 1-месячного курса Нейровитана, доказывает целесообразность широкого его применения в первичной и вторичной профилактике экозависимой патологии у детей.
1. Бєленічев І.Ф., Левицький Є.Л., Губський Ю.І. та ін. Антиоксидантна система захисту організму // Современные проблемы токсикологии. — 2002. — № 3. — С. 61-62.
2. Антипкін Ю.Г. Стан здоров’я дітей в умовах дії різних екологічних чинників // Мистецтво лікування. — 2007. — № 5. — С. 45-47.
3. Грищенко С.В., Грищенко И.И., Абакумова А.В. и др. Гигиеническая оценка состояния окружающей среды Донецкой области и степени ее опасности для здоровья населения // Вестник гигиены и эпидемиологии. — 2007. — Т. 11, № 1. — С. 8-12.
4. Гнатейко О.З., Лук’яненко Н.С. Екогенетичні аспекти патології людини, спричиненої впливом шкідливих факторів зовнішнього середовища // Здоровье ребенка. — 2007. — № 6 (9). — С. 82-87.
5. Агарков В.И., Бугашева Н.В., Коктышев И.В. и др. Закономерности и особенности морфофункциональных показателей здоровья подростков, постоянно проживающих в социально-экологических условиях Донбасса // Вестник гигиены и эпидемиологии. — 2007. — Т. 11, № 1. — С. 3-7.
6. Лук’янова О.М. Проблема здоров’я здорової дитини та наукові аспекти профілактики його порушень // Мистецтво лікування. — 2007. — № 9. — С. 42-47.
7. Юдина Т.В., Ракитский В.Н., Егорова М.В. и др. Показатели антиоксидантного статуса в проблеме донозологической диагностики // Современные проблемы токсикологии. — 2002. — № 3. — С. 61-62.
8. Ленинджер А. Основы биохимиии. — М.: Мир, 1985. — Т. 1. — 367 с.
9. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. — М., 1993. — Т. 1–2. — 779 с.
10. Horowitz J., Frenneaux M. Metabolic manipulation in ischaemic heart disease, a novel approach to treatment // Eur. Heart J. — 2004. — 25(8). — 634-641.
11. Nohl H. A novel superoxide radical generatоr in heart mitochondria // FEBS Letteu. — 2001. — 214. — P. 268-273.
12. Toffaletti J. Elevations in blood lactate: Overview of use in critical care // Scand. J. Clin. Lab. Invest. — 2006. — 56, Suppl. 224. — 107-110.
13. Aduen J. et al. The Use and Clinical Importance of a Substrate-Specific Electrode for Rapid Determination of Blood Lactate Concentrations // JAMA. — 2004 December. — Vol. 272, № 21.
14. Коровина Н.А., Захарова И.Н., Обыночная Е.Г. Применение антиоксидантов в педиатрической практике // http: media consilium/03_09/ Feb — 2004
15. Курашвили В.А., Майлэм Л. Новые возможности предотвращения оксидативного стресса // Журнал натуральной медицины. — 2001. — № 1. — С. 7-14.
16. Захарова И.Н., Скоробогатова Е.В., Обыночная Е.Г., Коровина Н.А. Дефицит витаминов и микроэлементов у детей и их коррекция // Педиатрия. — 2007. — № 3. — С. 7-9.
17. Кравчун Н.О., Земляніцина О.В., Козаков О.В. Використання препарату «Нейровітан» для лікування полінейропатій при ендокринних захворюваннях: Методичні рекомендації. — Київ; Харків, 2004. — 16 с.
18. Подколзин А.А., Мегреладзе А.Г., Донцов В.И., Арутюнов С.Д., Мрикаева О.М., Жукова Е.А. Система антиоксидантной защиты организма и старение // http://medi.ru
19. Показники здоров’я населення та діяльності медичних установ Донецької області за 2006 рік. — Донецьк, 2006. — 258 с.
20. Ruuge E.K., Ledenev A.N., Lakomkin V.L., Konstantinov A.A., Ksenzenko M.Yu. Free radical metabolites in myocardium during ishemia and reperfuusion // American Journal of Physiology. — 2001. — 261. — P. 81-86.
21. James A. Kruse Understanding Blood Lactate Analysis // The Journal for Respiratory Care Practitioners. — 2005. — 63-69.
22. Литвин Б.С. Вплив комплексної медикаментозної терапії на окисний гомеостаз у дітей з вегетативними дисфункціями // Педіатрія, акушерство та гінекологія. — 2007. — № 2. — С. 16‑18.
23. Олійник Я.В. Порушення перекисного окислення ліпідів та їх корекція у дітей, хворих на атопічний дерматит // Вісник наукових досліджень. — 2007. — № 3. — С. 39-42.
24. Новожилова Г.П., Аксенова В.М., Мозговая Л.А. Состояние перекисного окисления липидов и антиоксидантной системы в плазме, эритроцитах и слюне детей с патологией органов полости рта, отягощенной дисбиозом кишечника // http: www.stomatburg.ru/articles/klin
25. Ковальчук В.И., Мацкевич Б.И. Корреция липидного состава мембран эритроцитов антиоксидантами у детей с острыми гнойными заболеваниями // Система транспорта кислорода. — 2004. — № 1. — С. 55-61.
26. Витамины группы В. Экспертное заключение по токсикологическим исследованиям / Международный Центр фармакологических исследований (МЦФИ). — Амман, Иордания.
27. Nakano M. Clinical Experience with Neurovitan. Клиническая эффективность Нейровитана. Department of Internal Medicine, Takaoka City Hospital, Japan. По материалам представительства компании «Мегаком». — 2002. — Ч. 2, № 11. — С. 3.
