Журнал «Здоровье ребенка» 1 (22) 2010
Вернуться к номеру
Острый тонзиллофарингит у детей: вопросы дифференциальной диагностики и лечения
Авторы: КРИВОПУСТОВ С.П., Национальный медицинский университет им. А.А. Богомольца, г. Киев
Рубрики: Педиатрия/Неонатология
Версия для печати
В зарубежной литературе принято объединять острый фарингит и острый тонзиллит и обозначать воспаление небных миндалин и слизистой оболочки глотки как «острый тонзиллофарингит». Вероятно, термин «ангина» менее удачен за счет того, что при тонзиллите в процесс вовлекается в той или иной степени и задняя стенка глотки, а также он используется в кардиологии (ангинозная боль как признак стенокардии).
Возбудителями острого тонзиллофарингита могут быть вирусы, бактерии, простейшие, микотическая инфекция, прежде всего аденовирус 1, 7, 7а, 9, 14, 15, 16, коронавирус, риновирус, EBV, грипп А, В, парагрипп 1, 2, 3, Коксаки А, В, корь, краснуха, CMV, вирус простого герпеса, РС-вирус, бета-гемолитический стрептококк А (БГСА), стрептококки группы С, G, коринебактерии дифтерии, хламидии и др. (табл. 1). У детей в возрасте до 3 лет, как правило, он связан с вирусами, а после 5 лет особую актуальность приобретают бактериальные формы поражения.
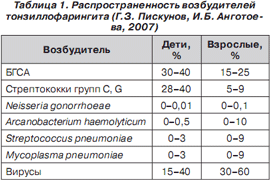
Всегда важно помнить об остром тонзиллофарингите, вызванном бета-гемолитическим стрептококком группы А? ввиду возможных осложнений (гнойные — перитонзиллярный или ретрофарингеальный абсцесс, мастоидит, менингит, некротизирующий фасциит, стрептококковый миозит, стрептококковый токсический шокоподобный синдром, которые редки, но смертность при них превышает 30 %; негнойные — острая ревматическая лихорадка, острый гломерулонефрит). Пик заболеваемости БГСА приходится на возраст 5–10 лет, он является причиной 25–30 % всех случаев острых бактериальных ангин (D. Rimmer, 1987).
В практической педиатрии алгоритм действия врача обычно начинается с выяснения ведущего симптома «боль в горле», который актуален для лиц старше 2-летнего возраста. Прежде всего необходимо выяснить: 1) может ли ребенок пить, глотать (для исключения абсцесса глотки); 2) есть ли налет в горле (экссудат или налет в горле может быть при острой бактериальной ангине — остром БГСА-тонзиллофарингите); 3) есть ли болезненность и увеличение > 2 см шейных лимфатических узлов (характерно для острого БГСА-тонзиллофарингита).
Если есть налет, нужно оценить, сопровождается ли он отеком шеи, распространяется ли за пределы миндалин, каков цвет налета, какова форма налета. Классическим признаком токсической дифтерии зева является односторонний или двусторонний отек подкожной клетчатки шеи, который распространяется до середины шеи, до ключиц или опускается на грудную клетку. В результате шея становится короткой и толстой, кожа на ней приобретает студнеобразную консистенцию, что выявляется посредством постукивания по ней пальцем. При дифтерии цвет налетов серовато-белый или грязно-серый, форма налетов пленчатая или в виде островков, а при попытке снять налет он снимается с трудом, слизистая кровоточит. При дифтерии налет может распространяться за пределы миндалин — на дужки, язычок, боковые и задние стенки глотки. Необходимо провести исследование — мазок на дифтерию (BL из зева и носа).
Для эффективной терапии чрезвычайно важно свое временно установить этиологию тонзиллофарингита. Теоретически желательно начинать антибиотикотерапию после получения результатов микробиологического исследования на БГСА. Диагностика включает микробиологическое исследование мазка с поверхности миндалин и/или задней стенки глотки. За рубежом широкое распространение получили методы экспресс-диагностики, основанные на прямом выявлении стрептококкового антигена в мазках с поверхности миндалин и/или задней стенки глотки. Современные тестовые системы позволяют получать результат через 15–20 мин с высокой специфичностью (95–100 %), но меньшей, чем при культуральном исследовании, чувствительностью (60–95 %), в связи с чем отрицательный результат экспресс-теста всегда должен подтверждаться культуральным исследованием.
В практике стартовая антимикробная терапия обычно начинается эмпирически, до получения результатов микробиологического исследования, при наличии клинических данных, указывающих на стрептококковую этиологию тонзиллита. Для отбора детей, которым показана антимикробная терапия, рекомендуется использовать шкалу Мак-Айзека (для детей старше 3 лет) и соответствующий алгоритм (табл. 2). В «Современных клинических рекомендациях по антимикробной терапии» (Российская Федерация, Смоленск: МАКМАХ. — Вып. 2. — 2007) вышеуказанные авторы приводят следующий алгоритм диагностики и лечения тонзиллита у детей, который, на наш взгляд, целесообразно внедрять в практическую деятельность современной педиатрии (рис. 1).
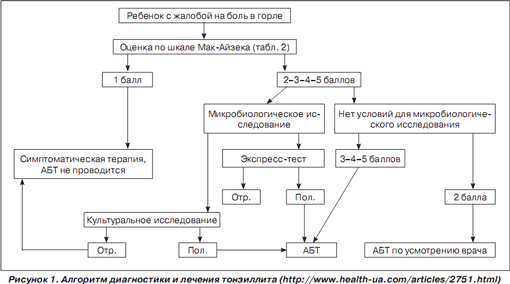
Лечение острого тонзиллофарингита предусматривает организацию режима и ухода за ребенком, системную антимикробную терапию при БГСА, местные средства (антисептического, противовоспалительного, иммунного, анальгетического действия), симптоматические средства (контроль лихорадки и др.), консультирование лиц, ухаживающих за ребенком.
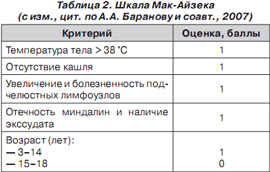
При антибактериальной терапии острого тонзиллофарингита, вызванного БГСА, преследуется цель не только купирования клинических проявлений тонзиллофарингита, но и достижения стойкой элиминации стрептококка группы А, профилактики острой ревматической лихорадки, гнойных осложнений, предотвращения распространения возбудителя. К сожалению, антибиотикотерапия БГСА-тонзиллофарингита не снижает риск развития гломерулонефрита.
Антибиотиками выбора для лечения БГСА-тонзиллофарингита являются: феноксиметилпенициллин, амоксициллин, цефалоспорины I поколения (цефалексин 50–100 мг/кг в сутки в 4 приема), макролиды, линкомицин, клиндамицин, которые назначают перорально, курс терапии (кроме азитромицина) — 10 суток. В качестве альтернативы рассматривают бензатинпенициллин внутримышечно однократно 600 тыс. ЕД для детей массой тела < 27 кг и 1,2 млн ЕД для более старших. У пациентов с аллергией на бета-лактамные антибиотики следует применять макролиды, а при непереносимости последних — линкозамиды.
В течение десятков лет пенициллины являлись препаратами первого плана в лечении острого бактериального тонзиллита, однако уже в середине 50–60-х годов прошлого века было показано, что частота их бактериологической неэффективности составила 10 %. Неэффективность терапии тонзиллита, обусловленного БГСА, может составлять свыше 30 %, а персистирование БГСА выявляется почти у четверти больных, окончивших первый курс лечения пенициллином, у более 60 % — после повторной терапии пенициллином (E. Kaplan и соавт., 1981).
Неэффективность терапии пенициллинами может быть связана с рядом факторов, и в первую очередь — с несоблюдением режима введения пенициллина; рекомендуемые схемы выполняют не более 50 % больных. Другая причина неэффективности бета-лактамных антибиотиков, особенно при рецидивирующем тонзиллите, связана с присутствием в глубине лакун миндалин, носоглотки смешанной микрофлоры, от 70 до 95 % штаммов которой продуцируют бета-лактамазы. Более того, опасно применять аминопенициллины при мононуклеозе, а нередко трудно в первые дни от начала заболевания убедиться в наличии вируса Эпштейна — Барр у пациента с ангиной. Поэтому в последние годы особое внимание оториноларингологов и педиатров обращено к цефалоспоринам I генерации и макролидам.
Представляет интерес частота выделения внутриклеточных возбудителей при остром и рецидивирующем тонзиллофарингите, достигающая, по данным S. Esposito (2002), для Mycoplasma pneumoniae 40 %, для Chl.nrumoniae — 7,4 %, что повышает актуальность использования макролидов (табл. 3).

Интерес представляет работа S. Altamimi и соавт. (Cochrane Database Syst Rev., 2009. — CD004872). Целью этого метаанализа стала сравнительная оценка эффективности 3–6-дневных курсов антибактериальной терапии с использованием более новых антибиотиков с 10-дневным курсом пенициллина внутрь в лечении пациентов с острым БГСА-фарингитом. Всего было идентифицировано 20 исследований с общим числом случаев острого БГСА-фарингита 13 102. Не было отмечено статистически достоверных различий между сравниваемыми курсами лечения в частоте возникновения ранней бактериологической неэффективности терапии и частоте возникновения позднего клинического рецидива. В то же время в целом риск развития позднего бактериологического рецидива был выше при использовании короткого курса лечения, хотя не было выявлено статистически значимых различий, когда из анализа исключили исследования с использованием низких доз азитромицина (10 мг/кг).
Таким образом, по данным вышеуказанного обзора, 3–6-дневные курсы антибактериальной терапии являются сопоставимыми со стандартной 10-дневной продолжительностью лечения пенициллином детей с острым фарингитом, вызванным S.pyogenes . Авторы делают вывод о том, что в странах с низкой распространенностью ревматической лихорадки короткие курсы лечения БГСА-фарингита у детей являются эффективными и безопасными. Тем временем результаты данного метаанализа не должны переноситься на регионы с высокой распространенностью ревматизма.
Распространенность острой ревматической лихорадки в настоящее время оценивается как менее 1–5 на 100 000 (0,001–0,005 %) в развитых странах и 100–150 на 100 000 (0,1–0,15 %) в развивающихся странах. Например, в США ~ 0,001 %, в Украине ~ 0,004 %. Однако настороженность в отношении ревматизма у нас не должна снижаться, и всегда необходимо помнить постулат J. Rotta: «Ревматизм не исчезнет, пока циркулирует бета-гемолитический стрептококк группы А». В настоящее время 10-дневный курс использования пероральных бета-лактамов при БГСА-тонзиллофарингите остается стандартной рекомендацией.
У детей с вирусным острым тонзиллофарингитом показаний к системной антимикробной терапии нет. Однако и при вирусном, и при бактериальном остром тонзиллофарингите актуально использование местных лекарственных средств, влияющих на MALT — систему лимфоидной ткани, ассоциированной со слизистыми. Это прежде всег, лизоцим (мураминидаза) — антибактериальный агент, фермент класса
гидролаз, разрушающий клеточные оболочки бактерий путем гидролиза N-гликозидных связей и повреждения цитоплазматической мембраны бактерии. В больших количествах он содержится в слюне. Лизоцим был открыт в 1922 году Александром Флемингом.
Общеизвестно, что первой линией обороны слизистых оболочек является система врожденного иммунитета, которая представлена множеством растворимых факторов, находящихся в слюне и других секретах, защищающих слизистые оболочки, а также определенными типами лейкоцитов. Растворимые факторы и клетки врожденного иммунитета распознают характерные микробные субстраты: пептидогликан и липотейхоевые кислоты грамположительных микробов, бактериальную ДНК, N-формилметионин, двунитчатую РНК вирусов, глюканы клеточных стенок грибов и др. К группе гуморальных факторов иммунитета относится и лизоцим, его продукция организмом усиливается в ответ на воздействие микробных факторов. При воспалительной реакции в слизистом эпителии увеличивается выработка лизоцима, однако напряжение местной защиты затем сменяется ее истощением.
Лизоцим (мураминидаза) атакует пептидогликаны (в частности, муреин), входящие в состав клеточных стенок бактерий (особенно грамположительных). Он также эффективен в отношении вирусов и грибов. Лизоцим обладает местным противовоспалительным эффектом и повышает неспецифическую резистентность организма, при этом известно, что у детей с лакунарной и фолликулярной ангиной имеет место низкий уровень в слюне иммуноглобулинов классов A, M, G, особенно slgA (Л.В. Феклисова и соавт., 2006).
Лизоцим гидролизует (1,4)-гликозидную связь между N-ацетилмурамовой кислотой и N-ацетилглюкозамином. Пептидогликан при этом связывается с активным центром фермента, расположенным между двумя его структурными доменами. Молекула субстрата в активном центре принимает конформацию, близкую к конформации переходного состояния. В соответствии с механизмом Филлипса лизоцим связывается с гексасахаридом, затем переводит 4-й остаток в цепи в конформацию твист-кресла. В этом напряженном состоянии гликозидная связь легко разрушается. Остатки глутаминовой (Glu35) и аспарагиновой кислот (Asp52) критичны для функционирования фермента. Glu35 выступает в качестве донора протона при разрыве гликозидной связи субстрата, разрушая связь, а Asp52 выступает в роли нуклеофила при образовании интермедиата — гликозил-фермента. Затем гликозил-фермент реагирует с молекулой воды, в результате чего фермент возвращается в исходное состояние и образуется продукт гидролиза.
В связи с вышеуказанным наше внимание привлек препарат Лисобакт, выпускаемый фирмой Bosnalijek (Босния и Герцеговина). В его состав входят два основных действующих вещества — лизоцим и пиридоксина гидрохлорид. После рассасывания таблетки в полости рта лизоцим и пиридоксин хорошо всасываются в слизистой оболочке. Лизоцим проявляет противомикробную и антивирусную активность, обладает местным противовоспалительным эффектом и повышает неспецифическую резистентность организма. Для усиления репаративного действия в препарат включен витамин В 6 (пиридоксин).
Пиридоксин оказывает защитное действие на слизистую оболочку полости рта, предупреждая развитие кандидоза. Он относится к важнейшим водорастворимым витаминам, участвует в синтезе нейромедиаторов и многих ферментов, обладает нейро-, кардио-, гепатотропным и гемопоэтическим действием. Кроме того, пиридоксин обеспечивает превращение триптофана в ниацин, в качестве кофермента участвует в обмене белков (переаминирование, декарбоксилирование, дезаминирование, пересульфурация, образование никотиновой кислоты из триптофана, синтез гемоглобина), углеводов и жирных кислот (превращение гликогена в глюкозу-1-фосфат, превращение линолевой кислоты в арахидоновую). Недостаточность витамина В 6 проявляется в том числе и поражением слизистых оболочек. Потребность в пиридоксине особо повышается во время инфекций.
Лисобакт (таблетки для рассасывания) находит широкое применение в отоларингологии, стоматологии, амбулаторной и стационарной педиатрии, в частности в лечении острых бактериальных и вирусных тонзиллофарингитов. После рассасывания таблетки максимальная концентрация лизоцима в сыворотке крови достигается через 1–1,5 ч, он распределяется в тканях организма, но максимальные его концентрации отмечаются в слизистых оболочках.
Детям в возрасте 3–7 лет Лисобакт обычно назначают по 1 таблетке 3 раза в сутки, 7–12 лет — по 1 таблетке 4 раза в сутки, детям в возрасте старше 12 лет и взрослым — по 2 таблетки 3–4 раза в сутки. Продолжительность применения — 8 дней, при необходимости лечение можно продлить. Таблетки Лисобакт следует рассасывать медленно, а растворенную массу необходимо как можно дольше задерживать в полости рта. Данную лекарственную форму не применяют у детей в возрасте младше 3 лет.
Препарат можно применять в комбинации с антибактериальными средствами для усиления их противомикробного действия. Высокая эффективность Лисобакта в лечении острого фарингита продемонстрирована в работе проф. Н.Л. Кунельской и соавт. (2008): клинические симптомы заболевания редуцировались у больных раньше, чем в контрольной группе. Целесообразность его использования при проявлениях инфекционного мононуклеоза в полости рта показана в работе Т.П. Кравец и соавт. (2009).
При острых вирусных тонзиллофарингитах Лисобакт также находит широкое применение, включая герпетические инфекции. Известно, что при действии лизоцима активируются факторы иммунитета, которые препятствуют размножению вирусов. Пиридоксин участвует в обмене аминокислот, в том числе цистеина, который, в свою очередь, входит в так называемую систему глутатиона, определяющую окислительно-восстановительный потенциал внутриклеточной среды. Эта антиоксидантная система обеспечивает и контролирует воспалительные реакции, развивающиеся при инфекциях, в частности, в процессе воспаления образуются активные формы кислорода. Введение пиридоксина уменьшает повреждение клеток организма, способствует их регенерации, усиливает обмен необходимых аминокислот, обеспечивает антиоксидантную защиту и, как следствие, ослабляет последствия стресса, которым в данном случае являются острые респираторные заболевания.
В настоящее время накоплена доказательная база по применению Лисобакта у часто и длительно болеющих детей при острых респираторных заболеваниях (Ю.Г. Бурмак и соавт., 2002), у детей с гнойным тонзиллитом на фоне базисной терапии (С.В. Кузнецова, 2002). Терапевтические возможности Лисобакта при хроническом тонзиллите освещены в фундаментальном обзоре проф. Е.И. Юлиша (2009).
Так, у детей, получающих Лисобакт на фоне острой инфекции глотки, отмечались более быстрое купирование интоксикационного синдрома, катаральных явлений, нормализация показателей гемограммы, а само заболевание протекало без осложнений. Лисобакт препятствовал проникновению чужеродных агентов во внутреннюю среду организма путем стимуляции фагоцитоза и усиления кооперативных функций Т-популяций лимфоцитов, бактериологических и антиадгезивных свойств иммуноглобулинов, способствовал ускорению репаративных процессов, повышал восприимчивость микробов к воздействию антибиотиков.
При изучении динамики состояния микрофлоры ротоглотки на фоне терапии с включением лизоцимсодержащего препарата отмечены повышение численности и активности облигатной микрофлоры, снижение активности факультативных и остаточных микроорганизмов, нормализация баланса аэробно-анаэробных популяций микроорганизмов и восстановление процессов протеолиза и муцинообразования, а также нормализация уровня секреторного IgА в слюне. Важно, что Лисобакт не только находит широкое терапевтическое применение, но и используется с профилактической целью, особенно у ослабленных, часто и длительно болеющих детей, в осенне-зимний период (О.О. Погорелова и соавт., 2009).
Таким образом, диагностический подход к курации детей с острым тонзиллофарингитом предусматривает дифференциацию на предположительно вирусную и бактериальную (в том числе БГСА) этиологию с соответствующим алгоритмом антимикробной терапии. Антибиотикотерапия направлена прежде всего на предупреждение осложнений стрептококковой инфекции. В любом случае обосновано применение Лисобакта, повышающего эффективность проводимого лечения и восстанавливающего местный гомеостаз ротовой полости.
1. Баранов А.А., Богомильский М.Р., Волков И.К. и др. Практические рекомендации по применению антибиотиков у детей в амбулаторной практике // Здоровье Украины. — 2008. — № 10(1).
2. Белов Б.С., Насонова В.А., Гришаева Т.П. Ревматологические аспекты стрептококкового тонзиллита и современные подходы к его антибактериальной терапии // Русский медицинский журнал. — 2006. — Т. 14, № 25.
3. Богомильский М.Р., Чистякова В.Р. Детская оториноларингология. — М.: Гэотар-мед, 2001.
4. Волосовец А.П., Кривопустов С.П. Макролиды в практике современной педиатрии. — К.: Четверта хвиля, 2009.
5. Волосовец А.П., Кривопустов С.П. Цефалоспорины в практике современной педиатрии. — Харьков: Прапор, 2007.
6. Пискунов Г.З., Анготоева И.Б. Острый тонзиллофарингит // Лечащий врач. — 2007. — № 2.
7. Погорелова О.О., Усенко Д.В., Ардатская М.Д. и др. Эффективность Лизобакта в лечении острых респираторных заболеваний у детей // Инфекционные болезни. — 2009. — Т. 1, № 1.
8. Таточенко В.К., Бакрадзе М.Д., Дарманян А.С. Острые тонзиллиты в детском возрасте: диагностика и лечение // Фарматека. — 2009. — № 14.
9. Юлиш Е.И. Хронический тонзиллит у детей // Здоровье ребенка. — 2009. — № 6(21). — С. 58-66.
10. Altamimi S., Khalil A., Khalaiwi K.A. et al. Short versus standard duration antibiotic therapy for acute streptococcal pharyngitis in children // Cochrane Database Syst. Rev. — 2009. — 21(1). — CD004872.
11. Bisno A.L., Gerber M.A., Gwaltney J.M. et al. Diagnosis and management of group A streptococcal pharyngitis: a practical guideline // Clin. Infect. Dis. — 1997. — № 25.
12. Edmonson M.B. et al. Relationship between clinical likelihood of group А Streptococcal pharyngitis and the sensitivity of rapid antigen-detection test in pediatric practice // Pediatrics. — 2005. — № 115.
13. Robert M. Kliegman, Richard E. Behrman, Hal B. Jenson, Bonita F. Stanton. Nelson Textbook of Pediatrics. — 18th edition. — Saunders, 2007.
14. Pichichero M.E., Casey J.R., Mayes T. et al. Penicillin failure in streptococcal tonsillopharyngitis: causes and remedies // Pediatr. Infect. Dis. J. — 2000. — № 19(9).
15. Putto-Laurila A., Mertsola J., Ruuskanen O. Viral Causes of Tonsillitis and Fever Unresponsive To Antibiotic Therapy // Pediatr. Infect. Dis. J. — 1999. — № 18(1).
