Журнал «Здоровье ребенка» 1 (22) 2010
Вернуться к номеру
Опсонирующая сеть протеинов системы неспецифической защиты респираторного тракта 1. Пентраксины
Авторы: Абатуров А.Е., Днепропетровская государственная медицинская академия
Рубрики: Педиатрия/Неонатология
Версия для печати
В обзоре показано, что представитель протеинового семейства пентраксинов острофазовый белок Ptx3 выполняет множество различных функций. Ptx3 является образраспознающим рецептором и играет определяющую роль в защите респираторного тракта от бактериальных (особенно Pseudomonas aeruginosa), грибковых (Aspergillus) и вирусных инфекционных агентов.
Введение
Рекогниция патоген-ассоциированных молекулярных структур (pathogen-associated molecular patterns, PAMP) инфекционных агентов в респираторном тракте осуществляется основополагающим структурно-молекулярным компонентом системы неспецифической защиты — образраспознающими рецепторами (pattern recognition receptors, PRR). В зависимости от формы функционирования выделяют несколько групп PRR: 1) группа солютабных секретируемых внеклеточных рецепторов, присутствующих как свободные компоненты в бронхоальвеолярном секрете; 2) группа мембранных рецепторов, участвующих в эндоцитозе; 3) группа сигнальных трансмембранных Toll-подобных рецепторов (Toll-like receptors, TLR); 4) внутриклеточных цитозольных рецепторов. В респираторном тракте роль солютабных PRR наряду с другими выполняют пентраксины (Ptx), коллектины, комплемент [2, 5, 13, 15, 24, 29].
Белки семейства Ptx, коллектинов, комплемент-полимерные белки, способные связываться с поверхностными гликоконъюгатами бактерий, вирусов, грибов, ограничивают процесс роста их колоний, усиливают процесс фагоцитоза, модулируют иммунный ответ, увеличивают эффективность мукоцилиарного клиренса респираторного тракта [9, 16, 25, 38, 40].
Пентраксины
Гликопротеины Ptx — филогенетически древнее консервативное суперсемейство белков, сохраненное у млекопитающих в течение эволюции от Limulus polyphemus [13, 14, 22, 26].
Краткая характеристика пентраксинов
В зависимости от длины молекулы Ptx представители этого семейства условно разделены на два подкласса — коротких и длинных Ptx. Молекулы коротких Ptx отличаются от молекул длинных Ptx отсутствием N-терминального домена [26]. Семейство коротких Ptx включает в себя C-реактивный белок (СРБ), амилоидный сывороточный P компонент (APCS), семейство длинных Ptx — нейрональный пентраксин I (NPtx2), нейрональный пентраксин II (NPtx2), пентраксин-3 (Ptx3), пентраксин-4 (Ptx4) (табл. 1). Все Ptx являются острофазовыми белками [4, 14, 21, 22].
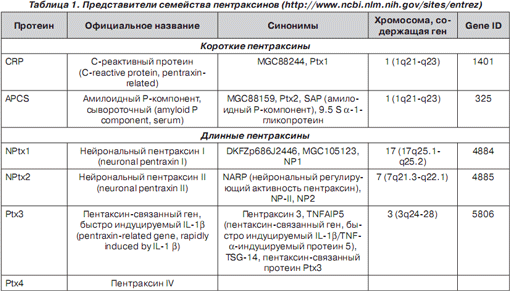
Непосредственное участие в противоинфекционной защите респираторного тракта принимает Ptx3. Первоначально Ptx3 был идентифицирован как продукт IL‑1‑индуцибельного гена эндотелиальных клеток и TNF‑индуцибельного гена фибробластов. Гликопротеин Ptx3 — новый представитель старого семейства Ptx, молекула которого состоит из 381 аминокислотного остатка и является циклическим пентамером с анулярной дископодобной структурой. C-терминальный домен (203 аминокислотных остатка) Ptx3 подобен C-терминальным доменам протеинов СРБ, SAP и содержит классическую для пентраксинов последовательность 8 аминокислотных остатков — HxCxS/TWxS; N-терминальный домен (178 аминокислотных остатков) уникален и образован 4 короткими a -спиралями (рис. 1) [14, 19, 32].
Структурно N-терминальный домен подобен N-терминальному домену молекул семейства коллектинов, что соответствует его физиологической роли в системе защиты респираторного тракта [18].
Индукция синтеза пентраксина-3
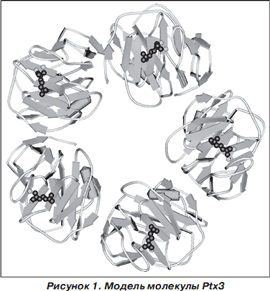
При развитии инфекционного процесса бронхолегочной системы PAMP возбуждают клеточные TLR, внутриклеточные сигнальные пути которых индуцируют группу факторов транскрипции, участвующих в регуляции воспаления. Учитывая, что проксимальный промотор гена Ptx3 содержит AP-, NF- k B-, Sp1- и NF-IL-6-связывающие сайты, активация данных факторов транскрипции индуцирует продукцию Ptx3. Основными продуцентами Ptx являются нейтрофилы, моноциты, макрофаги, дендритные клетки [7, 17, 36, 43, 44]. В отличие от других клеток, у которых нет предсформированных молекул Ptx3, в нейтрофилах Ptx3, преимущественно в мономерной форме, содержится в специфических гранулах вместе с лактоферрином. При активации нейтрофилов мономерный Ptx3 секретируется в экстрацеллюлярное пространство и полимеризуется в мультимеры. Формирование мультимеров Ptx3 не зависит от процесса гликозилирования [31, 42]. Показано, что 10 6 клеток нейтрофилов содержат приблизительно 24,9 ± 3,8 нг гликопротеина Ptx3. После возбуждения нейтрофилы высвобождают в экстрацеллюлярное пространство до 25 % интрацеллюллярного запаса Ptx3 [43]. Учитывая наличие предсформированных запасов Ptx3 в нейтрофилах, они в ответ на воздействие PAMP могут быстро (значительно раньше, чем другие клетки) высвобождать Ptx3. Моноциты, макрофаги и дендритные клетки начинают продуцировать Ptx3 в более поздние сроки [43]. Основными отсроченными продуцентами Ptx3 являются миелоидные дендритные клетки (MyDC). В течение 24 часов 10 6 MyDC синтезируют около 50 нг Ptx3 [36].
Индуцибельная продукция различными клетками Ptx3 зависит от селективной активности TLR и происходит в первые 4–6 часов после взаимодействия с РАМР (табл. 2) 36].
Синтез протеина Ptx3 может индуцироваться провоспалительными цитокинами. Показано, что провоспалительные цитокины — IL-1 b или TNF- a — активируют продукцию Ptx3 в эпителиоцитах, моноцитах, дендритных клетках, фибробластах, эндотелиоцитах, гепатоцитах, адипоцитах и миоцитах [6, 20, 23, 36].
При развитии инфекционно-воспалительного процесса в бронхолегочной системе отмечается не только местное, но и повышение уровня концентрации длинного петраксина Ptx3 в сыворотке крови. У практически здоровых людей уровень концентрации Ptx3 в сыворотке крови очень низкий (< 2 нг/мл), а при развитии вирусного или бактериального инфекционного процесса он быстро увеличивается, достигая максимума через 4–6 часов (уровень СРБ достигает пика только через 36–48 часов). В связи с этим показатель содержания Ptx3 в сыворотке крови рекомендуют использовать в качестве раннего диагностического маркера воспалительного процесса [8, 12, 43].
Механизм действия пентраксина-3
Противоинфекционное действие пентраксина-3
Длинный петраксин Ptx3 является уникальной молекулярной структурой, которая распознает определенные молекулярные структуры и играет важную роль в противоинфекционной защите организма [8, 33, 34]. Ptx3 преципитирует как инфекционные агенты, так и их PAMP, взаимодействуя с фосфохолином поверхностных молекулярных структур мембран возбудителя. Ptx3 преимущественно взаимодействует с OmpA и не связывается с такими РАМР, как липополисахариды, липотейхоевая кислота, экзотоксин А, N-ацетилмурамил-L аланил-D-изоглютамин. Это взаимодействие носит Са 2+ -зависимый характер [4, 48].
Протеин Ptx3 активирует по крайней мере два участвующих в элиминации инфекционных агентов эффекторных механизма: систему комплемента, связываясь с C1q [3], и фагоцитоз (в частности, альвеолярных макрофагов) [32].
В экспериментальных исследованиях было показано, что большинство особей мышей с нокаутным геном Ptx3 погибали в течение первых трех суток заболевания при инфицировании респираторного тракта Asperigillus fumigatus , Pseudomonas aeruginosa . Но при введении рекомбинантного Ptx3 летальность среди инфицированных особей резко снижалась. Терапия рекомбинантным Ptx3 увеличивает эффективность контроля инфекционных процессов, вызванных и Streptococcus pneumoniae, Haemophilus influenzaе . Однако мыши с нокаутным геном Ptx3 высоко резистентны к инфицированию Listeria monocytogens и Staphуlococcus aureus [23, 30, 32, 39, 45–47].
Также представлены данные о высокой степени ассоциации между низким уровнем экспрессии пентраксинов и высокой вероятностью развития туберкулеза [10].
Было показано, что Ptx3 участвует в процессе элиминации грамположительных, грамотрицательных бактерий, вирусов и грибов ( Aspergillus fumigates, Aspergillus flavus, Aspergillus niger , но не Candida albicans ) [11, 32].
Иммунномодулирующее действие пентраксина-3
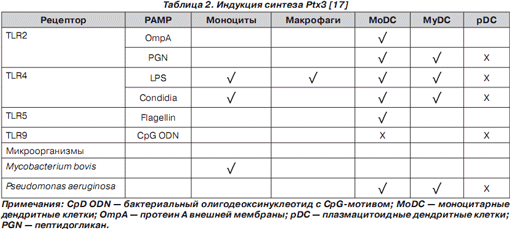
Гликопротеин Ptx3 является иммуномодулирующим фактором, который участвует в регуляции функционирования дендритных клеток, макрофагов и системы комплемента (рис. 2) [28].
Показано, что Ptx3 действует как солютабный PRR [27]. Гликопротеин Ptx3, связываясь с РАМР инфекционных агентов, облегчает их интернализацию нейтрофилами, резидентными и рекрутированными антигенпрезентирующими клетками [37].
Ptx3 индуцирует дендритные клетки и усиливает активность TLR, обусловливая индукцию синтеза IL-12, формируя Th 1 -направленность иммунного ответа [1, 34, 47]. Показано, что гликопротеин Ptx3 ингибирует синтез IL-10, но без изменения уровня секреции TNF- a [1]. Своеобразность действия Ptx3 на цитокиновую продукцию, которая характеризуется усилением синтеза IL-12, снижением продукции IL-10 при сохранении уровня синтеза TNF- a , по мнению R. Gaziano и соавт. [1], характеризует Ptx3 как тонкий регулятор воспаления, который способствует балансу про- и противовоспалительных реакций. Не исключено, что Ptx3 оказывает ингибирующее действие на IL-10-продуцирующие Treg-клетки.
В одном из фундаментальных исследований C. Garlanda и соавт. [32] представили доказательства, что в условиях отсутствия Ptx3 в организме система иммунитета не в состоянии ответить на инфицирование Aspergillus fumigatus по Th 1 -типу. Введение экзогенного Ptx3 способствует индукции Th 1 -иммунного ответа и выздоровлению мышей, зараженных Aspergillus fumigates [32].
Ptx3, связываясь с C1q, вызывает активацию системы комплемента, а взаимодействуя с альвеолярными макрофагами, усиливает процесс фагоцитоза инфекционных агентов [3, 30, 32]. Неизвестно, взаимодействует ли Ptx3 так же, как C-реактивный белок, с рецепторами FcyRIIa или индуцирует другие рецепторы, активность которых определяет напряжение фагоцитоза макрофагами. Гликопротеин Ptx3 высоко аффинен не только к компоненту комплемента C1q, но и к внеклеточному матриксному TNF-индуцибельному протеину-6, фибробластному фактору роста-2, сосудистому эндотелиальному фактору роста. Протеин Ptx3, связываясь с данными протеинами, предотвращает их взаимодействие со специфическими рецепторами, таким образом ингибируя их биологическую активность [32, 35, 41].
Ptx3 распознает апоптотические клетки более эффективно, чем клетки, находящиеся в процессе онкоза/некроза. Показано, что Ptx3, связываясь с апоптотическими клетками, снижает активность их элиминации фагоцитами и подавляет активность комплемента, расположенного на мембране апоптотической клетки. Взаимодействуя с апоптотической клеткой, Ptx3 регулирует кросс-презентацию антигенных детерминант на поверхности ее мембраны. Устойчиво связанный длинный петраксин Ptx3 с апоптотической клеткой может одновременно взаимодействовать с мембраной зреющей дендритной клетки, модулируя ее активность [45] .
Заключение
В организме человека представитель протеинового семейства пентраксинов острофазовый Ptx3 выполняет множество различных функций. Ptx3 является образраспознающим рецептором и играет определяющую роль в защите респираторного тракта от бактериальных (особенно Pseudomonas aeruginosa ), грибковых ( Aspergillus ) и вирусных инфекционных агентов. Он индуцирует фагоцитоз и возбуждает классический путь активации комплемента C1q. Длинный пентраксин Ptx3 оказывает иммунорегулирующее действие, которое направлено на поддержку Th 1 -ответа, в связи с чем гиперэкспрессия Ptx3 может способствовать развитию выраженного макрофагально-нейтрофильного воспалительного процесса. Ptx3 участвует в регуляции процесса элиминации апоптотических клеток.
Список литературы находится в редакции
