Журнал «Здоровье ребенка» 2 (23) 2010
Вернуться к номеру
Діагностична цінність С-реактивного білка в неонатальній практиці
Авторы: Бондаренко М.П., Орловська І.Ю., Бондаренко М.Ю., Антоненко Т.М., Дитяча міська клінічна лікарня № 3 ім. проф. М.Ф. Руднєва, Міська централізована імунологічна лабораторія, м. Дніпропетровськ
Рубрики: Педиатрия/Неонатология
Версия для печати
У межах комплексного клініко-лабораторного динамічного дослідження проведена оцінка діагностичної цінності С-реактивного білка в 32 новонароджених дітей при різних патологічних станах. Визначена висока значимість рівня активності С-реактивного білка, практична доступність при діагностиці інфекційних станів у немовлят та при оцінці якості лікування. На коливання рівня С-реактивного білка впливає ранній неонатальний вік новонароджених, наявність тяжких уражень головного мозку, гострої ниркової недостатності, а також застосування напередодні дослідження внутрішньовенних імуноглобулінів, інших препаратів крові. Виявлено, що активність С-реактивного білка у хлопчиків у 4 рази вища, ніж у дівчаток.
Новонароджені діти, С-реактивний білок, патологічні стани, діагностика.
Вступ
Ефективна діагностика та контроль якості лікування патологічних станів у новонароджених дітей завжди є важливим завданням у неонатології. Незважаючи на удосконалення технологій виходжування та лікування немовлят, залишається високим рівень їхньої захворюваності та летальності [1, 2]. Постійно проводиться пошук якісних лабораторних показників для визначення тяжкості патологічного процесу, диференціальної діагностики інфекційних станів та оцінки якості терапії: визначення лейкоцитарного індексу інтоксикації, індексу імунологічної резистентності, цитокінів, туморнекротичного фактору (ТНФ- a ), інтерлейкінів (ІЛ) -1, -6, -8, індексу ендогенної інтоксикації, показників прогнозування ускладнень захворювання (прокальцитонін), визначення ліпополісахаридпозитивних гранулоцитів у мазках периферичної крові, рівня токсичних фракцій середніх молекул [3–9]. Серед факторів, що зумовлюють зміни при запаленні, велике значення мають так звані реактанти гострої фази: С-реактивний білок (СРБ), амілоїдний білок А. У клінічній практиці СРБ використовується достатньо широко, але в новонароджених дітей специфіка цього показника вивчена недостатньо.
Метою нашого дослідження є визначення діагностичної цінності СРБ у новонароджених дітей із різними патологічними станами.
Матеріали і методи
Дослідження виконано на базі відділення патології новонароджених дитячої міської клінічної лікарні № 3 ім. проф. М.Ф. Руднєва та міської імунологічної лабораторії м. Дніпропетровська. Проведено комплексне динамічне клініко-лабораторне обстеження та аналіз перинатального періоду у 32 новонароджених дітей, які знаходилися на стаціонарному лікуванні в січні — квітні 2008 року. Проводилися стандартні лабораторні дослідження в динаміці, включаючи загальний аналіз крові, імунологічні показники: імуноглобуліни (Ig) М (IgM) і G (IgG) щодо TORCH-інфекцій, загальні імуноглобуліни А (IgA), М, G; циркулюючі імунні комплекси (ЦІК), СРБ, антистрептолізин-О (АСЛ-О), ТНФ- a , ультразвукові дослідження головного мозку та внутрішніх органів, бактеріологічні дослідження. Проводили клінічну оцінку стану дітей з визначенням наявності синдрому токсикозу: гарячка, гіпотермія, порушення кровообігу, сірий та блідий відтінок шкіри, синдроми пригнічення, порушення функцій внутрішніх органів тощо.
Дослідження рівня СРБ проводилося діагностикумом «СРБ — латекс-тест», ТОВ НВЛ «Гранум», м. Харків. Згідно з паспортом, нормальні показники його становили до 6 мг/л. Це недорогий аналіз, термін виконання 10–15 хвилин, необхідна кількість сироватки крові 5–10 мкл, він не потребує спеціального дорогого обладнання і може бути виконаний в будь-якій лабораторії. Визначення рівня гострофазного білка проводилося тричі: на початку лікування, через 16–20 і через 48–72 години лікувального процесу. Показники оцінювалися в комплексі з динамікою клінічних даних та вищезгаданих лабораторних результатів.
Новонароджені були розподілені на 2 групи: 22 дитини (11 доношених і 11 недоношених) — діти з інфекційною патологією та 10 пацієнтів (5 доношених і 5 недоношених) — діти з неінфекційною патологією.
Коефіцієнти діагностичної цінності (k) розраховували за формулою:
k = 2(S 1 2 + S 2 2 )/(M 1 — M 2 ) 2 ,
де S 1 , S 2 — середні квадратичні відхилення показника в різних групах;
М 1 , М 2 — середні арифметичні показники в різних групах;
k — ступінь відхилення одного показника різних груп.
Результати і їх обговорення
У всіх випадках вагітність мала перебіг з відхиленнями від норми: анемія, набряки вагітних, загроза переривання вагітності, токсикози, пієлонефрити, грибкові кольпіти, плацентити, гострі респіраторні захворювання. У 26 випадках (81,3 %) безводний період був до 10 годин, 6 (18,7 %) пологів мали безводний період від 11 до 96 годин. Недоношеність охоплювала терміни гестації від 27 до 36 тижнів. В асфіксії тяжкого ступеня народилося 2 дитини (6,3 %), середньої тяжкості — 4 (12,5 %), легкого ступеня — 13 новонароджених (40,6 %).
У ранньому неонатальному віці досліджувалося 4 дитини (12,5 %), у віці з 7-го по 28-й день життя — 18 (56,3 %), в постнатальному періоді — 10 (31,2 %). Серед обстежених новонароджених дівчаток було 15 (46,9 %), хлопчиків — 17 (53,1 %).
У комплексі дослідження проводили аналіз показників лейкоформули: лейкоцитоз мали 13 дітей (40,6 %), лейкопенія — у 5 випадках (15,6 %), у решти пацієнтів — норма. Зрушення лейкоцитарної формули ліворуч було у 22 новонароджених (68,8 %). Тромбоцитопенія зареєстрована у 7 пацієнтів (21,9 %). Клінічно маніфестний синдром токсикозу мали 20 дітей (62,5 %). Імунологічні маркери: IgМ і IgG до токсоплазми, цитомегаловірусу, герпесу 1—2-го типів та краснухи визначали в динаміці у дітей та їх матерів. IgМ у дітей не були виявлені. В одному випадку був зафіксований сумнівний показник у матері щодо герпесу 1–2-го типів. Коливання значень IgG до токсоплазми становило 22–754 МЕ/мл, до цитомегаловірусу — 8–893 ДU, до герпесу 1 — 2-го типів — 17–350 ДU, до краснухи — 24–86 МЕ/мл. Динамічний контроль цих показників свідчив про пасивну материнську трансплацентарну імунізацію IgG. Визначались рівні загальних IgА, IgМ, IgG у сироватці крові немовлят. Коливання рівнів загальних IgМ становило 0,2–1,0 г/л, IgG — 2,5–9,0 г/л, IgА — 0,2–0,35 г/л. Із інших показників гуморального імунітету визначалася концентрація ЦІК, її коливання були від 0,1 до 9 одиниць оптичної густини. Показники АСЛ-О тільки в трьох випадках (9,4 %) перевищували норму (> 250 МЕ/мл).
Під час ультразвукового дослідження виявлено вроджену ваду мозку в 1 новонародженого (3,1 %), у 2 (6,2 %) — кистозну енцефалопатію; дифузний та значний перивентрикулярний набряки мозку мали 15 дітей (46,9 %), внутрішньошлуночкові крововиливи (ВШК) різного ступеня були у 12 новонароджених (37,5 %), ознаки стріарної васкулопатії зафіксовано в 1 пацієнта (3,1 %).
Серед досліджених дітей 4 (12,5 %) мали ниркову недостатність в анамнезі, 7 (21,9 %) — на момент аналізу. Вроджені вади розвитку мали 11 новонароджених (34,4 %).
Травматичний фактор (оперативні втручання, кефалогематоми, підвивих 1-го шийного хребця) в анамнезі мали 8 дітей (25 %). З біохімічних показників аналізувалися рівні загального білка та альбумінів сироватки крові як оцінка спроможності печінки до синтезу білків. У 7 випадках (21,9 %) зафіксовано зниження рівня загального білка, в 5 (15,6 %) — зниження фракції альбумінів. Паралельно з визначенням СРБ проводили діагностику рівня ТНФ- a : вперше при призначенні лікування його коливання становили від 3 до 47 пг/мл, при контролі через 16–20 годин зафіксовано зростання цього показника у дітей до 13–208 пг/мл, при контролі через 72 години значення даного цитокіна були в нормі — 6 пг/мл.
Результати бактеріологічних досліджень з біологічних локусів (трахея, пупок) та біосередовищ (кал, кров, ліквор) свідчили про наявність різноманітної умовно-патогенної флори (як одного збудника, так й їх поєднання): ентерокока (1 дитина — 3,1 %), синьогнійної палички (4 — 12 %), грибів роду Candida (2 — 6,3 %), Klebsiella pneumoniae (6 — 18,8 %), золотистого стафілокока (1 — 3,1 %), ентеробактеру (2 — 6,3 %).
Результати визначення рівня СРБ відображали чітку різницю між інфекційною та неінфекційною патологією у новонароджених пацієнтів (табл. 1).
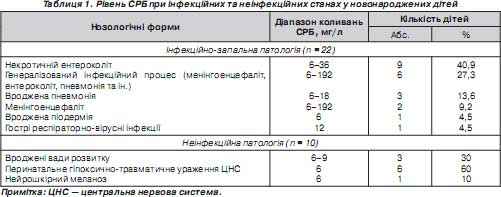
За наявності одного інфекційного вогнища (пневмонія або некротичний ентероколіт) підвищення рівня СРБ становило від 6 до 36 мг/л, при генералізованому перебігу інфекції його коливання досягали максимального рівня — 192 мг/л та вище. Динаміка зміни рівня СРБ повністю збігалася з динамікою клінічних проявів синдрому токсикозу та загального стану дитини. Це давало змогу підтвердити правильність обраної терапії або необхідність її корекції вже через 16–20 годин з початку лікування, що підтверджувалося подальшим клініко-лабораторним контролем стану дітей (табл. 2).
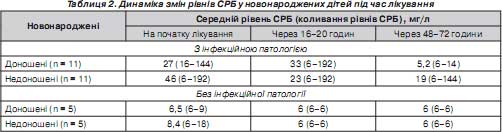
Щодо показників загального аналізу крові, чіткої кореляції не відмічено: високі рівні СРБ (12–192 мг/л) тільки у 22,6 % випадків поєднувалися з лейкоцитозом, у 41,9 % — зі зрушенням лейкоформули ліворуч, у 9,7 % — із тромбоцитопенією, у 6,5 % — поєднувалися з лейкопенією. Звертає увагу великий розмах коливань рівня СРБ при інфекційній патології. Це пов''язано з відчутною медіаторною роллю цього показника при інфекціях, викликаних бактеріальними патогенами великої молекулярної маси, що, за даними В.М. Титова [13 ], є причиною підвищення концентрації СРБ у сотні разів. Подібні коливання рівня СРБ при дослідженні дітей з генералізованими формами інфекції частіше спостерігалися у хлопчиків (18 %) незалежно від гестаційного віку. В цих пацієнтів із різних біологічних локусів виділялися гриби роду Candida , синьогнійна паличка, клебсієли, що сприяли великому ліпополісахаридному навантаженню [9].
Відомо, що запалення — це еволюційно сформований процес відокремлення та знищення вогнищ ураження і причин захворювання в організмі. СРБ з''являється через 4–6 годин після початку захворювання. Результат гострофазної відповіді полягає в тому, щоб допомогти організму відновити гомеостаз шляхом контролювання таких процесів, як ступінь крововтрати, відокремлення зони ураження, резорбція некротичних тканин, зв''язування та видалення надмірної кількості тканинних протеаз і екзогенних субстанцій, створення умов для репарації [10]. Гострофазна відповідь являє собою сукупність місцевих та системних реакцій організму на тканинне ураження. Місцева реакція запускає механізм викиду медіаторів (серотоніну, гістаміну, ІЛ-1, ІЛ-6, простагландинів) у кров, що викликають системні реакції — гарячку, лейкоцитоз, збільшення продукції кортизолу, активацію системи комплемента, перенесення амінокислот із м''язів до печінки, збільшення синтезу гострофазних білків у печінці [10]. Під час інфекційного процесу продукти життєдіяльності мікроорганізмів (ендотоксини) стимулюють продукцію ІЛ-1, що посилює синтез та секрецію СРБ, і його концентрація у плазмі крові може підвищуватися в 1000 разів. У крові здорових людей, за даними літератури, концентрація СРБ підтримується на рівні менше ніж 10 мг/л [1, 3]. Синтез його відбувається в печінці зі швидкістю 1–10 мг/л на добу. Період півжиття цього білка становить 12–24 годин. СРБ людини складається з п''яти подібних нековалентно зв''язаних поліпептидних ланцюгів, утворюючи замкнений пентамер.
С-реактивний білок має важливу властивість — контактувати за участю кільця з деякими мікроорганізмами, до складу мембрани яких входить фосфорилхолін. Створений комплекс активує систему комплементу (С-3в). Це призводить до зв''язування С-3в з поверхнею мікроба, що опсонує агента, тобто проводиться підготовка до фагоцитозу. СРБ запускає комплементний каскад елімінації уламків клітин, а потім відновлення сполучної тканини [10, 12]. Цей гострофазний білок також може взаємодіяти з Т-лімфоцитами, регулюючи їхні функції в умовах запалення. Він є представником відразу декількох функціональних груп: медіаторів, транспортних білків, імуномодуляторів [10].
У наших дослідженнях лабораторна активність СРБ була достатньо інформативною незалежно від гестаційного віку новонароджених (табл. 3).

У 14 новонароджених (43,8 %) виявлено тяжке ураження головного мозку (ВШК 3-го ст., кісти мозку), що в усіх випадках збігалося з високими рівнями гострофазного білка і доповнювало оцінку тяжкості деструктивного ураження органу. У дітей із «травматичним» анамнезом рівні гострофазного білка підвищувалися тільки за наявності синдрому токсикозу. Така ж картина спостерігалась і у новонароджених із вадами розвитку. Вірогідної залежності показників СРБ від ступеня перенесеної асфіксії не відмічалося: середній рівень СРБ при тяжкій асфіксії був 15 мг/л, при середньому ступені тяжкості — 6 мг/л, при легкій — 45,8 мг/л, у дітей без асфіксії він у середньому становив 22,3 мг/л. Наявність дітей із синдромом токсикозу свідчила про коливання рівня даного білка в досліджуваних групах пацієнтів.
Залежно від віку, в якому було проведено аналіз, середній рівень гострофазного білка становив: у ранньому неонатальному періоді — 8,5 мг/л (n = 7), у віці 8–28 діб — 34,5 мг/л (n = 12), у грудному віці — 35,5 мг/л (n = 13). Наявність фізіологічних змін у синтезі протизапальних інтерлейкінів та СРБ у перші дні після народження [14] може пояснити низький рівень гострофазного показника в перші 7 днів, але це питання потребує подальшого дослідження.
При порівнянні даних про перебіг вагітності в плані інфекційного анамнезу та рівень СРБ у немовлят залежності не відмічалося. Середній показник цього білка в новонароджених від «інфекційних» вагітних становив 27,2 мг/л, від «неінфекційних» — 31,2 мг/л.
Високі показники IgG до TORCH-інфекцій не збігалися з коливаннями рівня СРБ, що відображало наявність пасивної материнської імунізації, а не було проявами інфекційного стану.
При порівнянні значення С-реактивного білка та загальних Ig сироватки крові в одному випадку (3,1 %) на фоні підвищеного рівня IgМ (6 г/л) дитина мала нормальний показник СРБ. У двох випадках (6,2 %) при низьких показниках цього Ig (нижче 0,4 г/л) рівень гострофазного білка був вищий за норму. Щодо загальних IgG, то тільки у двох пацієнтів (6,2 %) його високі показники збігалися з підвищенням рівня білка гострої фази. Не виявлено залежності рівня АСЛ-О від коливання показників СРБ. У 12 випадках (37,5 %) низькі рівні ЦІК (нижче 4 опт од.) збігалися з високим коливанням гострофазного показника (від 18 до 192 мг/л), тобто спостерігалася тенденція до зворотної залежності. Визначення рівня СРБ при некротичному ентероколіті мали фазові особливості: в гострий період захворювання він був високим (18–36 мг/л), тоді як при реконвалесценції його рівень досягав 6 мг/л, що використовувалося для комплексної оцінки стану дитини та можливості виходжування пацієнтів без антибактеріальної терапії. У 7 випадках (21,9 %) дослідження проводилося на фоні гострої ниркової недостатності (ГНН), що збігалися з високими рівнями білка гострої фази. У 4 дітей (12,5 %), які мали ознаки ГНН в анамнезі, показники цього білка були в нормі. Незважаючи на зниження рівня загального білка плазми або фракції альбумінів, що спостерігали у 37,5 % досліджених новонароджених, показники СРБ у них були високими. Порівнюючи рівні ТНФ- a і СРБ у 15 пацієнтів (46,9%), виявили збіг підвищених показників.
Під час оцінки активності інфекційно-запальних процесів у новонароджених дітей виявлено, що СРБ і ТНФ- a були найпоказовішими реактантами запалення, що підтверджується визначенням коефіцієнта діагностичної цінності k (табл. 4) [12].
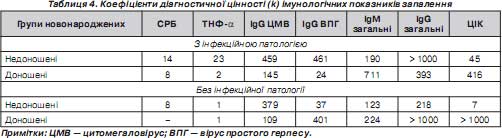
Серед обстежених новонароджених у 7 (21,9 %) перед визначенням рівня СРБ проводилося лікування препаратами крові: еритроцитарна маса, свіжозаморожена плазма, внутрішньовенні імуноглобуліни. У 3 (42,9%) дітей з цієї когорти визначалися високі рівні гострофазного білка.
Потрібне подальше дослідження можливого впливу препаратів крові на рівень цього гуморального медіатора.
Нами вивчалася залежність рівнів даного гострофазного реактанта від статі дитини (табл. 5).
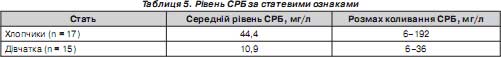
Виявлено, що у хлопчиків цей показник був частіше значно вищим, ніж у дівчаток.
Висновки
1. Визначення рівня С-реактивного білка має економічну доцільність, доступність і як мікрометод не несе ризику ятрогенних ускладнень для новонароджених пацієнтів.
2. Коливання рівня СРБ має високу специфічність щодо діагностики та керованості інфекційних станів у немовлят. Цей показник також може підвищуватися при тяжких ураженнях мозку та за наявності гострої ниркової недостатності в дітей.
3. Рівень білка гострої фази не має залежності від факторів перинатального періоду, не залежить від зниження концентрації загального білка плазми та його альбумінової частки у немовлят. Відмічається, що активність СРБ у новонароджених хлопчиків в 4 рази більша, ніж у дівчаток.
4. Ранній неонатальний вік пацієнта та застосування препаратів крові і внутрішньовенних імуноглобулінів може впливати на коливання рівня С-реактивного білка.
1. Дегтярева М.В., Бирюкова Т.В. Клинико-лабораторные особенности раннего неонатального сепсиса у детей различного гестационного возраста и оценка эффективности иммунозаместительной терапии пентаглобином // Педиатрия. — 2008. — № 1. — С. 32-40.
2. Македонський І.О., Бєлозьорова В.Л. Тридцятирічний досвід роботи відділення патології новонароджених Дніпропетровської дитячої клінічної міської лікарні № 3 // Перинатология и педиатрия. — 2007. — № 1. — С. 19-23.
3. Попов С.В., Юсак Л.А., Богданова А.В. Диагностическое значение гематологических индексов и рассчитываемых показателей у новорожденных детей с инфекционными заболеваниями // Современная педиатрия. — 2005. — № 1. — С. 191-194.
4. Шунько Є.Е., Кончаковська Т.В. Роль TNF-a, IL-1b та IL-6 у гіпоксично-ішемічному ураженні центральної нервової системи новонароджених // Педіатрія, акушерство та гінекологія. — 2002. — № 1. — С. 15-19.
5. Бондаренко М.П., Бєлозьорова В.Л Визначення фактора некрозу пухлин у новонароджених при різних патологічних станах // Материалы 1-й международной научно-практической конференции «Наука и технологии: шаг в будущее» / Медицина. — Белгород: Руснаучкнига, 2006. — С. 3-5.
6. Осипова Т.В. Індекс ендогенної інтоксикації як показник ефективності лікування гнійного менінгіту у новонароджених дітей // Педіатрія, акушерство та гінекологія. — 2000. — № 3. — C. 50-51.
7. Бузурная Е.М., Мельникова Е.В. Прокальцитонин как маркер ранних септических осложнений у новорожденных, оперированных по поводу пороков внутриутробного развития // Вестн. интенсивной терапии. — 2003. — № 2. — С. 71-73.
8. Таболин В.А., Яковлев М.Ю. Современные подходы к лечению токсико-септических состояний у новорожденных // Педиатрия. — 2002. — № 1. — С. 31-35.
9. Ситко Л.А., Чернышев А.К. Критерии тяжести и прогноза некротизирующего энтероколита у новорожденных // Детская хирургия. — 2003. — № 6. — С. 46-48.
10. Чукаева И.И., Богова О.Т. Инфаркт миокарда и воспаление // Медицина патологических состояний. — 2007. — № 4. — С. 19-23.
11. Вельков В.В. С-реактивный белок в лабораторной диагностике острых воспалений и оценке риска сосудистой патологии // Лабораторная диагностика. — 2007. — № 4. — С. 53-68.
12. Вороненко Ю.В., Москаленко В.Ф. Соціальна медицина та організація охорони здоров’я. — Тернопіль: Укрмедкнига, 2000. — С. 62-69.
13. Титов В.Н. С-реактивный белок — тест нарушения «чистоты» межклеточной среды организма при накоплении «биологического мусора» большой молекулярной маcсы // Клин. лаб. диагностика. — 2008. — № 2. — С. 3-14.
14. Безруков Л.О. Високий вміст інтерлейкінів-6 і -8 та С-реактивного білка як показник наявності у новонародженої дитини генералізованої інфекції // Перинатология и педиатрия. — 2007. — № 3. — С. 15.
