Журнал «Здоровье ребенка» 3 (24) 2010
Вернуться к номеру
Відмінності протезованого дихання в новонароджених із синдромом аспірації меконію
Авторы: Пицюра Н.С., Національний медичний університет ім. О.О. Богомольця, м. Київ
Рубрики: Педиатрия/Неонатология
Версия для печати
У статті подані особливості респіраторної терапії в новонароджених із синдромом аспірації меконію як однієї з актуальних проблем сучасної неонатології, перинатології та педіатрії в цілому. Виявлено тяжке пошкодження паренхіми легень у новонароджених із синдромом аспірації меконію, що потребує тривалого проведення штучної вентиляції легень.
Новонароджений, синдром аспірації меконію, механічна вентиляція.
В основі життєзабезпечення новонародженого та його адаптації до постнатального стану лежить достатнє функціонування системи газообміну, що включає в себе адекватне дихання, легеневий газообмін, гемоциркуляцію, повноцінне тканинне дихання [1–3]. Уся система повинна включитися протягом першої хвилини життя після народження дитини. У цей період відбувається перший вдих, виштовхування фетальної рідини з дихальних шляхів, «розправлення» альвеол за рахунок синтезу сурфактанту, дихальний газообмін. Поряд із цим відбуваються функціональні зміни з боку серцево-судинної системи [4].
Розглядаючи адаптацію новонароджених із синдромом аспірації меконію, потрібно враховувати патогенетичні механізми в легенях та організмі в цілому. Механічна обструкція дистальних відділів дихальних шляхів, хімічний пневмоніт та інактивація сурфактанту — це комплекс патофізіологічних реакцій, що обумовлює неможливість забезпечення адекватного газообміну в умовах позаутробного існування.
Метою даного дослідження було оцінити ознаки дихальних розладів та визначити, відповідно, особливості штучної вентиляції легень (ШВЛ) новонароджених із синдромом аспірації меконію, які були госпіталізовані до відділення реанімації та інтенсивної терапії новонароджених КМДКЛ № 2.
У дослідженні поданий аналіз даних 85 новонароджених із різним ступенем асфіксії, що надалі потребували проведення респіраторної підтримки та були госпіталізовані до дитячої лікарні протягом 2004–2008 років. Діти були розподілені на дві групи. До основної групи увійшли 62 новонароджені дитини з синдромом аспірації легень, яким проводилася штучна вентиляція легень від народження. Групу порівняння становили 23 новонароджені дитини з асфіксією помірного та тяжкого ступеня, які також потребували респіраторної підтримки від народження.
Критерії включення в основну групу новонароджених із синдромом аспірації меконію, яким проводилася механічна вентиляція легень, були такими:
— наявність меконію в амніотичній рідині;
— респіраторний дистрес у перші години життя;
— необхідність респіраторної підтримки;
— виключення інших причин дистресу.
Із дослідження виключалися новонароджені діти з уродженими вадами серця, аномаліями розвитку (діафрагмальна грижа, гіпоплазія легень тощо), набряком легень, недоношені новонароджені з респіраторним дистрес-синдромом, уродженими пневмоніями.
До групи порівняння були відібрані діти з асфіксією різного ступеня, народжені від матерів із чистими навколоплідними водами, які потребували інтубації трахеї та проведення штучної вентиляції легень від народження.
Дослідження параметрів ШВЛ проводилося постійно за допомогою апарата штучної вентиляції легень Bear Cub 750 psv із графічним монітором (США).
Новонароджені немовлята з різним ступенем асфіксії при народженні мають усі ознаки дезадаптації у вигляді дихальних розладів за рахунок вищезгаданого комплексу патогенетичних реакцій (основна група) та центрального генезу (група порівняння).
Клінічні ознаки дихальної недостатності подані в табл. 1, дані якої свідчать, що клінічно остання в обох групах має майже однакову частоту проявів: периферичний ціаноз (67,7 vs 82,6 %), переважно тахіпное (61,3 vs 69,6 %) та дихання з участю допоміжної мускулатури, тобто втягування міжреберних проміжків, епігастральної ділянки, яремної ямки (77,4 vs 56,5 %). Даний факт лише підкреслює неспецифічність ознак.
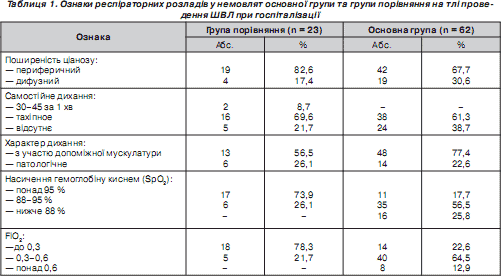
Поряд із цим показник насичення гемоглобіну киснем був у межах 88–95 % у 56,5 % новонароджених із синдромом аспірації меконію на фоні високої оксигенозалежності за рахунок парціальної частки кисню в дихальній суміші, що була в межах 0,3–0,6 у 40 (64,5 %) немовлят цієї ж групи. Ці дані свідчать про утруднення процесів газообміну, зниження оксигенації крові за рахунок порушення дифузії газів через ушкоджену альвеолярно-капілярну мембрану в новонароджених основної групи.
Однак, слід відзначити, що насичення гемоглобіну киснем нижче 88 % та парціальна частка кисню в повітряній суміші понад 0,6 у дітей основної групи зустрічається в небагатьох випадках (25,8 та 12,9 %). Поясненням даного факту, на нашу думку, є те, що немовлята з синдромом аспірації меконію, критичний стан при народженні яких унеможливлював переведення до відділення реанімації новонароджених дитячої лікарні до першої доби, були госпіталізовані в більш пізні строки (після першої доби) після стабілізації стану за рахунок покращення оксигенації при більш високих показниках насичення гемоглобіну киснем та нижчих показниках FiO 2 .
З іншого боку, діти групи порівняння мали адекватну дифузію газів у непошкоджених легенях, про що свідчать високі показники насичення гемоглобіну киснем та низький рівень парціальної частки кисню в суміші у великої кількості новонароджених — 73,9 та 78,3 %.
Завдяки інноваціям у галузі медичної техніки сьогодні стало можливим протезування вентиляції легень у новонароджених від народження за допомогою різних методик та засобів.
Традиційна штучна вентиляція легень — це метод респіраторної терапії, заснований на активному нагнітанні повітряно-кисневої суміші в легені під тиском та створенні умов для пасивного видиху, що й визначає достатній газообмін при створенні достатнього тиску на вдиху та видиху, концентрації кисню та його потоку [1, 2, 3, 5, 7–9, 13].
Респіраторна терапія — один із складних методів лікування, особливо в періоді новонародженості, адже спектр вентилятор-індукованих (VILI — ventilator induced lung injury) та вентилятор-асоційованих ушкоджень легень (ventilator associated lung injury) в новонароджених досить широкий [2, 5, 10, 11, 13, 14].
Серед основних ускладнень потрібно виділити волюмо-, баротравму, ателектотравму (перерозподіл дихального об''єму), синдром витоку повітря (пневмоторакс, легенева інтерстиційна емфізема, бронхоплевральна фістула тощо), внутрішньошлуночкові крововиливи, серцево-судинні розлади, перивентрикулярну лейкомоляцію, ретинопатію, туговухість, бронхолегеневу дисплазію, хронічні легеневі захворювання (токсична дія кисню, інгібування сурфактанту, збільшення альвеолярно-капілярної проникності та просочування рідини та білка, запальна відповідь — біотравма) тощо [5, 7–9, 12].
Проводячи респіраторну підтримку новонародженим, ми у своєму дослідженні намагалися вирішити такі завдання: досягнення та підтримка адекватного газообміну та альвеолярної вентиляції, мінімізація ризику баротравми та серцево-судинних порушень, досягнення комфорту шляхом ліквідації десинхронізації, забезпечення мінімальної м''язової роботи.
Головним принципом, яким ми керувалися, розпочинаючи механічну вентиляцію госпіталізованим новонародженим, було використання тригеру, завдяки якому відбувалося забезпечення апаратного дихального циклу, що синхронізований із самостійними дихальними спробами новонародженого. Максимальну чутливість (0,01 л/хв) серед існуючих має тригерний пристрій респіратора Bear Cub (США), який є одночасно й датчиком потоку, що максимально близько розташований до пацієнта. Відстань між датчиком та пацієнтом має велике значення і повинна бути мінімальною для отримання об''єктивних показників ефективності вентиляції. Поряд із цим датчик потоку менше реагує на нереспіраторні сигнали (G. Dimitriou et al., 1998; W. Nikischin et al., 1996).
Респіратор Bear Cub забезпечує вентиляцію легень із контролем за тиском (pressure control). Серед переваг даного виду механічної вентиляції в новонароджених є обмеження високого тиску, що значно знижує ймовірність баротравми, а також мінімізація роботи дихання.
Лабільний дихальний об''єм, що характерний для даного виду вентиляції, ми максимально контролювали за допомогою графічного моніторингу петель та кривих, що дозволяє в режимі реального часу оцінювати еластичність легеневої тканини (легеневий комплайєнс) та змінювати параметри вентиляції відповідно до коливань механічних властивостей легень. Таким чином, ми забезпечували принцип «захисної» вентиляції в новонароджених обох груп.
Поряд із цим, застосовуючи за допомогою тригеру стратегію респіраторної підтримки, при якій апаратний вдих ініціюється самою дитиною при наявності самостійних дихальних рухів, ми уникали можливої десинхронізації з респіратором. Адже асинхронність між спонтанними та механічними дихальними рухами — дуже важливий недолік вентиляції, що призводить, за літературними даними, до низки негативних ефектів: коливання артеріального тиску (Amitay, 1993; Hummler, 1996), збільшується рівень стресорних гормонів (Quinn, 1998), зростає потреба в седації та міорелаксації (Henry, 1979), збільшуються ризик виникнення та ступінь внутрішньошлуночкових крововиливів (Periman, 1985), зменшується дихальний об''єм (Hummler, 1996; Rosas, 1992), збільшується робота дихання (Jarreau, 1996), зменшується оксигенація (Cleary, 1995; Henry, 1979), з''являється активний видих (Heldt & Bernstein; Greenough, 1985), збільшуються ризик синдрому витоку повітря (Greenough, 1983, 1984) та тривалість вентиляції (Donn, 1994).
Десинхронізації ми уникали також за рахунок вчасної санації дихальних шляхів за результатами оцінки даних графічного моніторингу, оцінки рівня знаходження ендотрахеальної трубки, купірування судомного синдрому, корекції параметрів ШВЛ, а при неефективності — медикаментозно, під контролем клініко-інструментальної оцінки гемодинаміки (середній артеріальний тиск, частота серцевих скорочень, стан периферичного кровообігу тощо).
Відлучення від респіратора відбувалося шляхом пробної екстубації з будь-якого режиму за умови максимально фізіологічних параметрів вентиляції або шляхом тривалого тренування самостійного дихання через інтубаційну трубку із підтриманням лише позитивного тиску на видиху за рахунок постійного базового потоку (СРАР — continuous positive airway pressure) за умови достатнього насичення гемоглобіну киснем (SpO 2 ).
З огляду на вищезазначене ми розпочинали проведення ШВЛ із тригерних режимів, що представлені в даному респіраторі: допоміжна або контрольована вентиляція (A/C — Assist/Control), синхронізована переміжна примусова вентиляція (SIMV — synchronized intermittent mandatory ventilation), вентиляція з підтримкою тиском (PSV — pressure support ventilation) або комбіновані режими — SIMV/PSV.
Щодо індивідуальних особливостей кожного режиму, то А/С — це режим, при якому респіратор підтримує та перетворює кожну самостійну дихальну спробу пацієнта на апаратний вдих (аssist ventilation — допоміжна), а за відсутності останніх генерує апаратні дихання з установленими параметрами (частота вдихів, максимальний тиск на вдиху, час вдиху тощо) та набуває характеру контрольованої вентиляції (Control ventilation, IPPV, IMV). Придатний для стартового застосування в пацієнтів із непостійним спонтанним диханням та слабкістю дихальних м''язів. Застосування даного режиму зменшує потребу в седації пацієнтів при максимальній чутливості тригера, що забезпечує повну синхронізацію та мінімальну роботу дихання з подальшим м''яким зниженням дихальної респіраторної підтримки за відсутності коливань показників центральної гемодинаміки [2, 5, 15].
За наявності спонтанних дихальних зусиль у режимі SIMV/IMV апаратне дихання підтримується тиском із частотою, що контролюється лікарем і повністю синхронізується з самостійним диханням пацієнта (SIMV). При цьому спонтанне дихання, що виходить за межі встановленої частоти, відбувається в режимі СРАР, тому має значення достатній рівень основного, постійно циркулюючого потоку в контурі (base flow) для подолання резистентності інтубаційної трубки. За умови відсутності спонтанного дихання в пацієнта вентиляція набуває значення переміжної примусової вентиляції (IMV), що за фізикою дихання не відрізняється від режиму A/C за даних умов.
Режим SIMV/IMV дозволяє перевести дитину на самостійне дихання шляхом поступового зниження частоти дихання, що генерується респіратором. Однак, на нашу думку, можливі коливання гемодинаміки в результаті коливання внутрішньогрудного тиску при значній різниці між фізичними характеристиками спонтанного та апаратного вдиху за рахунок різного дихального об''єму.
Режим PSV дозволяє пацієнту самостійно контролювати частоту дихання, інспіраторний потік, час вдиху, що сприяє повній синхронізації не лише інспіраторної, але й експіраторної фази дихання. Поряд із цим за відсутності самостійного дихання апаратні вдихи не генеруються, тобто режим подібний до СРАР, але з мінімальною роботою дихання. Адже при диханні в режимі СРАР через інтубаційну трубку робота дихання надзвичайно висока через зусилля на подолання аеродинамічного опору (резистентність) інтубаційної трубки, що призводить до виснаження немовлят та повернення до примусового режиму і, як наслідок, збільшення тривалості вентиляції.
Тому, на нашу думку, ідеальним режимом початку вентиляції є комбінований режим SIMV/PSV, при якому апаратна частота дихання синхронізована із самостійними вдихами та має примусовий характер, а самостійні дихання, що не підтримуються контрольованими фіксованими параметрами, відбуваються в ізольованому режимі PSV. Дана комбінація адекватна як для терапії дихальної недостатності, так і для відлучення від респіратора з мінімальними коливаннями гемодинаміки та роботи дихання.
Режими, циклічні за потоком (Flow cycled SIMV, Flow cycled A/C), також ідеальні для респіраторної підтримки новонароджених із дихальною недостатністю центрального генезу, хірургічною патологією, тобто при інтактній легеневій паренхімі. Адже дихальний цикл закінчується після досягнення заданого потоку повітряної суміші в дихальні шляхи, чого може бути недостатньо для забезпечення адекватної оксигенації при патології зі зниженою еластичністю легеневої тканини [2]. Але ми у своєму дослідженні використовували дані режими не у стартовій терапії ШВЛ, а лише на проміжних етапах.
Розподіл обстежених дітей залежно від стартового режиму ШВЛ поданий у табл. 2.
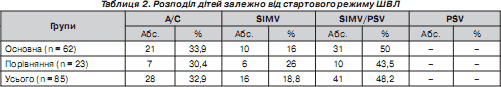
Привертає увагу факт відсутності серед стартових режимів в обстежених новонароджених режиму з підтримкою тиску (PSV) у чистому вигляді. У новонароджених із синдромом аспірації меконію цей факт легко пояснити тим, що даний режим забезпечує самостійне дихання з максимально фізіологічними параметрами за умови адекватної дифузії газів із боку неушкодженої паренхіми легеневої тканини. Однак, з іншого боку, діти групи порівняння мають інтактну легеневу тканину, але при цьому в них теж цей режим не використовувався через наявність патологічної нервової симптоматики набряку мозку внаслідок асфіксії (відсутність самостійного дихання або його неефективність через тахіпное, участь допоміжної мускулатури в акті дихання, судомний синдром).
За літературними даними, застосування pressure control (PSV) вентиляції обмежене у стартовій терапії тяжкої дихальної недостатності, особливо апное центрального генезу, через значні коливання дихального об''єму і, як наслідок, хвилинної вентиляції [5, 6].
У нашому дослідженні переважало використання на початку респіраторної терапії в дітей обох груп (48,2 %) комбінованого режиму (SIMV/PSV) завдяки вищезазначеним перевагам.
Отже, розпочинаючи респіраторну підтримку у відділенні реанімації та інтенсивної терапії новонароджених дитячої лікарні, ми намагалися встановити такі параметри апаратних вдихів, які б забезпечували розправлення колабованих альвеол, стабілізували їх на вдиху та видиху та попереджали їх кінцево-інспіраторне перерозтягнення. Поряд із цим адекватна оксигенація повинна була досягатися ще й мінімальною парціальною часткою кисню в дихальній суміші для зменшення токсичного впливу останнього на організм немовляти.
Необхідно підкреслити, що дихальна суміш, що доставлялася до альвеол через дихальний контур апарата та інтубаційну трубку, була зволожена та підігріта таким чином, що при температурі 37 °С та 100% відносній вологості абсолютна вологість відповідала 44 мг/л води, що є фізіологічною та запобігає руйнуванню сурфактанту. Адже під час штучної вентиляції легень дана функція верхніх дихальних шляхів у новонароджених на тлі протезованого дихання виключена.
Для встановлення певних параметрів на апараті ШВЛ ураховувалася фактична вага новонародженого, адже певні параметри мають певну лінійну залежність із нею.
Критеріями задовільного підбору параметрів були не лише насичення гемоглобіну киснем, але й об''єктивний стан немовляти (колір шкіри, участь допоміжної мускулатури в акті дихання тощо), а в деяких випадках і показники кислотно-лужного стану крові та рівень вуглекислого газу в експіраторній порції повітря (EtCO 2 ) — капнографія.
Незважаючи на вентиляцію з контролем тиску в даному апараті ШВЛ, ми все ж таки намагались моніторувати й об''ємні показники, дотримуючись вищезазначених захисних стратегій при проведенні ШВЛ, тому частота апаратної дихальної підтримки встановлювалася як мінімальна для забезпечення хвилинної вентиляції легень (ХВЛ) із розрахунку 200–300 мл/кг [7], де ХВЛ дорівнює добутку дихального об''єму (4–6 мл/кг) та частоти дихання.
Поряд із цим покращення оксигенації крові ми досягали, впливаючи на два показники: парціальну частку кисню в дихальній суміші (FiO 2 ) та середній тиск у дихальних шляхах (МАР). Останній визначає поняття жорсткості механічної вентиляції та є інтегральним показником, що моніторується безпосередньо апаратом ШВЛ або підраховується за формулою:
МАР = [(f + Tin)/ 60 ] · (PIP – PEEP) + PEEP.
З формули стає зрозумілим, що на величину середнього тиску в дихальних шляхах більшою мірою впливає позитивний тиск в кінці видиху (РЕЕР).
При величині середнього тиску в дихальних шляхах в межах 4,0–6,0 механічна вентиляція проводиться з параметрами, максимально наближеними до фізіологічних, що вказує на мінімальну інвазивність даного виду терапії.
Параметри механічної вентиляції, із яких розпочинали терапію, подані в табл. 3.
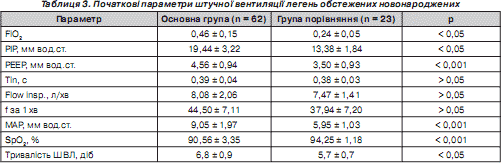
На нашу думку, різницю оксигенації на фоні механічної вентиляції легень в обстежених новонароджених добре ілюструє показник насичення гемоглобіну киснем, що вірогідно відрізняється (р < 0,001) в новонароджених із синдромом аспірації легень та немовлят групи порівняння — це лише підкреслює більш глибокі порушення метаболізму.
Парціальна частка кисню в дихальній суміші в новонароджених основної групи коливається від 0,21 до 0,8 та в середньому становить 0,46 ± 0,15, що відрізняється (р < 0,05) від такої в новонароджених групи порівняння, у якій коливання дещо обмежене — 0,21–0,4 (0,24 ± 0,05). Ми вважаємо, що даний показник додатково підкреслює факт утрудненої дифузії газів через альвеолярно-капілярну мембрану в новонароджених із синдромом аспірації меконію.
Отже, при аналізі інвазивності проведення респіраторної терапії за величиною середнього тиску в дихальних шляхах привертає увагу значне коливання даного показника в новонароджених із синдромом аспірації меконію в межах від 14,3 до 6,0 мм вод.ст. та його середнє значення — 9,05 ± 1,97, що вірогідно відрізнялось у новонароджених групи порівняння (р < 0,001). На нашу думку, це в черговий раз підкреслює паренхіматозне ураження легень у новонароджених основної групи, адже у немовлят групи порівняння даний показник наближається до фізіологічного — 5,95 ± 1,03 із коливаннями від 8,3 до 4,4 мм вод.ст.
Можемо відзначити, що піковий тиск на висоті вдиху (РІР) (р < 0,05) та позитивний тиск в кінці фази вдиху (РЕЕР) (р < 0,001) вірогідно вище у групі дітей із синдромом аспірації меконію. Очевидно, що адекватна оксигенація досягалася саме підвищенням даних параметрів. З одного боку, позитивний тиск на видиху найбільше впливає на МАР, як ми вже підкреслювали, про що свідчить рівень вірогідності р < 0,001. Поряд із цим піковий тиск на вдиху — це параметр, що прямо пропорційний дихальному об''єму, як наслідок, він забезпечує збільшення площі альвеол для дифузії газів протягом часу вдиху.
З іншого боку, чергування ділянок перерозтягнення та обструкції внаслідок обтурації меконієм обумовлює нерівномірність еластичних властивостей легень, що унеможливлює досягнення плато для покращення оксигенації шляхом збільшення площі дифузії, що досягається короткочасною не фізіологічною, а вимушеною затримкою розкритих альвеол на висоті вдиху за рахунок підвищення або часу вдиху, або інспіраторного потоку повітряної суміші. Саме порівняння цих параметрів — часу вдиху, дихального потоку — не виявило вірогідної різниці в групах (р > 0,05).
Поряд із цим тривалість штучної вентиляції легень, як видно з табл. 3, становила 6,8 ± 0,9 доби в новонароджених основної групи, що вірогідно відрізнялась (р < 0,05) від такої в новонароджених групи порівняння (5,7 ± 0,7доби).
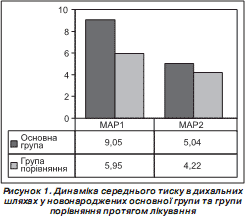
Ми порівнювали стартові параметри штучної вентиляції легень у новонароджених обох груп при надходженні до дитячої лікарні (МАР1) з параметрами на 2-гу–3-тю добу лікування (МАР2) (рис. 1). При цьому у 5 випадках (21,7 %) новонародженим було проведене відлучення від респіратора з переведенням на самостійне дихання. Аналізуючи динаміку інвазивності респіраторної терапії за показником середнього тиску в дихальних шляхах (рис. 1), можна відзначити, що у групі дітей із неврологічною симптоматикою внаслідок асфіксії параметри вентиляції наближаються до фізіологічних зі значною тенденцією до зниження в динаміці — із 5,95 до 4,22. У групі дітей із синдромом аспірації меконію на 3-тю добу з моменту госпіталізації всі діти отримували респіраторну підтримку. Привертає увагу «пом''якшення» параметрів за рахунок зниження інтегрального показника інвазивності механічної вентиляції (МАР). Поряд із цим лише 22,6 % пацієнтів (14 немовлят) основної групи мали потребу в кисні (FiO 2 — 0,3–0,6) для покращення оксигенації на 2-гу–3-тю добу.
Отже, клініка дихальних розладів у немовлят основної групи та групи порівняння не відрізнялася за частотою притаманних ознак. Новонароджені немовлята з синдромом аспірації легень мають значне паренхіматозне ушкодження легеневої тканини, на що вказує більш висока парціальна частка кисню в дихальній суміші. Ураховуючи більш «жорстку» вентиляцію легень за показником середнього тиску в дихальних шляхах, новонароджені основної групи в результаті потребують тривалого проведення ШВЛ.
1. Аверин А.П. Особенности проведения традиционной искусственной вентиляции у новорожденных (развитие респираторных технологий, новые стратегии). Часть 1 // Журнал интенсивной терапии. — 2005. — № 2. — С. 34-38.
2. Аверин А.П. Особенности проведения традиционной искусственной вентиляции у новорожденных (развитие респираторных технологий, новые стратегии). Часть 2 // Журнал интенсивной терапии. — 2006. — № 2. — С. 44-53.
3. Киреев С.С., Ващенко О.Н. Респираторная терапия у новорожденных // Патология. — 2005. — Т. 2, № 3. — С. 12-14.
4. Лукьянов М.В. Влияние традиционной и высокочастотной ИВЛ на легочную гемодинамику: Автореф. дис… канд. мед. наук. — М., 1991.
5. Фомичев М.В. Респираторная поддержка в неонатологии. — Екатеринбург: Уральское издательство, 2002. — 56 с.
6. Donn S., Becker M. Baby in control: Neonatal pressure support ventilation // Neonat. Intens. Carе. — 1998 — V. 11, № 7.
7. Eichenwald E.C. Mechanical ventilation. Manual of neonatal care. — Philadelphia: Lippincott Williams & Wilkins, 2004. — 5th edition. — Р. 348-61.
8. Frankel L.R. Mechanical ventilation. Nelson Text book of Pediatrics. — Philadelphia: Saunders, 2004. — 17th edition. — Р. 303-6.
9. Ghulam Nabi. Mechanical ventilation in infants // JK-Practitioner. — 2005. — Vol. 12, № 1.
10. Leung P., Jubran A., Tobin M.J. Comparison of assisted ventilator modes on triggering, patient effort, and dyspnea // Am. J. Respir. Crit. Care Med. — 1997. — 155(6). — 1940-1948.
11. Mathur N.C., Kumar S., Prasana A.L., Sahu U.K., Kapoor U.K., Roy S., Chandra R., Mathur Y.C. Intermittent positive pressure ventilation in a neonatal intensive care unit. Hyderabad experience // Indian Pediatrics. — 1998. — 35. — 349-52.
12. Riyas P.K., Vijaykumar K.M., Kulkarni M.L. Neonatal mechanical ventilation // Indian J. Pediatr. — 2003. — 70(7). — 537-40.
13. Steven H.F. Respiratory Monitoring // Respiratory Care Clinics of North America. — 2000. — Vol. 6, № 4.
14. Tobin M.J., Jubran A., Laghi F. Patient-ventilatior interaction // Am. J. Resp. Crit. Сare Med. — 2001. — 163(5). — 1059-1063.
15. Younes M. Proportional assist ventilation, a new approach to ventilatory support // Theory. Am. Rev. Respir. Dis. — 1992. — 145(1). — 114-120.
