Журнал «Здоровье ребенка» 3 (24) 2010
Вернуться к номеру
Клинико-лабораторные аспекты синдрома короткой кишки у детей
Авторы: Грона В.Н., Веселый С.В., Вакуленко М.В., Борей Т.В., Сопов Г.А., Кафедра детской хирургии Донецкого национального медицинского университета им. М. Горького на базе Областной детской клинической больницы г. Донецка
Рубрики: Педиатрия/Неонатология
Версия для печати
У детей, перенесших резекцию более 50 см кишечника, развивается синдром короткой кишки. Клинические проявления его зависят от уровня и объема резекции кишечника и адаптационных возможностей организма ребенка. Реабилитационные мероприятия у детей с синдромом короткой кишки должны включать коррекцию нарушенного всасывания и восстановление нормального трофического статуса; купирование диареи, профилактику и лечение дисбактериоза; контроль и коррекцию общих дигестивных нарушений; корригирование патологических психосоциальных аспектов. Дети с синдромом короткой кишки нуждаются в постоянном диспансерном наблюдении педиатра, эндокринолога и хирурга.
Дети, синдром короткой кишки, диагностика, реабилитация.
Введение
После выполнения обширных резекций кишечника у детей качество жизни и реабилитация последних в последующем затруднены в связи с возникновением клинического синдрома, описанного как синдром короткой кишки (СКК), а также последствиями, возникающими после проведения такого рода оперативных вмешательств [3, 5, 9]. На протяжении многих лет в зарубежной литературе, особенно в англоязычной, подобное состояние определяется термином «синдром короткой кишки» [3]. На сегодняшний день считается, что синдром короткой кишки — это клинический синдром, который характеризуется комплексом патофизиологических нарушений, развивающихся после обширной резекции тонкой, толстой или тонкой и толстой кишки, и проявляется нарушением кишечного всасывания (мальабсорбцией) [3–6].
Практически у всех пациентов с СКК возникают хронические осложнения дигестивного аппарата. Основными из них являются снижение массы тела, заболевания печени, связанные с парентеральным питанием, диарея, явления дисбактериоза кишечника. Тяжесть клинических проявлений зависит от многих факторов. Прежде всего от протяженности оставшегося участка кишки и места резекции (тощая кишка, подвздошная кишка), наличия или отсутствия илеоцекального клапана. Течение СКК во многом зависит от адаптационных возможностей оставшейся части кишки. У детей адаптационные и приспособительные механизмы активизируются раньше, чем у взрослых, и имеют более выраженный динамический характер [10].
Дети, перенесшие обширную резекцию кишечника, после выписки из хирургического стационара попадают к педиатру, который зачастую затрудняется оценить характер и степень дигестивных нарушений, а также выработать рациональную тактику реабилитации.
Целью нашей работы была оптимизация тактики реабилитации детей с синдромом короткой кишки.
Материалы и методы
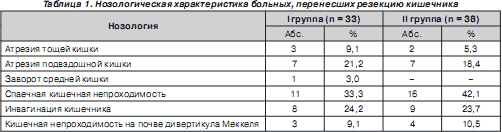
Были изучены результаты лечения 71 больного в возрасте от 1 года до 16 лет, оперированных в клинике детской хирургии Донецкого национального медицинского университета им. М. Горького за период с 1991 по 2008 гг. Всем больным была выполнена резекция тонкого кишечника, в том числе 15 детям (21,1 %) — резекция тощей кишки, 46 (64,8 %) — резекция подвздошной кишки, 10 пациентам (14,1 %) — резекция подвздошной кишки и илеоцекального угла. Пациенты были разделены на 2 группы. I группу составили 33 ребенка, которые перенесли обширную (более 50 см ) резекцию кишечника (тощей кишки, подвздошной кишки и илеоцекального угла). У всех пациентов первой группы имели место клинические признаки приобретенной (вторичной) формы мальабсорбции и синдрома короткой кишки.
II группу составили 38 детей, которые перенесли резекцию (от 20 см до 50 см ) тощей или подвздошной кишки и у которых не были выявлены клинические признаки мальабсорбции и синдрома короткой кишки. Характер нозологии у больных этих двух групп представлен в табл. 1. Клинические и лабораторные данные обследования пациентов, перенесших резекцию кишечника, сравнивали с аналогичными у 20 практически здоровых детей ( III группа), не имеющих в анамнезе гастроэнтерологической патологии. Параметры возраста и пола были идентичны таковым у больных I и II групп.
Клинико-лабораторные аспекты изучались в динамике в сроки от 1 года до 10 лет после операции. У всех детей изучались жалобы при поступлении (наличие и характер боли в животе, тошноты, явлений полифекалии и диареи), данные копроцитограммы, общего и биохимического анализов крови, электролитный состав крови, микробный пейзаж кала, показатели микроскопии солевого осадка мочи и результаты фиброгастродуоденоскопии с рН-метрией и уреазным тестом (только у пациентов I и II группы).
Результаты и их обсуждение
Периодические боли в животе, явления полифекалии и диарея были выявлены у всех детей I группы; постоянная тошнота отмечена у 28 человек (84,8 %). Во II группе периодические боли в животе были выявлены у 23 детей (60,5 %), явления полифекалии и диареи — у 8 детей (21,1 %) и жалобы на наличие тошноты — у 15 детей (39,5 %). У детей III группы вышеуказанные жалобы отмечены не были.
Данные фиброгастродуоденоскопии свидетельствуют о том, что в I группе гиперацидная гастропатия выявлена у 33 детей (100 %), причем у 24 (72,7 %) — с эритематозной трансформацией слизистой, у 9 больных (27,3 %) — с изменениями гиперпластического характера. Во II группе наличие гастрита выявлено у 23 (60,5 %) детей, эритематозная трансформация слизистой диагностирована у 18 (65,2 %) пациентов. При проведении уреазного теста у 19 детей I группы (57,6 %) получен отрицательный результат, аналогичные данные выявлены и во II группе детей — 15 больных (65,2 %) с отрицательным результатом уреазного теста. Явления дуоденита были отмечены у большинства больных обеих групп — у 19 (57,6 %) и 15 (65,2 %) соответственно.
Результаты копроцитограммы и бактериологического анализа на дисбактериоз оказались следующими. В I группе жидкая консистенция стула, наличие скрытой крови и значительное увеличение количества лейкоцитов в кале отмечено у 19 детей (57,6 %), стул кашицеобразной консистенции выявлен у 14 (42,4 %), наличие крахмала и большого количества нейтрального жира — у 24 (72,7 %), а обилие слизи и явления дисбактериоза определены у 28 детей (84,8 %). Во II группе пациентов, имеющих жидкую консистенцию стула, не оказалось, однако стул кашицеобразной консистенции, с обилием зерен крахмала, отмечен у 23 детей (60,5 %). Скрытая кровь и нейтральный жир обнаружены в 8 случаях (21,1 %), у 30 больных (78,9 %) визуализирована обильная слизь, а у 15 детей (39,5 %) — бактериологические признаки дисбактериоза.
В общем анализе крови все исследуемые показатели у детей I и II групп были ниже, чем у детей группы контроля. У больных I группы отмечен самый низкий уровень эритроцитов — 3,10 ± 0,21 Т/л, в то время как данный показатель у детей II и III групп составил 3,90 ± 0,07 и 4,6 ± 0,7 Т/л соответственно. Уровень гемоглобина у пациентов I группы был 101,0 ± 2,0 г/л, что существенно ниже аналогичного показателя во II и III группах (124,0 ± 1,0 и 135,0 ± 3,0 г/л соответственно). Отмечено незначительное снижение гематокрита и цветного показателя у детей I группы (36 ± 1 % и 0,84 ± 0,02 соответственно), во II и III группах эти показатели были в пределах нормы.
Анализируя данные биохимического исследования крови, отметили, что у детей I группы имелось снижение уровня всех исследуемых электролитов (К, Са, Na, Р, Сl). У детей II и III групп состояние электролитного состава крови соответствовало нормальным показателям. Содержание общего билирубина, глюкозы, показатели АСТ, АЛТ во всех трех группах находились в пределах нормы. В I и II группах отмечалось снижение содержания общего белка по сравнению с III группой (58,7 ± 2,4; 69,7 ± 1,6 и 78,0 ± 1,2 г/л соответственно). Иммунограмма (табл. 2) свидетельствует о снижении уровня всех иммуноглобулинов у больных I группы по сравнению со II и III группами, особенно классов IgA и IgM, что свидетельствует о развитии вторичного иммунодефицитного состояния у пациентов с СКК.

Состояние моторно-эвакуаторной функции изучали на основании времени пассажа бариевой взвеси.
Анализ состояния моторно-эвакуаторной активности кишечника (табл. 3) выявил у большинства детей I группы (72,7 %) повышенно-ускоренную, а у 27,3 % детей — умеренно-ускоренную эвакуаторную активность. У детей II группы в 78,9 % случаев определялась умеренно-ускоренная, а в 21,1 % случаев — нормальная эвакуаторная активность кишечника.

Резюмируя изложенное, можно сделать вывод, что у детей, перенесших резекцию более 50 см кишечника, развивается синдром короткой кишки. Разработка рациональной схемы реабилитационных мероприятий у таких пациентов является многоступенчатым процессом, включающим в себя достижение четырех первичных целей: 1) коррекцию нарушенного всасывания и восстановление нормального трофического статуса; 2) купирование диареи, профилактику дисбактериоза, ферментативную поддержку; 3) контроль и коррекцию желудочно-кишечной гиперсекреции, иммунологических изменений, а также нарушенной двигательной функции тонкой кишки; 4) учет и корригирование психосоциальных аспектов повседневной жизни больных.
Резекция тощей кишки обычно переносится удовлетворительно при условии сохранения подвздошной кишки и илеоцекального клапана. Несмотря на то что большинство пищевых веществ всасываются именно в тощей кишке, диарея и метаболические нарушения при данном типе операции не столь выражены. В этих случаях компенсаторные функции берет на себя сохраненная подвздошная кишка. Однако при таком оперативном пособии имеет место нарушение нормального процесса пищеварения ввиду наличия ферментативной недостаточности. В данном случае необходимо акцентировать внимание на заместительной терапии препаратами ферментов поджелудочной железы (креон, панзинорм, мезим форте, панкреатин). Данная терапия способствует не только улучшению переваривания и усвоения питательных веществ, но и уменьшению диарейного синдрома [3, 10, 11].
При обширной резекции подвздошной кишки резко нарушается всасывание жидкости, секретируемой тонкой кишкой, и развивается тяжелая секреторная диарея, которая может усугубляться наличием солей желчных кислот в просвете кишки. При отсутствии дистального отдела подвздошной кишки не происходит всасывания желчных кислот и витамина В 12 . Все это может приводить к тяжелой недостаточности питания. С целью предотвращения трофической недостаточности в ранние сроки после оперативного лечения следует начинать парентеральное питание. Для покрытия суточной потребности в белках назначают парентеральное введение смесей аминокислот. С целью восполнения липидных субстратов и покрытия энергетических затрат применяют жировые эмульсии [3, 10]. В настоящее время для лечения больных детей с синдромом короткой кишки рекомендуется раннее начало энтерального питания, которое способствует повышению адаптационных возможностей оставшейся части кишки и улучшению всасывания и переваривания пищи. Суточная потребность жиров должна покрываться преимущественно за счет триглицеридов, содержащих короткоцепочечные или среднецепочечные жирные кислоты [6, 8–10].
Потеря баугиниевой заслонки, как правило, приводит к возникновению восходящего обсеменения бактериальной флорой тонкой кишки. Кишечный дисбиоз может усугубить мальабсорбцию пищевых ингредиентов и кобаламина. Это приводит к увеличению в просвете кишки недорасщепленных и утилизированных нутриентов, что повышает осмолярность кишечного содержимого и обусловливает усиление диареи. Важное место в данной ситуации занимает применение адсорбирующих препаратов, обладающих способностью связывать избыток органических кислот (смекта, полисорб, энтеросгель, атоксил), и препаратов пробиотического действия (бифиформ, биогая, линекс, йогурт) [3, 4, 10].
С целью предупреждения возникновения рефлюксных состояний при резекции илеоцекального угла, приводящих к нарушению многих констант гомеостаза, необходимо формирование тонко-толстокишечного соустья с антирефлюксной защитой.
Одними из основных моментов в разработке реабилитационных мероприятий для больных с синдромом короткой кишки являются учет и корригирование психосоциальных аспектов. Исследования, проведенные у детей и подростков с СКК, вскрыли психосоциальные проблемы, существующие внутри семьи и в окружающей социальной среде. У пациентов обнаруживаются эмоциональные нарушения, которые коррелируют с тяжестью заболевания и с психосоциальным стрессом. Таким образом, с точки зрения холизма (т.е. признания целостности организма) для оптимизации качества жизни пациентов важно принимать во внимание не только соматические нарушения, но и их психологические аспекты. Тщательно продуманное содружественное лечение как соматической, так и психологической сферы делает достижение полноценной реабилитации более реальным. Необходимо тщательно учитывать фазы развития и механизмы копинга (стратегии преодоления заболевания), свойственные детскому организму. Результатом такой холистической стратегии может стать исчезновение психопатологических нарушений при достижении ремиссии соматического заболевания.
Выводы
1. У детей, перенесших резекцию более 50 см кишечника, развивается синдром короткой кишки. Характер клинических проявлений СКК зависит от уровня и объема резекции кишечника и адаптационных возможностей организма ребенка.
2. У детей, перенесших резекцию тонкой кишки объемом до 50 см с сохранением баугиниевой заслонки, на протяжении двух лет происходит адаптация процессов пищеварения и всасывания.
3. Дети с синдромом короткой кишки нуждаются в постоянном диспансерном наблюдении педиатра, эндокринолога и хирурга.
4. Реабилитационные мероприятия у детей с синдромом короткой кишки должны включать коррекцию нарушенного всасывания и общих дигестивных нарушений, купирование дисбиоза и нарушений дефекации, корригирование патологических психосоциальных аспектов.
1. Барановский А.Ю., Шапиро И.Я. Искусственное питание больных. — СПб., 2000. — 154 с.
2. Боровик Т.Э., Лекманов А.У. Энтеральное питание при неотложных состояниях у детей // Рос. педиатp. журн. — 2000. — № 5. — С. 49-52.
3. Ерпулева Ю.В., Лекманов А.У., Коновалов А.К. Синдром короткой кишки у детей: причины развития и основные подходы к лечению // Анестезиология и реаниматология. — 2006. — № 1. — С. 49-53.
4. Денисов М.Ю. Практическая гастроэнтерология для педиатра: Руководство для врачей. — М., 2001. — 376 с.
5. Карли Ф. Метаболический ответ на острый стресс. Освежающий курс лекций по анестезиологии и реаниматологии. — Архангельск, 1996. — С. 31-33.
6. Курек В.В., Кулагин А.Е., Васильцева А.П., Слинько С.К. Опыт применения зондового питания у детей в условиях интенсивной терапии // Анестезиология и реаниматология. — 2000. — № 1. — С. 24-27.
7. Методическое письмо «Новые технологии питания детей, больных целиакией и лактазной недостаточностью». — М., 2005.
8. Руководство по лечебному питанию детей / Под ред. К.С. Ладодо. — М.: Медицина, 2000. — 384 с.
9. Смит Б., Хикмен Р., Моррей Дж. Питание ребенка в отделении интенсивной терапии // Интенсивная терапия в педиатрии: Пер. с англ. — М.: Медицина, 1995. — Т. 1. — С. 39-68.
10. Соломенцева Т.А. Синдром короткой кишки: тактика врача-гастроэнтеролога // Острые и неотложные состояния в практике врача. — 2009. — № 5. — С. 50-55.
11. Чубарова А.И., Гераськина В.П., Кыштымов М.В. и др. Эффективность применения ферментотерапии и диетотерапии при лактазной недостаточности у новорожденных // Вопросы детской диетологии. — 2003. — Т. 1, № 4. — С. 21-24.
