Журнал «Здоровье ребенка» 5 (26) 2010
Вернуться к номеру
Инновационный подход к лечению и профилактике респираторных инфекций у детей с использованием бактериальных лизатов
Авторы: Недельская С.Н., Запорожский государственный медицинский университет
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье отражены современные тенденции иммунопрофилактики острых респираторных вирусных инфекций у детей. Представлена классификация иммунотропных препаратов бактериального происхождения. Приведена доказательная база эффективности использования иммуномодуляторов бактериального происхождения на основе механического лизиса.
Несмотря на новые знания об этиопатогенезе острых респираторных заболеваний (ОРЗ) и огромное количество лекарственных препаратов в арсенале врача, болезни органов дыхания занимают первое место в структуре заболеваемости как у детей, так и у взрослых и составляют у детей до 14 лет 68–72 %, а до 4 лет — 76–82 %. В развитых странах у 25 % детей в возрасте < 1 года и у 18 % детей в возрасте 1–4 года респираторные инфекции зачастую рецидивируют [6].
Детей, подверженных частым ОРЗ, принято называть часто болеющими детьми (ЧБД). К ним относятся дети, которые подвергаются повторному заражению дыхательных путей чаще 6 раз в год или в эпидемический период (октябрь — май) чаще 1 раза в месяц. При этом частые ОРЗ возникают в силу эпидемиологических причин из-за транзиторных, корригируемых отклонений в защитных системах организма [11]. По разным данным, к группе ЧБД относят до 1/4 всего детского населения.
По данным ВОЗ, в мире ежегодно регистрируется 1,5 млрд случаев ОРЗ, что составляет 1/3 всего населения планеты и 75 % от всей инфекционной патологии. В Украине ОРЗ ежегодно болеют 10–14 миллионов людей, что составляет 25–35 % от общей заболеваемости [1].
Наиболее высокий уровень заболеваемости респираторными инфекциями отмечается у детей дошкольного и младшего школьного возраста, которые посещают организованные коллективы. По российским данным, доля ЧБД колеблется в широком диапазоне и у детей в возрасте от 3 до 6 лет составляет 15–75 %, не имея тенденции к снижению [2].
Неуклонный рост заболеваемости респираторными инфекциями обусловлен многими причинами. Например, отсутствием адекватной массовой иммунопрофилактики и иммунореабилитации, синтезом новых антибактериальных и противовоспалительных средств, которые, как это ни парадоксально, могут обусловить формирование хронизации и рецидивирования инфекционного процесса и резистентности возбудителей. Тем более что иммунная система слизистых, отвечающая за защиту от возбудителей, испытывает все возрастающие негативные влияния (например, экологической обстановки, что особенно актуально в условиях промышленного региона Юга Украины) [9].
В соответствии с критериями ВОЗ классическими факторами риска для частых ОРЗ являются: недостаточное питание (в частности, в развивающихся странах), низкий вес при рождении, искусственное вскармливание, загрязнение воздуха, низкий социально-экономический статус, иммунный дефицит и пропущенные вакцинации [4].
Причинами неадекватного иммунного ответа на возбудитель — патогенный микроорганизм могут стать особенности как микроорганизма (высокая инфицирующая доза, незащищенные входные ворота для инфекционного агента, высокая вирулентность и изменчивость возбудителя), так и макроорганизма (отсутствие слаженности в работе неспецифических факторов защиты, патологическое функционирование специфического иммунитета, нарушенные индивидуальные особенности распознавания специфического микроорганизма иммунными клетками макроорганизма, изменения в работе мукоцилиарного аппарата).
В разные годы в педиатрии, терапии и иммунологии применялись в лечебных целях иммуномодуляторы различных групп. Так, 20–30 лет назад использовались нуклеинат натрия и левамизол, 15 лет назад — естественные модуляторы иммунологического гомеостаза: тактивин, вилозен, тималин, тимоген. В последнее десятилетие широкое клиническое применение нашли цитокины (ИФН-a, ИФН-g, ИЛ-1, ИЛ-6, ФНО-a). Кроме того, в последние годы в различных областях клинической медицины с успехом применяются препараты, обладающие комплексным противовирусным и иммуномодулирующим действием, и синтетические стимуляторы иммунитета. Однако наиболее перспективным методом иммунотерапии и иммунопрофилактики детей и взрослых, особенно часто болеющих или желающих защититься от ОРЗ и гриппа, с нашей точки зрения, следует считать группу иммуномодуляторов микробного происхождения, или бактериальных вакцин [3, 9].
Бактериальные иммуномодуляторы создавались как «вакцины» с целью выработки стойкого протективного иммунитета против бактерий. Возможности вакцинации per os изучаются с 1927 года (A. Besredka). Как класс они были разработаны в 1970-х и внедрены в мир фармакопеи постепенно в течение 1980-х гг.
Большое значение в связи с этим имеет изучение системы местного иммунитета слизистых, особенно синтеза и секреции иммуноглобулина А (IgA). Эффективная защита поверхности верхних дыхательных путей обеспечивается благодаря взаимодействию механизмов врожденного (неспецифического) и приобретенного (специфического) иммунитета. Резистентность слизистых оболочек к микробному заражению путем уменьшения доступности рецепторов эпителия для патогенных факторов за счет блокирования их микробами сапрофитной флоры, антимикробными веществами секретов слизистой оболочки (лизоцим, секреторные антитела, лактоферрин и др.) и мукоцилиарного транспорта обозначают как колонизационный иммунитет [10, 12].
Нижние дыхательные пути (трахея, бронхи, легкие) у здоровых обычно стерильны, что зависит от эффективной работы мукоцилиарного аппарата. Вирусы респираторных инфекций и другие неблагоприятные факторы повреждают слизистую дыхательных путей, что угнетает активность факторов местной защиты. Поврежденный мукоцилиарный аппарат слизистой оболочки не может обеспечить стерильность нижних отделов, вследствие чего микроорганизмы из носоглотки начинают колонизировать нижние дыхательные пути (наиболее часто — H.influenzae, S.pneumoniae, M.catarrhalis, Stph.aureus и др.) и становятся причиной развития острого бронхита, пневмонии или обострения хронического бронхолегочного процесса. Попавшие в нижние дыхательные пути микробы обычно быстро фагоцитируются макрофагами. Макрофаги эффективно фагоцитируют бактерии, агглютинированные антителами и опсонизированные комплементом. Лизис агглютинированных антителами бактерий осуществляется также при активации системы комплемента. Нейтрализация бактерий антителами блокирует их адгезию к слизистой. Связывание с антителами инактивирует бактериальные токсины. При недостаточном иммунном ответе бактерии колонизируют нижние дыхательные пути и могут формировать биопленку, на которую макрофаги не реагируют даже в присутствии антител [7, 14].
Химические компоненты слизи также в значительной степени формируют «первый эшелон иммунитета», и только когда этот наружный барьер становится проницаемым, в слизистой оболочке развиваются воспалительный и иммунный ответы.
Антиген-стимулированные клетки с поверхностным IgA попадают с циркулирующей кровью в лимфоидные органы, например пейеровы бляшки. Развитие специфического иммунного ответа происходит при кооперации Т- и В-лимфоцитов, макрофагов или дендритных клеток. В дальнейшем специфический IgA вновь транспортируется на поверхность слизистых, препятствуя инвазии инфекционных агентов, их адсорбции, фагоцитозу и формированию иммунных комплексов. С другой стороны, активация цитотоксических Т-лимфоцитов приводит к уничтожению инфицированных клеток [10].
Экспериментальные исследования возможности пероральной иммунизации мышей убитыми бактериями Klebsiella pneumonia демонстрировали увеличение в слизистых респираторного тракта клеток, содержащих в цитоплазме специфический IgA, и титра специфических IgA-антител в сыворотке, но уровни специфических IgG и IgM не изменялись. При этом иммунизированные мыши выжили, а неиммунизированные погибли от пневмонии. Иммунизация крыс убитыми Haemophylus influenzae и Pseudomonas aeruginosa показывает аналогичные результаты, клиренс бактерий через респираторный тракт продолжается до 6 месяцев, что способствует индукции протективного иммунитета.
Препараты, содержащие лизаты бактерий, способствуют профилактике инфекций носоглотки и респираторного тракта, не вызывают формирования протективного длительного иммунитета. Их можно разделить на две группы (табл. 1) [8].

На сегодня эти препараты применяются во всем мире для предотвращения и/или лечения бактериальных инфекций верхних и нижних дыхательных путей. Все продукты имеют бактериальное происхождение. Препараты первого поколения — это бактериальные лизаты (например, целые бактерии); более поздние продукты разработаны на основе бактериальных экстрактов (отобраны те компоненты бактерий, которые имеют наибольшую иммуногенность), например мембранные протеогликаны (биостим) или рибосомы (рибомунил). Бактериальные иммуностимуляторы не лечат острые инфекции. Скорее, они обеспечивают иммунную защиту, благодаря которой уменьшаются частота и тяжесть таких инфекций и, как следствие, снижаются необходимость использования антибиотиков и, соответственно, риск развития резистентности. Назначение бактериальных иммуностимуляторов широко распространено во многих странах мира: на сегодня во всем мире более 8 млн пациентов ежегодно уже получают лечение и около 150 млн пациентов были пролечены этими препаратами с момента их коммерциализации. Однако клиническая практика в некоторых странах показывает, что иммунопрофилактика не так хорошо воспринимается, как должна была, учитывая все еще высокие уровни резистентности к антибиотикам и выраженность социально-экономической проблемы вследствие рецидивирующих респираторных инфекций (J. Bousquet).
Бронхомунал стимулирует секрецию простагландина Е2 и интерлейкина-1 (ИЛ-1) альвеолярными макрофагами, повышает активность макрофагов против инфекционных агентов и клеток опухоли, усиливает секрецию фактора некроза опухоли и ИЛ-2 [6], активирует естественные киллеры, усиливает синтез IgA, ИЛ-8, ФНО-a, нейтрофил-активирующего фактора [8].
Рибомунил стимулирует выработку специфических антител IgM, IgG и секреторного IgA, повышает количество клеток CD3+, CD4+ при изначально сниженных показателях, активирует Т-клетки и макрофаги. При назначении рибомунила в виде спрея в основном наблюдаются влияние на систему местного иммунитета и выработка IgА [5, 8].
Недавно специалистами компании Lallemand Pharma Int. (Швейцария), ключевым направлением деятельности которой является создание иммунобиологических препаратов, на основе инновационной технологии производства поливалентного механического бактериального лизата (polyvalent mechanical bacterial lysate — PMBL) был разработан иммуномодулятор Респиброн. На украинском рынке данный препарат представляет компания «Мили Хелскере Лтд.».
Иммуномодулятор Респиброн содержит бактериальный лизат 13 штаммов наиболее распространенных патогенных микроорганизмов, вызывающих заболевания верхних дыхательных путей: 6 штаммов Diplococcus pneumoniae, Haemophilus influenzae, Klebsiella pneumoniae, Klebsiella ozaenae, Streptococcus pyogenes, Streptococcus viridians, Staphylococcus aureus, Neisseria catarrhalis.
Технология производста Респиброна уникальна. В отличие от широко распространенного метода химического лизиса бактерии разрушаются механически, ультразвуковым дроблением. Это позволяет отделить от них крупные фрагменты клеточных оболочек без их существенных изменений (например, структурных компонентов белковой природы), а также отделить от них балластные (антиген-неактивные) и токсичные части микробной клетки. Соответственно, данный антигенный материал лучше распознается иммунной системой человека и, следовательно, формирует именно специфический иммунный ответ, а отсутствие токсичных компонентов позволяет избежать общей негативной реакции организма [13].
Имеются теоретические работы, которые показывают, что первичный специфический иммунный ответ фиксируется на 5–6-й день с момента контакта с антигеном, тогда как вторичный иммунный ответ при наличии клеток памяти развивается в течение нескольких часов. В настоящее время показано, что достаточная выработка и накопление антигенспецифического sIgA возникает только при сублингвальном применении, при парентеральном введении такой эффект отсутствует.
Сублингвальное (подъязычное) применение Респиброна позволяет не только избежать воздействия и разрушения препарата пищеварительными соками — прямой контакт с иммунными клетками слизистых оболочек позволяет быстро сформировать специфический иммунный ответ при повторном попадании на слизистую оболочку возбудителей респираторных заболеваний. Это позволяет сократить количество возникновений инфекций дыхательных путей как в период проведения 3-месячного профилактического курса, так и в последующие как минимум 5 мес. Поэтому пациентам с проблемами со стороны дыхательных путей рекомендовано проведение профилактических курсов 2 раза в год.
Удобство применения (всего 1 таблетка в сутки) и непродолжительный курс (10 дней) способствуют высокой комплайентности пациентов: нет необходимости постоянно носить препарат с собой, следить за временем приема Респиброна. К тому же упаковка содержит 10 таблеток — этого количества достаточно на курс лечения.
Респиброн имеет двойной механизм действия: активирует неспецифическую резистентность за счет мембранных антигенов, входящих в состав препарата, путем активации дендритных клеток, нейтрофилов, макрофагов, NK-клеток, индукции фагоцитоза; активирует специфический иммунитет путем повышения уровня продукции ИЛ-2, специфических сывороточных Ig классов A, G, M и sIgA, активации эффекторных CD4 и CD8, активации В-лимфоцитов.
Доказательная база по эффективности бактериальных лизатов, полученных путем механического лизиса (PMBL), довольна велика. Первые рандомизированные исследования в педиатрии датируются 1993 годом. J.P. Collet, T. Ducruet и соавт. включили 400 детей в двойное плацебо-контролируемое рандомизированное исследование с целью оценить влияние неспецифического иммуностимулятора на частоту ОРЗ. Пациенты, которые получали PMBL, имели низкий относительный риск (RR = 0,52) заболеть тремя и более эпизодами ОРЗ.
F. Braido, F. Tarantini (2007) проанализировали пилотные исследования эффективности Респиброна у часто болеющих детей, которые показали достоверное снижение частоты эпизодов ОРЗ, тяжести каждого из них. Эффект сохранялся до 6 месяцев после окончания курса лечения.
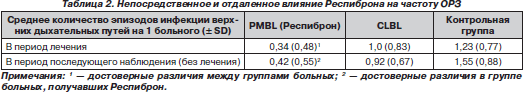
A. Macchi, L.D. Vecchia (2005) проведено рандомизированное сравнительное исследование эффективности бактериальных лизатов: сублингвального, поливалентного, бактериального, полученного путем механического лизиса (Респиброн), и орального иммуностимулирующего бактериального лизата, полученного химическим лизисом (CLBL). Результаты представлены в табл. 2.
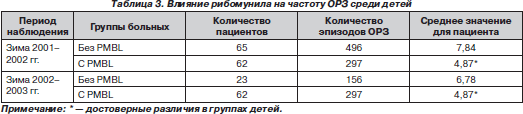
F. Rosaschino, L. Cattaneo (2004) показали, что количество эпизодов ОРЗ достоверно уменьшается как в сезон применения PMBL, так и через год после курса (табл. 3). Эффект сопровождался повышением уровней В-лимфоцитов в сыворотке крови.
Другое плацебо-контролируемое исследование 188 детей показало, что уровень заболеваемости снизился на 50 % через год после лечения Респиброном. Также продемонстрирована высокая безопасность препарата (S.B. Ruah, C. Ruah, 2001). По результатам исследований M.D. Gutiérrez-Tarango (2001), Респиброн снижает не только риск и частоту возникновения ОРЗ, но и длительность каждого эпизода в случае заболевания, а также длительность антибактериальной терапии и количество ее курсов (если она необходима). Влияние Респиброна на необходимость антибактериальной терапии (АБ-терапии) представлено в табл. 4.

Респиброн также эффективен в комплексном лечении ОРЗ, требующих назначения антибактериальных препаратов (M. Bartocci, A. Allegri, 1997). Проводилось наблюдение за 48 детьми с рецидивирующими инфекциями верхних дыхательных путей в возрасте 6–11 лет, которые были распределены на 4 группы (табл. 5).

Результаты исследования показали, что у детей, которые получали Респиброн сублингвально в комбинации с АБ-терапией, реже отмечались рецидивы респираторной инфекции, а также быстрее исчезали признаки воспаления.
На рынке Украины Респиброн появился недавно, поэтому широкомасштабных отечественных исследований его эффективности еще не проводилось. На базе 5-й городской детской больницы г. Запорожья наблюдались 42 ребенка с диагнозом острого ринофарингита, ларинготрахеита. Средний возраст — 6,40 ± 0,93 года. В комплексную терапию 26 пациентов был добавлен Респиброн (по 1 таблетке в сутки сублингвально на протяжении 10 дней). Проводилась клиническая оценка эффективности лечения на основании скорости снижения интоксикационного синдрома, катаральных явлений. В группе детей, получавших Респиброн, интоксикационный синдром регрессировал через 1,20 ± 0,12 дня по сравнению с 3,70 ± 0,25 дня среди пациентов, получавших стандартную терапию (р < 0,05). Динамика катаральных явлений также была достоверно более значительной в основной группе больных. Частота рецидивирования ОРЗ в первой группе пациентов составила 4,25 ± 1,07 эпизода за год, в группе сравнения — 7,26 ± 2,16 (р < 0,05). Полученные нами данные позволяют рекомендовать включение Респиброна в комплекс терапевтических мероприятий при респираторных инфекциях.
Выводы
1. Респиброн — единственный препарат на рынке иммунотропных медикаментов, полученный путем механического лизиса, который позволяет наиболее безопасно и эффективно индуцировать образование специфических антител.
2. Сублингвальный путь введения Респиброна позволяет обеспечить прямой контакт антигена с иммунными клетками слизистой оболочки и сформировать местный иммунитет.
3. Широкий опыт применения Респиброна позволяет определить его как препарат, обеспечивающий профилактику развития острых инфекций верхних и нижних дыхательных путей (в том числе профилактика суперинфекций при ОРВИ и гриппе); эффективность комплексного лечения острых инфекций дыхательных путей (в том числе в сочетании с АБ-терапией).
1. Абатуров О.Є., Височина І.Л. Імунопрофілактика гострих респіраторних вірусних інфекцій на сучасному етапі // Новости медицины и фармации. — 2009. — 17(291).
2. Гаращенко Т.И., Ершов Ф.И. Возможен ли контроль острых респираторных заболеваний у детей? (Новый взгляд на старую проблему) // Актуальные вопросы оториноларингологии детского возраста и фармакотерапия болезней ЛОР-органов // Юбилейный сборник научных трудов. — М., 2001.
3. Горностаева Ю.А. Иммунотропная терапия хронических инфекционно-воспалительных процессов в бронхолегочной системе в амбулаторной практике // Справочник поликлинического врача. — 2007. — 12. — С. 7-11.
4. Заплатников А.Л. Иммунопрофилактика и иммунотерапия острых респираторных инфекций у детей // Лечащий врач. — 2006. — № 9. — С. 50-56.
5. Коровина Н.А., Заплатникова Л.В. Современные возможности профилактики и лечения рекуррентных инфекций органов дыхания у детей // Педиатрия. — 2009. — № 3.
6. Локшина Э.Э., Зайцева О.В. Новые подходы в терапии рецидивирующих респираторных инфекций у детей // Сonsilium medicum. Приложение «Педиатрия». — 2009. — № 4. — С. 20-24.
7. Лупан И.Н., Самарин О.И., Татуревич А.Ю. Инновационный подход к иммунотерапии часто болеющих детей // Вопросы современной педиатрии. — 2009. — Т. 8, № 3. — С. 28-31.
8. Маркова Т.П. Бактериальные иммуномодуляторы // Русский медицинский журнал. — 2009. — № 3. — С. 24-27.
9. Намазова Л.С., Вознесенская Н.И. Имунотерапия пациентов с респираторной аллергией // Consilium Medicum. — 2002. — Т. 4, № 9. — С. 28-33.
10. Рязанцев С.В., Хмельницкая Н.М. Роль слизистой оболочки в защите ЛОР-органов от потенциально патогенных для организма антигенных факторов // Вестник оториноларингологии. — 2000. — № 3. — С. 60-64.
11. Самсыгина Г.А., Коваль Г.С. Часто болеющие дети: проблемы диагностики, патогенеза и терапии // Лечащий врач. — 2009. — № 1. — С. 43-48.
12. Шамшева О.В., Учайкин В.Ф. Лечение и профилактика рецидивирующих инфекций респираторного тракта у детей // Детские инфекции. — 2008. — Т. 7, № 3. — С. 49-52.
13. Эффективная профилактика и лечение вирусных и бактериальных заболеваний дыхательных путей: реалии и перспективы (Дискуссионный круглый стол «Мировой опыт профилактики и лечения вирусных и бактериальных респираторных инфекций в современных условиях глобализации и открытых границ») // Новости медицины и фармации. — 2009. — № 16(290).
14. Bousquet J., Fiocchi A. Профилактика рецидивирующих респираторных инфекций у детей с использованием рибосомального иммунотерапевтического препарата (клинический обзор) // Современная педиатрия. — 2009. — № 2(24). — С. 50‑57.
15. Braido F., Tarantini F., Ghiglione V. Bacterial lysate in the prevention of acute exacerbation of COPD and in respiratory recurrent infections // International Journal of COPD. — 2007. — № 2(3). — Р. 335-345.
16. Collet J.P., Ducruet T., Kramer M.S., Haggerty J. Stimulation of nonspecific immunity to reduce the risk of recurrent infections in children attending day-care centers. The Epicrèche Research Group // Pediatr. Infect. Dis. J. — 1993 Aug. — 12(8). — 648-52.
17. Gutiérrez-Tarango M.D., Berber A. Safety and efficacy of two courses of OM-85 BV in the prevention of respiratory tract infections in children during 12 months // Chest. — 2001. — Vol. 119(6). — P. 1742-1748.
18. Macchi A., Vecchia L.D. Open comparative, randomized controlled clinical study of a new immunostimulating bacterial lysate in the prophylaxis of upper respiratory tract infections // Arzneimittelforschung. — 2005. — Vol. 55(5). — P. 276-281.
19. Rosaschino F., Cattaneo L. Strategies for optimizing compliance of paediatric patients for seasonal antibacterial vaccination with sublingually administered Polyvalent Mechanical Bacterial Lysates (PMBL) // Аcta bio medica ateneo parmense. — 2004. — Vol. 75. — P. 171-178.
20. Ruah S.B., Ruah C., van Aubel A., Abel S., Elsasser U. Efficacy of a polyvalent bacterial lysate in children with recurrent respiratory tract infections // Adv. Ther. — 2001. — Vol. 18(4). — P. 151-162.
21. Bartocci M., Allegri A., Tegaido L. Lyophilised polybacterial lysate in the prevention of respiratory infections. G. Gaslini Paediatric Clinic of the University of Genoa (Abstract presented at the Current Paediatric Convention. Loano 11–13th April, 1997).
