Журнал «Здоровье ребенка» 5 (26) 2010
Вернуться к номеру
Кристаллические артропатии в практике врача-педиатра
Авторы: Омельченко Л.И., Ошлянская Е.А., Петренко Л.Б., Людвик Т.А., ГУ «ИПАГ АМН Украины», г. Киев
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье представлен краткий обзор патогенетических механизмов развития, особенностей дифференциальной диагностики кристаллических артропатий и возможностей коррекции метаболических нарушений. Описан случай псевдоподагры у ребенка младшего школьного возраста.
Дети, артропатии, нарушения обмена.
Кристаллические артропатии у детей выявляют исключительно редко в связи с меньшей выраженностью метаболических нарушений и наличием только начальных проявлений вторичных изменений опорно-двигательного аппарата. Чаще всего они проявляются болями в суставах так называемого механического характера. При таком характере болевого синдрома артралгии отсутствуют в покое, появляются только при относительно длительной ходьбе (или стоянии) и стихают во время отдыха, типичны боли в переднем отделе коленного сустава при ходьбе по лестнице, пересеченной местности, вставании с низкого сидения. Изменение ритма болей на воспалительный свидетельствует о присоединении синовиита или периартрита [1].
Согласно МКБ 10-го пересмотра, кристаллические артропатии относятся к группе воспалительных артропатий неинфекционного генеза и включают подагру (М 10) и другие кристаллические артропатии (М 11):
— отложения гидроксиапатита (М 11.0);
— наследственный хондрокальциноз (М 11.1);
— другие хондрокальцинозы (М 11.2);
— кристаллическая артропатия неуточненная (М 11.9).
Их распостраненность у взрослых составляет: подагры — 1–28 на 1000; различна для разных регионов и пола, для других кристаллических артропатий точно неизвестна [2].
Механизм развития патологического процесса, приводящего к возникновению поражений опорно-двигательного аппарата, при кристаллических артропатиях сложный.
Если при подагре образование кристаллов уратов происходит в синовиальной жидкости или во внесуставных тканях (формирование тофусов) на фоне общего повышения уровня мочевой кислоты в тканевой жидкости, то при псевдоподагре и других кристаллических артропатиях первичной зоной кристаллообразования является толща гиалинового или волокнистого хряща или периартикулярные структуры при нормальном уровне кальция в других тканях организма [3, 4].
Типичными морфологическими признаками, предшествующими патологической минерализации, являются гипертрофия хондроцитов и их усиленный апоптоз. В гипертрофированных хондроцитах синтезируются измененные протеогликаны и укороченные цепи коллагена, изменяется продукция матриксной металлопротеиназы-13, щелочной фосфатазы, трансглютаминазы, что способствует развитию вторичных деструктивных изменений и воспалительной реакции. Определенную роль в патогенезе играют и генетические факторы [5].
У взрослых причиной отложения солей в суставообразующих тканях чаще всего является нарушение пуринового обмена, проявляющееся повышением содержания в крови и тканях мочевой кислоты, — подагра. Диагноз подагры практически не устанавливается в детском возрасте.
В то же время, по данным клинического регистра отделения болезней соединительной ткани у детей ГУ «ИПАГ АМНУ», наличие гиперурикемии отмечается в 4,9 % случаев при обследовании детей с жалобами на артралгии даже без признаков воспалительных изменений в суставах. Причины выявленных урикемий могут быть вторичными, обусловленными эндокринопатиями, аутоиммунными заболеваниями, приемом некоторых лекарственных средств, но могут являться и начальными подагрическими нарушениями, которые клинически манифестируют только через десятилетия [1, 2].
К мысли о нарушении минерального обмена у пациента с жалобами на боли в суставах педиатра может привести обнаружение отложений извести в тканях, чаще всего выявляемое при проведении рентгенологического исследования.
Основная причина местного обызвествления — изменения тканей, способствующие поглощению солей кальция из крови и тканевой жидкости вследствие ощелачивания среды и усиления активности тканевых ферментов. Отложения извести в тканях могут возникать и вследствие неметаболических причин — в туберкулезных очагах некроза; гуммах; при инфарктах на месте погибших клеток; в очагах хронического воспаления. Эти причины подлежат первоочередному исключению при выявлении у пациентов локальных отложений солей кальция [6–8].
Участки обызвествления в тканях типичны как для подагры, так и для псевдоподагры. Сегодня известны две разновидности последней, имеющие в своей основе различный метаболический дефект [9].
Первой разновидностью псевдоподагры является пирофосфатная артропатия (хондрокальциноз), которая в детском возрасте практически не встречается, протекает в виде приступов острого артрита, возникающего вследствие субхондрального отложения пирофосфатов кальция (Са2(Р2О7)2Н2О). Такие отложения могут быть во многих суставах, но клиническое значение имеет в основном поражение коленных суставов. Педиатрам, однако, необходимо помнить и о других возможных причинах отложения солей пирофосфата кальция, например, наблюдаемых при гемохроматозе.
Пирофосфатная артропатия протекает в форме псевдоостеоартроза, псевдоревматоидной формы, псевдоподагрического варианта, псевдонейропатической артропатии, асимптомного хондрокальциноза, что обусловливает спектр дифференциального поиска.
Часто при этом заболевании выявляют изменения скелетных мышц, сухожилий, связок, синовиальных сумок в местах их прикрепления к костям, в основном с медиальной стороны коленного сустава. Боли в этих случаях бывают весьма сильными, приводя к хромоте, нередко сохраняются в покое. В диагностике основное значение имеют пальпация и проведение тестов с изолированным напряжением мышц. Диагноз можно подтвердить ультразвуковым исследованием тканей и выявлением кристаллов пирофосфатов в синовиальной жидкости.
Причиной иррадиирующей боли в коленном суставе при хондрокальцинозе могут быть изменения тазобедренного сустава. Поэтому при «необъяснимых» болях в коленном суставе рекомендуется рентгенологическое исследование всей бедренной кости и тазобедренного сустава.
К рентгенологическим особенностям пирофосфатной артропатии относят значительное сужение суставной щели в сочетании с остеосклерозом, особенно при выявлении изолированного поражения бедренно-надколенникового сочленения или латерального бедренно-большеберцового сочленения, наличие внутрисуставных телец различной степени плотности, выраженное уплощение медиальной или латеральной поверхности мыщелка большеберцовой кости [6]. Патогномоничными признаками пирофосфатной артропатии является хондрокальциноз (обызвествление менисков и суставного хряща). Пирофосфатная артропатия с поражением коленного сустава может и не сопровождаться четким кальцинозом менисков или суставного хряща. В этих случаях диагноз устанавливается при обнаружении кристаллов пирофосфата кальция в синовиальной жидкости.
Вторым типом псевдоподагры является болезнь отложения основных фосфатов кальция, при которой кристаллы гидроксиапатита кальция откладываются в большей степени в сухожилиях и подкожно [10].
По данным рентгенологического исследования диагноз гидроксиапатитной артропатии устанавливается в случаях:
— множественной кальцификации периартикулярных структур (при исключении системной склеродермии, дерматомиозита, смешанного заболевания соединительной ткани, которые также могут сопровождаться образованием кальцинатов);
— рецидивирующих атак острого периартрита, особенно при выявлении в сухожилии кальцината, уменьшающегося или исчезающего после атаки;
— исключения септического артрита, нейроартропатии Шарко, ревматоидного артрита.
Гидроксиапатит, откладывающийся в околосуставных тканях при псевдоподагре второго типа, представляет собой минеральное соединение, имеющее формулу Са10(РО4)6ОН. Его кристаллы образуются в изначально поврежденной ткани, чем объясняется то, что кальцификации подвергаются прежде всего часто травмирующиеся и плохо васкуляризированные участки сухожилий. Поэтому участок сухожилия надостной мышцы вблизи прикрепления его к большому бугорку плечевой кости является излюбленной локализацией [6]. В свою очередь, кальцификация способствует дальнейшему прогрессированию дегенеративных изменений и развитию вторичной воспалительной реакции вследствие повышенной секреции цитокинов и протеолитических ферментов фагоцитами после поглощения ими кристаллов. Способствуют генерализации процесса кальцинатоотложения общие предрасполагающие факторы: сахарный диабет, заболевания щитовидной железы, гиперфосфатазия. Описаны семейные случаи заболевания, хотя каких-либо ассоциаций с HLA-антигенами не выявлено [7, 8].
Депозиты основных фосфатов кальция могут быть лишь случайной рентгенологической находкой у людей без каких-либо жалоб, хотя чаще отмечается боль при движении и болезненность при пальпации пораженного сустава.
Течение болезни отложения основных фосфатов кальция, так же как и хондрокальциноза, может быть различным.
Манифестной формой артропатии является острый кальцифицирующий периартрит. Его развитие может быть спровоцировано травматизацией сухожилия, физической нагрузкой или каким-либо соматическим заболеванием. В результате повреждения места отложения кристаллов происходит их выход из кальцината в толщу сухожилия и окружающие ткани с развитием бурной воспалительной реакции. Острый периартрит сопровождается сильным болевым синдромом. Иногда из периартикулярных структур выделяется или аспирируется белесое кремообразное мелоподобное содержимое. Клиническая картина сходна с приступом подагры тем более что одной из локализаций патологического процесса может быть первый плюснефаланговый сустав. В отличие от истинного приступа подагры, такая локализация кальцифицирующего периартрита чаще отмечается у молодых женщин, а не мужчин. Острый периартрит длится обычно в течение 2–3 недель, разрешается в результате противовоспалительного лечения или самопроизвольно.
Рецидивирование приступов и вовлечение разных суставов способствует развитию хронической боли. После приступа рентгенологически выявляемый кальцинат может уменьшиться в размерах и даже полностью исчезнуть.
Когда кристаллы из периартикулярных тканей проникают непосредственно в полость сустава, развивается синовиит, чаще всего в виде хронического моно- или полиартрита. Преимущественная локализация этой артропатии — суставы пальцев. Обычно у таких пациентов наряду с дегенеративно-деструктивными изменениями в суставах наблюдаются кальцинаты в околосуставных тканях. Кристаллы способствуют повреждению хряща и кости путем механического воздействия и стимулируя высвобождение из синовиальной оболочки медиаторов воспаления.
Несмотря на частое обнаружение кальцинатов в околосуставных тканях, диагноз артропатии, обусловленной отложением основных фосфатов кальция, устанавливается крайне редко. Причиной является отсутствие диагностических критериев этого заболевания, а также четких представлений о причинно-следственной связи между хроническим воспалением, дегенеративными процессами в суставных структурах и их кальцификацией. Из-за чрезвычайно малых размеров кристаллы основных фосфатов кальция не визуализируются при световой микроскопии во время исследования синовиальной жидкости. Эта методика позволяет видеть только очень крупные агрегаты кристаллов, которые выглядят как солнечный диск. Существуют методы, позволяющие выявлять соединения кальция (окрашивание ализарином красным), однако они неспецифичны в отношении основных фосфатов и могут давать реакцию также с пирофосфатом кальция, карбонатом кальция, нередко присутствующими в синовиальной жидкости одновременно с апатитом.
Рентгенологическими особенностями, позволяющими отличить болезнь отложения основных фосфатов кальция от пирофосфатной артропатии, является нехарактерность хондрокальциноза, преобладание изменений в латеральном отделе при поражении коленного сустава, отсутствие остеофитов, более частая локализация в мелких суставах и периартикулярных тканях.
Основные дифференциальные признаки кальцифицирующих кристаллических артропатий приведены в табл. 1.
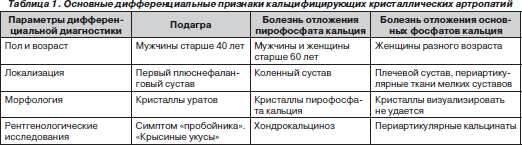
С отложением основных фосфатов кальция, кроме вышеописанных идиопатических поражений, связаны и другие состояния — артропатия при хроническом гемодиализе, подкожные депозиты при склеродермии, кальциноз при опухолях, отложение кальция в местах инъекций глюкокортикоидов и идиопатический универсальный кальциноз.
Приводим описание случая кристаллической артропатии у ребенка, наблюдавшегося в нашей клинике.
Ребенок М., девочка, акушерский анамнез у матери отягощен токсикозом 1-й и 2-й половины беременности, ранний анамнез отягощен: низкий вес при рождении (2050 г.), с 3 мес. имелись проявления мальабсорбции. Ребенок из группы наблюдения часто болеющих детей, с 3 лет жаловалась на боли в суставах, периодическое образование воспалительных изменений на коже. В 8 лет впервые обнаружено новообразование на V пальце правой стопы и IV пальце левой кисти, по месту жительства произведено рентгенологическое исследование и выявлено рентгенконтрастное образование костной плотности, на снимке стопы связанное с костью, заподозрена остеоид-остеома. Во время пребывания в клинике образовался свищ. С целью уточнения диагноза проведено оперативное вмешательство в обеих локализациях поражения — фистулонекрэктомия с исследованием биоптата в референтных лабораториях НИИ онкологии и НИИ ортопедии и травматологии Украины.
Патоморфологическое заключение было неоднозначным: изменения в гистологических препаратах пальцев руки и ноги однотипны. Материал представлен фрагментами патологически измененной кожи и подкожной основы. Эпидермис сохраняет витальность, но отмечается локальный акантоз, в дерме, преимущественно в сосочковом слое, выявлены участки склерозированной фиброзной ткани с небольшими периваскулярными мононуклеарными инфильтратами. В дерме и подкожной основе располагаются нечетко очерченные оссификаты, состоящие из полиморфных островков неравномерно обызвествленной ретикулофиброзной костной ткани. В костномозговых полостях содержится незрелая фиброзная и грануляционная ткань в состоянии гранулоцитарно-моноцитарной инфильтрации, кое-где мелкие скопления нейтрофилов и элементы нагноения. Убедительных данных о наличии опухоли не получено. По результатам гистологического исследования нельзя исключить наличие остеомиелита фаланг или остеоартрита межфаланговых суставов. Предложено хирургическое удаление фаланг, назначение антибиотикотерапии. От повторного оперативного вмешательства мать отказалась. Через 8 месяцев в связи с рецидивом заболевания ребенок повторно был обследован в ОДКБ, в ревматологическом отделении. Изменения расценивались как параартикулярный кальциноз. При обследовании выявлено значительное повышение уровня щелочной фосфатазы в крови девочки (1815 ед/л), и она была направлена на консультацию в ГУ «ИПАГ АМНУ» для исключения диффузных заболеваний соединительной ткани.
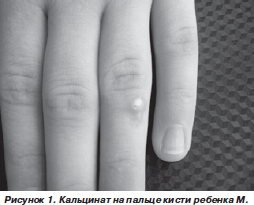
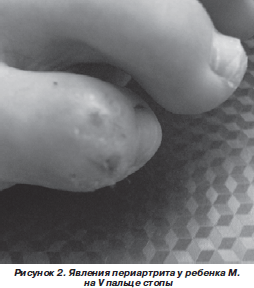
При первом поступлении в нашу клинику девочка предъявляла жалобы на артралгии, чаще после нагрузки, беспокойство, изменения в области пальцев рук и ног, периодические боли в животе, частые ОРВИ. При осмотре отмечено удовлетворительное общее состояние, выраженная расторможенность ребенка, признаки гипермобильности суставов, большое количество стигм дизэмбриогенеза. Отмечалась бледность кожных покровов, умеренный периорбитальный цианоз. На V пальце правой стопы имелись отечность, гиперемия, свищ с отделением крошковидной белой массы. На IV пальце левой кисти пальпировалось уплотнение и был выражен рубец после оперативного вмешательства (рис. 1, 2). На левом предплечье и спине в области поясницы справа пальпировались подвижные округлые подкожные образования без изменений кожи над ними. Видимые слизистые чистые. Миндалины гипертрофированы до 2-й степени, рыхлые, не гиперемированы, налетов нет, в лакунах — слизь. Носовое дыхание затруднено. Суставы без признаков острых синовиитов, гипермобильность по шкале Бейтона — 8 баллов. Лимфоузлы по типу микрополиадении. Перкуторных и аускультативных изменений в легких не выявлено. Границы относительной и абсолютной сердечной тупости в пределах возрастной нормы. При аускультации сердечные тоны не ослаблены, ритм сердца правильный, отмечен короткий систолический шум функционального характера, не связанный с тонами. При пальпации живота отмечалась болезненность в эпигастральной области. Стул неустойчивый. Мочеиспускание с эпизодами дополнительных неудерживаемых порций между актами мочеиспускания.
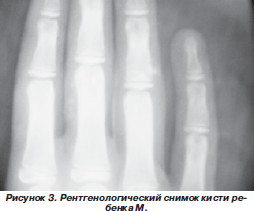
В клинике девочке проведено рентгенологическое исследование кистей рук и предплечий, стоп для уточнения локализации кальцинатов. По его описанию определялись участки обызвествлений, располагающиеся в подкожной клетчатке на уровне средней трети диафиза локтевой кости и кнаружи от средней фаланги мизинца правой стопы, что требовало продолжения обследования для уточнения причин системного кальциноза (рис. 3, 4).
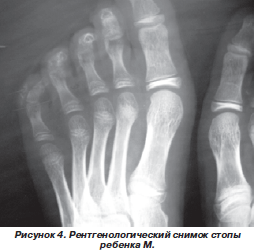
Костных деструкций, изменений со стороны суставообразующих костей возле очагов поражения не выявлено. Проведенная электромиография, определение креатинфосфокиназы, антигистидазных антител и антител к скелетной мускулатуре позволили исключить хронически текущий дерматомиозит. С целью исключения склеродермии и смешанного заболевания соединительной ткани у ребенка исследовались анти-scl-70-антитела и антитела к рибонуклеопротеиду (результаты были негативны). Проводились также рентгенологическое исследование желудка с бариевой взвесью, спирография, рентгенография органов грудной клетки, специфических для болезней соединительной ткани изменений выявлено не было. Приводим результаты иммунологических исследований: содержание иммуноглобулина G в крови — 11,3 г/л, иммуноглобулина А — 1,28 г/л, иммуноглобулина М — 0,67 г/л, антинуклеарные антитела не выявлены, антифосфатидилсериновые, антикардиолипиновые, антифосфатидилэтаноламиновые антитела выявлены в титрах ниже диагностически значимых, выявлены также положительные антитела к ДНК — к денатурированной — 1,7 ед/л, к нативной — 1,4 ед/л. Абсолютные и относительные количества основных субпопуляций лимфоцитов по данным проточной цитофлуориметрии были в пределах возрастных значений.
В общем анализе крови, биохимических исследованиях крови отклонений от нормальных значений не было. Кальций в крови составлял 2,2 ммоль/л, фосфор — 1,7 ммоль/л. Суточная кальциурия — 237,5 мг, фосфатурия — 737,5 мг при диурезе 1250 мл. В общих анализах мочи и анализах мочи по Нечипоренко выявлена незначительная протеинурия, лейкоцитурия. В суточной моче белок — 30 мг/дл, эр. — 50 в мл, лейкоциты — 75 в мл. Концентрационная функция почек по анализу мочи по Зимницкому сохранена. При осмотре гинекологом выявлены признаки вульвита. В мазках выделений — кокковая флора и мицелий дрожжевых грибков, значительное количество плоского эпителия.
При проведении УЗИ органов брюшной полости и забрюшинного пространства обнаружены S-образная деформация желчного пузыря, умеренное уплотнение внутрипеченочных желчных протоков при нормальных размерах печени, увеличение в размерах и повышение эхогенности всех отделов поджелудочной железы, уплотнение чашечно-лоханочной системы правой почки.
По данным электрокардиографии — нарушение проводимости по правой ножке пучка Гиса, умеренные обменные изменения в миокарде.
В мазках из зева выделен золотистый стафилококк, в мазках раневого отделяемого — золотистый стафилококк и фекальный стрептококк.
Результаты серологических исследований, проведенные с целью определения антител к трихинеллам, цистицеркам, токсоплазмам, также были негативны. При рентгенографии черепа внутричерепных кальцинатов не выявлено. При электроэнцефалографическом исследовании — общемозговые изменения в виде дизритмии и ирритации альфа-ритма в затылочных отведениях, зональные различия ритмов сохранены. Очаг ирритации в теменно-височных отделах слева. На пробу открывания глаз реакция нормальная, на гипервентиляцию отмечается вовлечение медиобазальных отделов мозга с признаками генерализации. Реоэнцефалограмма изменений не выявила.
Девочка была консультирована окулистом, оториноларингологом, неврологом, психиатром, ортопедом, генетиком, фтизиатром. При консультации в НИИ фтизиатрии проводилось повторное гистологическое консультирование биоптатов и бактериологическое исследование отделяемого из свища, специфических изменений, характерных для туберкулеза, не выявлено.
Вышеперечисленные результаты обследования позволили исключить инфекционную и иммунопатологическую причины кальциноза. Дальнейшее обследование проводилось с целью уточнения характера обменных нарушений, приводящих к развитию кальциноза.
Результаты определения уровней кальций-регулирующих гормонов в крови свидетельствовали об их нормальном содержании: паратгормон — 26,6 пг/мл (референтные значения 12–65 пг/мл), кальцитонин — 1,72 пг/мл (0,07–12,97 пг/мл). Консультация эндокринолога и отсутствие задержки психического развития позволили исключить и псевдогиперпаратиреоз как причину кальциноза.
С учетом наличия стойких артралгий, минимального мочевого и дизурического синдрома проведены исследования транспорта солей. Выявлена гиперурикемия — 464 мкмоль/л при отсутствии урикурии (2,27 мкмоль/л), содержание оксалатов в крови и моче оставалось в пределах нормальных значений.
На основании полученных данных девочке установлен диагноз: периартрикулярный кальциноз неуточненного генеза. Дисметаболическая урикурическая нефропатия. Хронический компенсированный тонзиллит. НДСТ (искривление носовой перегородки, гипермобильный синдром, гиперэластоз). Хронический гастродуоденит, дуоденогастральный рефлюкс. Дискинезии желчевыводящих путей. Гиперкинетическое расстройство поведения.
Ребенок был выписан с рекомендациями соблюдения диеты с ограничением содержания пуриновых оснований, приема магний- и алюминий-содержащих препаратов, канефрона, солевых гипоуратных средств (уридан, уралит), омега-3-полиненасыщенных жирных кислот, местного применения диметилсульфоксида и ксидифона и лечения сопутствующей хронической соматической патологии, в случае возникновения необходимости повторной хирургической санации проведение биохимического исследования отделяемого из раны.
На фоне лечения у ребенка отмечалась частичная положительная динамика в виде отсутствия появления новых кальцинатов, уменьшения образований в местах отсутствия хирургических вмешательств. Однако на пальце стопы, где отмечалось постоянное травмирование, через 10 месяцев появились признаки воспаления. После хирургической обработки проведено биохимическое исследование, которое выявило наличие фосфатов кальция.
Через 1 год ребенок планово повторно госпитализирован. При обследовании выявлена нормализация показателей транспорта солей, содержания анти-ДНК-антител. Ребенок консультирован нефрологом, урологом, генетиком. С учетом манифестации болезни у лица женского пола в молодом возрасте, наличия диффузного кальциноза с преимущественным поражением сухожилий мелких суставов, рецидивирующего периартрита с положительной динамикой кальциноза после его разрешения, биохимического выявления в очаге воспаления фосфатов (а не уратов) кальция был поставлен уточненный диагноз: болезнь нарушения обмена основных фосфатов кальция (псевдоподагра с отложениями гидроксиапатита).
Рекомендовано наблюдение нефролога, ревматолога, генетика. Элиминационная диета. Ограничение травматизации. Исключение приема сульфаниламидных препаратов и аспирина, повторные курсы антацидов и солей магния, хондропротекторов, витаминов группы В, курсы комплексонотерапии и ксидифона. Сегодня в мире для лечения этой патологии и ингибиции кальциноза у взрослых применяются бифосфонаты, которые являются синтетическими аналогами пирофосфатов кальция, и аналоги кальцитонина (элькатонин) [11].
Особенностью случая является раннее возникновение заболевания, связанного с нарушением обмена кальция, у девочки младшего школьного возраста. Описанный случай свидетельствует о необходимости помнить о возможности развития в детском возрасте патологий, более характерных для взрослых.
1. Мерта Дж. Артралгии и артриты. — М.: Практика, 1999. — Т. 1, № 5.
2. Шостак Н., Логинова Т., Хоменко В., Рябкова А. Подагра: патогенез, клиника, лечение // Врач. — 2004. — № 4. — С. 42-44.
3. Беленький А.Г. Болезнь отложения кристаллов пирофосфата кальция дигидрата // Ревматология. — http:www.novavitae.org/modules.php
4. Masudu I. Calcium cristal deposition diseases. Lessons from histochemistry // Current Opinion in Rheumatology. — 2004. — Vol. 16, № 3. — P. 279-281.
5. Disla E., Infante R., Fahmy A. et al. Recurrent acute calcium pyrophosphate dihydrate arthritis following intra-articular hyaluronate injection // Arthritis Rheum. — 1999. — Vol. 42. — Р. 1302-1305.
6. Boegard T.L., Rudling O., Petersson I.F., Jonsson K. Magnetic resonance imaging of the knee in chronic knee pain. A 2-year follow-up // Osteoarthritis. Cartilage. — 2001. — Vol. 9. — P. 473-80.
7. Merchant A.C. Classification of Patellofemoral Disorders // Arthroscopy. — 1988. — Vol. 4. — P. 235-40.
8. Басанкин И.В., Белышева Т.В., Ариэль Б.М. Редкое наблюдение метаболического системного кальциноза. Случай из практики. — http:www.novavitae.org/modules.php
9. Годзенко А.А. Артропатия, связанная с отложением основных фосфатов кальция // РМЖ. — 2009. — http://www.rmj.ru/
10. Faure G.C., Daculsi G. Calcified tendinitis: a review // Ann. Rhem. Dis. — 1983. — Vol. 42 (Suppl. 1). — P. 49-53.
11. Takashi Naito, Kosaku Nitta, Naoki Kimata et al. Прогрессирующий опухолевый кальциноз как особенность саркоидоза у пациента на гемодиализе // Nephrol. Dial. Transplant. — 1999. — Vol. 14. — P. 2716-2719.
