Журнал «» 2(16) 2011
Вернуться к номеру
Кардиоренальный синдром
Авторы: Визир В.А., Березин А.Е., Запорожский государственный медицинский университет
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
Обзор посвящен основным вопросам диагностики, профилактики и лечения кардиоренального синдрома. Обсуждаются перспективы использования различных диагностических и лечебных стратегий с целью улучшения выживаемости и снижения риска наступления неблагоприятных клинических исходов.
Кардиоренальный синдром, прогноз, клинические исходы, диагностика, профилактика, лечение.
Последнее десятилетие ознаменовалось существенным увеличением частоты встречаемости хронической сердечной (ХСН) и почечной (ХПН) недостаточности [56]. Многие исследователи при описании заболеваемости, смертности и патоморфоза указанных заболеваний, акцентируя внимание на многообразии клинических форм, сложностях диагностики, профилактики и лечения, указывали на эпидемический характер распространенности ХСН и ХПН [49, 69]. В многочисленных эпидемиологических, проспективных, ретроспективных клинических и специально спланированных исследованиях была установлена тесная ассоциация между тяжестью почечной дисфункции, оцениваемой по величине редукции скорости клубочковой фильтрации (СКФ)/концентрации креатинина плазмы крови, и риском общей смерти, а также возникновением различных кардиоваскулярных событий, включая инфаркт миокарда (ИМ), внезапную смерть, мозговой ишемический инсульт, впервые возникшую сердечную недостаточность (СН) [69]. В частности, среди пациентов с терминальной почечной дисфункцией (end stage of chronic renal disease — ESRD) величина кардиоваскулярной смертности почти в 500 раз выше, чем у лиц общей популяции с нормальной функцией почек [6, 7]. С другой стороны, хроническая СН как потенциально фатальная стадия развития любого сердечно-сосудистого заболевания часто является ведущей причиной наступления неблагоприятного клинического исхода у пациентов с документированной хронической болезнью почек (ХБП) независимо от ее тяжести [7]. Так, результатами регистра JCARE-CARD (Japanese Cardiac Registry of Heart Failure in Cardiology) установлено, что в когорте пациентов с ХБП в качестве основной причины для ургентной госпитализации фигурирует именно остро декомпенсированная (acute decompensate heart failure — ADHF) СН [36]. По данным регистра ADHERE (Acute Decompensated Heart Failure National Registry), 30 % всех госпитализированных больных с острой СН имели ХБП/концентрацию креатинина плазмы крови более 2 мг/дл в анамнезе [1]. В целом принято считать, что в когорте пациентов с кардиоваскулярными заболеваниями элевация креатинина/мочевины плазмы крови является независимым фактором высокого риска негоспитальной смертности, что справедливо и для пациентов с острым коронарным синдромом/ИМ [6]. При проведении анализа результатов 16 рандомизированных клинических исследований (РКИ) (n = 80 098), посвященных СН, было установлено, что 63 % больных с СН имели легкую ХПН и 20 % — умеренную и тяжелую [68]. При этом редукция СКФ на каждые 10 мл/мин/м2 ассоциируется с 7% увеличением кардиоваскулярной смертности.
Таким образом, сформировалось представление о существовании потенциальной ассоциации между миокардиальной и почечной функциями, нарушение которых опосредуется различными патофизиологическими механизмами, но способствует взаимному прогрессированию с формированием СН и ХПН, оказывающими неблагоприятное синергичное влияние на ближайший и отдаленный прогноз [1, 63]. Настоящий обзор посвящен обсуждению основных вопросов, касающихся критериев диагностики, методов профилактики и лечения кардиоренального синдрома.
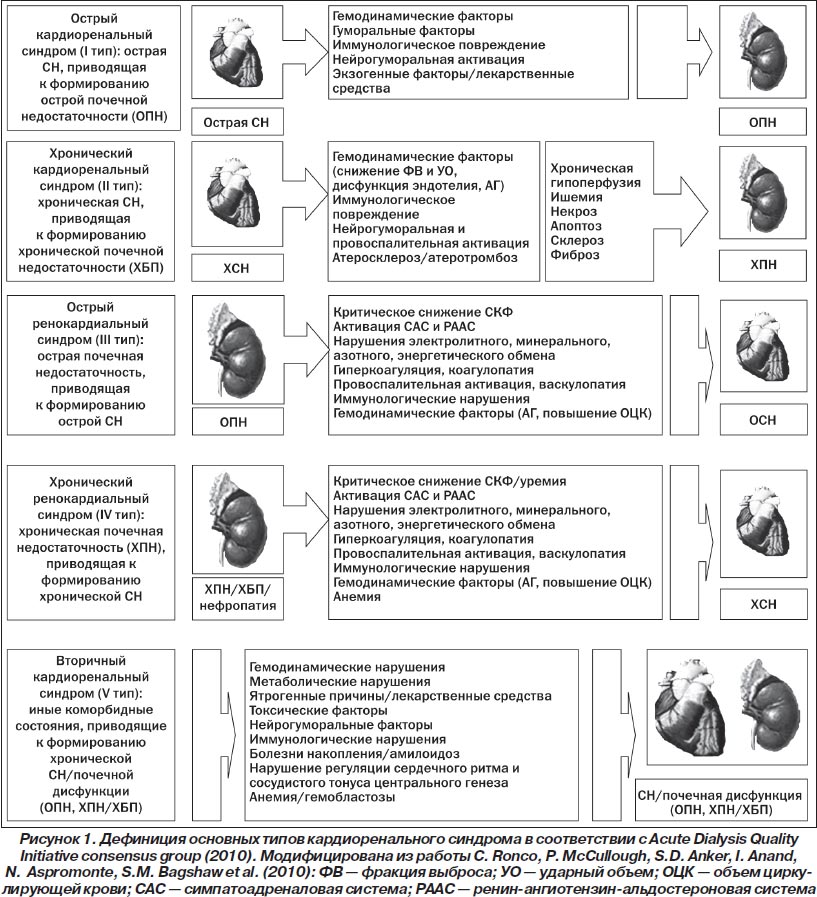
Определение
До последнего времени четко унифицированной позиции в отношении дефиниции кардиоренального синдрома не существовало. Чаще всего при описании характера взаимоотношений «миокардиальная дисфункция — нефропатия» приводили различные атрибуты последних, как то: преобладание острой/хронической СН или ХБП до и после диализного периода, сопутствующих коморбидных состояний, например наличие анемического синдрома. В 2010 году был опубликован согласительный документ Cardiorenalsyndromes: Reportfromtheconsensusconferenceoftheacutedialysisqualityinitiative, явившийся результатом работы исследователей в рамках Acute Dialysis Quality Initiative (ADQI) consensus group [64]. Отличительная особенность этого консенсуального соглашения — декларация о принципиальной неоднородности кардиоренального синдрома как понятия и выделение основных пяти типов последнего в зависимости от наличия острой/хронической СН, а также первичности/вторичности возникновения поражения сердца или почек по отношению друг к другу (рис. 1). По мнению исследователей, предложенная ими градация поможет более четко идентифицировать основные патофизиологические механизмы возникновения кардиоренального синдрома, сформулировать наиболее оптимальные подходы к его лечению и профилактике, а также оценить величину риска наступления неблагоприятного клинического исхода для каждого пациента [63, 64].
Основные патофизиологические механизмы формирования кардиоренального синдрома
В настоящее время концепция кардиоренального синдрома основана на существовании взаимно влияющих патогенетических факторов, как оказывающих неблагоприятное влияние в отношении контрактильной способности миокарда, так и определяющих прогредиентное снижение функциональной способности и выживаемости почки. Причем именно доказанная синергичность указанных взаимоотношений, опосредующаяся вовлечением в патологический процесс разнообразных генетических, гемодинамических, метаболических, структурно-функциональных факторов, нейрогуморальной и провоспалительной активацией, нарушениями липидного и минерального обмена, привела к появлению термина «кардиоренальный синдром» [9, 53, 57]. В качестве прекурсоров и предрасполагающих к появлению последнего факторов обычно рассматривают артериальную гипертензию (АГ), анемию, гипер- и дислипидемию, ишемическую болезнь сердца, сахарный диабет, метаболический синдром/абдоминальное ожирение, ХБП, реноваскулярные заболевания [63, 64, 69].
При этом в качестве основных механизмов, способствующих формированию кардиоренального синдрома, рассматривают повышение центрального венозного давления, снижение перфузии почки, внутрипочечную гипертензию, недостаточность эндогенных механизмов, обеспечивающих эффективный салурез и натрийурез (система натрийуретических пептидов), эндотелиальную дисфункцию, системную провоспалительную и нейрогуморальную активацию, прооксидантный стресс и некоторые другие факторы (рис. 2).
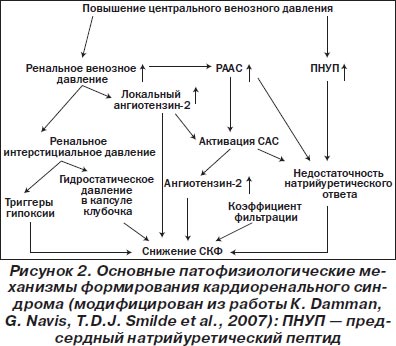
Фактически критическое снижение тканевой перфузии органа-мишени с последующим возникновением ишемического (реперфузионного) воспалительного повреждения является морфологической основой кардиоренального синдрома.
Диагностические подходы к верификации кардиоренального синдрома
Верификация диагноза кардиоренального синдрома у пациентов, находящихся в критическом состоянии, обычно не вызывает серьезных трудностей. Острая СН или тяжелая хроническая СН, ассоциированные с клинически значимым снижением СКФ, а также олигурией/анурией и тяжелой канальцевой дисфункцией как стадиями ОПН, характеризуются яркой клинической картиной. Современная диагностика острой/тяжелой хронической СН и ОПН/тяжелой ХБП достаточно хорошо разработана и представлена в соответствующих клинических рекомендациях [27, 54, 55, 68, 69]. В то же время ранняя диагностика и стратификация пациентов в группы высокого риска формирования кардиоренального синдрома представляют более серьезный интерес [68, 74].
В диагностике СН, как и почечной дисфункции, находят широкое применение биологические маркеры, использование которых может быть применимо для скринирующих и диагностических целей (диагностические биомаркеры), идентификации патофизиологической стадии кардиоренального синдрома (биомаркеры состояния), для оценки величины риска (антецедентные маркеры), прогноза и исхода (прогностические маркеры), а также мониторирования эффективности лечения [74] (рис. 3). Более того, существование определенной экспозици между воздействием этиологического фактора и клинической манифестацией кардиоренального синдрома дает возможность использовать этот подход в качестве диагностического метода на ранних стадиях заболевания. Полагают, что для идентификации острой/хронической СН, оценки риска наступления неблагоприятного исхода наиболее оптимальной является оценка плазменного уровня натрийуретических пептидов (мозговой натрийуретический пептид — МНУП, N-терминальный фрагмент МНУП — NТ-pro-МНУП) и циркулирующих тропонинов Т и I, а также иных маркеров миокардиального повреждения [19, 71]. Внедрение в рутинную клиническую практику других маркеров биомеханического стресса (галектин-3, ST-2-протеин), кардиоваскулярного ремоделирования и провоспалительной активации пока ограничено неоднозначностью интерпретации полученных данных, стоимостью аналитических процедур и недостаточной доказательной базой. Использование метаболических маркеров с целью стратификации пациентов в группу высокого риска возникновения кардиоренального синдрома достаточно хорошо аргументировано, их предсказующая ценность невелика [71].
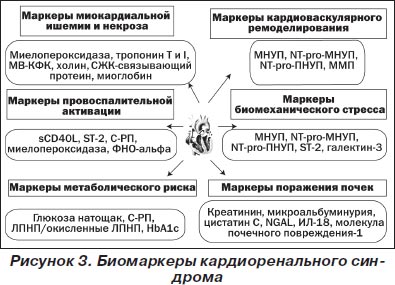
В свою очередь, для стратификации пациентов с острой и хронической почечной дисфункцией предложен достаточно широкий спектр биологических маркеров, измерение которых возможно как в плазме/сыворотке, так и в моче. Наиболее популярные маркеры, отражающие функциональную способность почки и обладающие хорошей предсказующей ценностью, — креатинин плазмы/мочи, СКФ и альбуминурия [2, 55, 60]. Вместе с тем для пациентов с кардиоренальным синдромом традиционные ограничения, касающиеся чувствительности и валидности этих тестов, могут иметь серьезное клиническое значение. Так, в рутинной клинической практике обычно пренебрегают отсутствием прямой линейной зависимости между содержанием креатинина в крови и рассчитанной величиной СКФ по традиционной формуле Кокрофта — Голта [47]. Кроме того, широко известно, что содержание креатинина не способно адекватно отражать незначительные колебания СКФ, а также подвержено влиянию различных внеренальных факторов, включая характер питания, величину массы тела, гендерные, возрастные и этнические различия [24]. Для того чтобы избежать этих трудностей на практике, разработаны формулы 6-MDRD и 4-MDRD (Modification of Diet in Renal Disease Study), обладающие более высокой точностью. Однако рутинное использование последних требует применения калькулятора. Кроме того, эти формулы не применимы в определенных клинических ситуациях, таких как острая почечная недостаточность, беременность, кахексия, заболевания скелетной мускулатуры, пара- и квадриплегия, цирроз печени, трансплантация почек/печени, а также для измерения резидуального диуреза при проведении процедур гемо- и перитонеального диализа, т.е. как раз тогда, когда вероятность возникновения кардиоренального синдрома наиболее высока либо диагноз сомнений не вызывает [2]. Обсуждается вопрос о возможности использования методов расчета СКФ на основании клиренса цистатина С [23, 39]. В отличие от клиренса креатинина плазмы крови измерение циркулирующего пула цистатина С позволяет более точно оценить величину СКФ, особенно в тех случаях, когда последняя превышает 50 мл/мин/м2. Однако данные, полученные различными исследователями, оказались противоречивыми [29, 39, 45]. До конца не ясно, способен ли этот метод достаточно улучшить результаты, чтобы гарантировать его широкое распространение для клинического использования [77].
Альбуминурия относится к так называемым скринирующим маркерам, основные недостатки которых — неспособность отражать динамику изучаемых изменений в лонгитюде и относительно низкая специфичность [2]. В связи с этим внимание исследователей привлекает поиск новых биологических маркеров, удовлетворяющих современным требованиям, включая возможность мониторирования их концентрации, достаточный диагностический и прогностический потенциал [58, 71].
Среди последних у пациентов с кардиоренальным синдромом наибольшее значение имеют креатинин, цистатин C, липокаин, ассоциированный с желатиназой нейтрофилов, молекула почечного повреждения-1 (kidney injury molecule-1), ИЛ-18, асимметричный диметиларгинин и печеночный тип СЖК-связывающего протеина (liver-type fatty acid-binding protein), обеспечивающие в определенной мере возможность детекции клубочкового и тубулярного поражения [55]. Так, цистатин С в большей мере отражает нарушения фукнции клубочков, тогда как молекула почечного повреждения-1, ИЛ-18 и NGAL рассматриваются как маркеры преимущественно тубулярного поражения [35, 37].
Существуют определенные попытки расширить список маркеров почечной дисфункции с целью повышения предсказующей точности и диагностической ценности [14]. Вместе с тем многие исследователи склоняются к мысли о внедрении в клиническую практику планшетных систем для проведения мультимаркерной диагностики. Эти попытки увенчались успехом: к настоящему времени подобные диагностические системы уже созданы и апробированы, а методы анализа стандартизированы. Однако вопрос об экономической целесообразности нового диагностического подхода несколько сдерживает внедрение. С другой стороны, в когорте пациентов, требующих интенсивной терапии или находящихся в критическом состоянии, более разумным является мониторирование важнейших биологических параметров, отражающих состояние больного и характеризующих эволюцию почечной и сердечной недостаточности [61, 78]. Тем более что само проведение терапии в этих условиях обычно нуждается в механической поддержке дыхания, иногда и кровообращения [34]. При этом мониторирование центрального венозного давления, столь необходимого для оценки риска и тяжести кардиоренального синдрома, вообще является рутинной процедурой. В некоторых центрах измерение перфузии органов рассматривается как более надежный критерий вовлечения последних в патологический процесс, чем биомаркерная диагностика.
Стратегические подходы к лечению кардиоренального синдрома
Многие исследователи склоняются к полимодальному подходу в проведении лечебных мероприятий у пациентов с кардиоренальным синдромом. Необходимо отметить, что в большинстве РКИ, посвященных различным стратегиям лечения острой и хронической СН, острая почечная недостаточность, тяжелая почечная дисфункция или ранее документированный диагноз ХБП являлись критериями исключения. Все это обусловливает ограниченность сведений по этому вопросу и, вероятно, будет способствовать продолжению исследований в этом направлении.
Диуретики
Диуретики находят широкое применение в лечении пациентов с острой и хронической СН, особенно в случаях ретенции жидкости и формирования отечного синдрома. Однако эффективность диуретической терапии у лиц с документированным кардиоренальным синдромом существенно лимитирована формирующейся резиститентностью и иногда нестабильной гемодинамикой [46]. В РКИ DOSE-AHF Study (Determining Optimal Dose and Duration of Diuretic Treatment in People with Acute Heart Failure) предпринята попытка оценить перспективы использования диуретической терапии в этих случаях, однако результаты испытания будут доступны только к 2014 году. В то же время использование петлевых диуретиков может негативно отражаться на величине риска внезапной сердечной смерти и тромбоэмболических осложнений [15].
Ваптаны
Полагают, что реализация акваретических эффектов антагонистов рецепторов вазопрессина может существенно повысить эффективность лечения пациентов с кардиоренальным синдромом [3]. Так, селективная блокада V2-рецепторов способствует увеличению диуреза (преимущественно за счет воды — акварезис) [59] без сопутствующей негативной активации ренин-ангиотензиновой и симпатоадреналовой систем, гипотензии, гипокалиемии и стимуляции жажды [32, 75]. Именно перспектива реверсии отечного синдрома у пациентов с гипонатриемией делает ваптаны столь привлекательными для клинического применения, поскольку снижение пула натрия в плазме крови у больных с СН обычно приводит к тяжелому рефрактерному отечному синдрому, прогрессированию дисфункции миокарда и азотемии [44, 66].
В настоящее время созданы и прошли первые этапы клинических испытаний два антагониста рецепторов к вазопрессину: кониваптан (conivaptan) — неспецифический антагонист V1a- и V2-рецепторов и толваптан (tolvaptan) — селективный непептидный антагонист V2-рецепторов [17, 31]. Ваптаны, созданные несколько позднее, — ликсиваптан (lixivaptan) и сатаваптан (satavaptan), а также SR-121463 — находятся на стадии изучения [3, 8, 59].
Рациональность применения толваптана у пациентов с декомпенсированной СН изучалась в РКИ ACTIV in CHF (The Acute and Chronic Therapeutic Impact of a Vasopressin Antagonist in Congestive Heart Failure) [28]. Анализ полученных данных показал, что 60-дневная летальность была достоверно ниже в группе толваптана по сравнению с группой плацебо (ОР = 0,736, 95% ДИ = 0,569–0,952 на каждый 1 ммоль/л повышения плазменного пула натрия) [65]. Однако этот результат был документирован только у пациентов с наиболее тяжелой СН или с сопутствующей азотемией [28, 29]. Необходимо отметить, что способность препарата восстанавливать плазменный пул натрия тесно ассоциировалась с вероятностью клинического улучшения у пациентов независимо от тяжести СН.
В последующем результаты РКИ EVEREST (Efficacy of Vasopressin Antagonism in Нeart Failure Outcome Study With Tolvaptan) показали, что толваптан не оказывает какого-либо позитивного влияния на выживаемость у пациентов с тяжелой СН при длительном наблюдении, но и не приводит к негативным последствиям. Вместе с тем толваптан способствовал снижению выраженности отечного синдрома, одышки, повышению диуреза, снижению потребности в петлевых диуретиках уже в первые сутки от начала лечения. Тем не менее Food and Drug Administration (FDA, США) пока не одобрила толваптан для длительного приема больными с прогрессирующей СН, тогда как неселективный антагонист V1a-V2-рецепторов для парентерального применения кониваптан такое одобрение уже получил [33].
Антагонисты аденозина
Антагонисты аденозина рассматриваются как перспективный класс лекарственных средств, позволяющих повысить выживаемость почечной ткани, что теоретически может найти свое применение при кардиоренальном синдроме. Однако опыт клинического применения этих препаратов весьма ограничен. Так, антагонист A1-рецепторов KW-3902 продемонстрировал способность не только к сохранению почечной функции, но и к реверсии резистентности к диуретикам у пациентов с декомпенсированной СН и кардиоренальным синдромом [30].
Инотропные лекарственные средства
Несмотря на то что фармакологическая инотропная поддержка при острой и декомпенсированной систолической СН демонстрирует способность к существенному улучшению клинического статуса пациентов, серьезным лимитирующим фактором остаются проаритмогенный и проишемический эффекты [62, 72]. К сожалению, несмотря на все выигрышные позиции, терапевтическое окно при использовании инотропных лекарственных средств остается чрезвычайно узким. Так, в РКИ OPTIME-CHF (Outcomes of a Prospective Trial of Intravenous Milrinone for Exacerbations of Chronic Heart Failure) милринон способствовал повышению риска наступления смертельного исхода [25]. До сих пор обсуждаются вопрос об оптимальном дозировании милринона, веснаринона и других представителей этого класса лекарственных средств, продолжительность терапии и оценка риска наступления нежелательных клинических исходов [13, 70].
Левосимендан
Левосимендан (levosimendan) относится к ингибиторам фосфодиэстеразы, так называемым сенситизаторам [80]. Препарат проявляет отчетливый позитивный инотропный эффект, сопоставимый с таковым у добутамина, ассоциированный с повышением величины СКФ [26, 67, 79]. Левосимендан зарегистрирован в ряде стран Евросоюза, Российской Федерации и в Украине, однако не все современные клинические рекомендации рассматривают его как лекарственное средство с доказанным позитивным влиянием в отношении ближайшей и отдаленной выживаемости [51]. Несмотря на благоприятный терапевтический профиль, роль левосимендана при острой СН, в частности вызванной острым инфарктом миокарда, и кардиоренальном синдроме остается предметом дискуссии, а доказательства его безопасности в отношении возможного проаритмогенного эффекта требуют более серьезного внимания [48, 52, 73].
Нейрогуморальныe блокаторы
Бета-адреноблокаторы и антагонисты ренин-ангиотензин-альдостероновой системы. Роль ингибиторов АПФ, антагонистов альдостерона и антагонистов рецепторов к ангиотензину-2 в предотвращении возникновения кардиоренального синдрома до сих пор не ясна. Представители этих классов лекарственных средств рекомендованы на различных стадиях кардиоваскулярного континуума, в том числе и при формировании хронической СН, нефропатии различной этиологии, оказывают органопротекторный эффект и улучшают клинические исходы. Их благоприятное влияние в отношении выживаемости и риска повторных госпитализаций, связанных с декомпенсацией СН, является установленным фактом. В то же время специальных исследований, посвященных их роли при кардиоренальном синдроме, проведено не было. Теоретически при экстраполяции результатов исследований, посвященных хронической СН и ХБП, можно предположить, что благоприятный эффект хронической нейрогуморальной блокады ренин-ангиотензин-альдостероновой системы в отношении снижения риска манифестации кардиоренального синдрома более чем ожидаем.
Прямые ингибиторы ренина. В настоящее время прямые ингибиторы ренина (ПИР), в том числе и зарегистрированный в нашей стране алискирен, рекомендованы для проведения антигипертензивной терапии [43]. В то же время, учитывая их благоприятный терапевтический профиль, существует настоятельная необходимость в подтверждении теоретических преимуществ в условиях специально спланированных длительных РКИ, с оценкой влияния последнего на твердые клинические конечные точки, такие как выживаемость и кардиоваскулярная/общая смертность у пациентов с хронической СН. Так, в небольшом (n = 320) РКИ ALOFT (Aliskiren observation of heart failure Treatment) алискирен продемонстрировал способность к редукции плазменного содержания мозгового натрийуретического пептида, что ассоциировалось с существенной редукцией выраженности митральной регургитации, улучшением профиля трансмитрального кровотока и снижением конечно-диастолического объема левого желудочка (ЛЖ) [50]. Решение вопроса о влиянии алискирена на твердые конечные точки у пациентов с СН адресовано двум запланированным исследованиям: ATMOSPHERE (Aliskiren Trial to Minimise OutcomeS in Patients with HEart FailurE), ASTRONAUT (Aliskiren Trial on Acute Heart Failure Outcomes). После завершения последних можно будет оценить перспективы использования ПИР у больных с дисфункцией ЛЖ, в частности, с целью возможной превенции возникновения кардиоренального синдрома.
Несиритид
В 2001 году FDA по показанию «острая СН» был лицензирован первый рекомбинантный МНУП несиритид (nesiritide) [42]. Препарат обладал не только благоприятным гемодинамическим эффектом, но и проявлял натрийуретическую, ренопротективную активность, а также способствовал реверсии васкулярного и кардиального ремоделирования [10, 40]. В последующем было установлено, что длительная внутривенная инфузия рекомбинантного В-натрийуретического пептида способствует уменьшению выраженности нейрогуморальной активации, преимущественно за счет компонентов ренин-ангиотензин-альдостероновой системы, а также ассоциируется с дозозависимыми вазодилатацией, увеличением натрийуреза, диуреза и ингибированием секреции вазопрессина и эндотелина-1 [10]. Тем не менее клинический эффект несеритида, включая степень реверсии диспноэ, оказался сопоставимым с традиционно применяемой внутривенной инфузией негликозидного инотропного средства или нитроглицерина [27, 42]. Многие исследователи полагают, что ренопротекторные эффекты несиритида, основанные на предотвращении снижения почечной функции за счет блокады локальной ренин-ангиотензиновой и симпатоадреналовой систем, могут оказать благоприятное влияние как на ближайший, так и на отдаленный прогноз у пациентов с СН [38, 41, 42]. Необходимо отметить, что у пациентов с острой СН внутривенное введение несиритида не приводит к снижению скорости клубочковой фильтрации и повышению плазменного пула креатинина [76]. Большое значение может иметь потенцирование эффекта диуретиков, особенно у пациентов с развившейся острой почечной недостаточностью на фоне сердечной декомпенсации [11, 76].
Благоприятные результаты исследований несиритида у больных с острой СН повлекли за собой попытки применения новой стратегии в лечении больных с тяжелой застойной СН. В одном из плацебо-контролируемых рандомизированных пилотных исследований у больных с тяжелой СН несиритид вводился внутривенно в течение 12 часов три дня подряд [12]. Исследователи отметили существенное (по отношению к плацебо) снижение периферического сосудистого сопротивления, повышение сердечного выброса без существенного изменения частоты сердечных сокращений. Кроме того, была зарегистрирована отчетливая редукция активности ренина и концентрации альдостерона плазмы на фоне повышения натрийуреза и диуреза при удовлетворительной переносимости. В испытании FUSION (Follow Up Serial Infusions Of Nesiritide) у пациентов с тяжелой СН (n = 210) применение несиритида на протяжении 12 недель привело к достоверно более выраженному улучшению клинического статуса по сравнению с плацебо. Необходимо отметить, что в этом исследовании выживаемость у больных в группе несиритида имела недостоверную тенденцию к улучшению по сравнению с традиционной стратегией лечения [21, 42]. Тем не менее влияние несиритида в отношении выживаемости у пациентов с острой/тяжелой хронической СН остается предметом дискуссии.
Ультрафильтрация
Процедура ультрафильтрации резервируется для пациентов с документированной рефрактерностью к петлевым диуретикам. В то же время предполагается, что ультрафильтрация может оказаться полезной для предотвращения прогрессирования кардиоренального синдрома уже на ранних стадиях последнего, чему были посвящены два крупных РКИ: RAPID-CHF (Relief for Acutely Fluid-Overloaded Patients With Decompensated Congestive Heart Failure) и UNLOAD (Ultrafiltration Versus Intravenous Diuretics for Patients Hospitalized for Acute Decompensated Congestive Heart Failure) [4, 16]. Анализ результатов этих испытаний показал, что процедура ультрафильтрации способствовала быстрой реверсии клинических признаков СН, снижению массы тела, но не оказывала позитивного влияния на почечную функцию. Ожидается, что завершение РКИ CARRESS-HF (Cardiorenal Rescue Study in Acute Decompensated Heart Failure) позволит более точно установить преимущества ультрафильтрации в отношении повышения выживаемости почечной ткани [22].
В целом можно заключить, что появившаяся недавно целостная концепция кардиоренального синдрома инициирует проведение специально спланированных исследований с целью оптимизации диагностической и лечебной помощи таким пациентам.
1. Adams K.F. Jr, Fonarow G.C., Emerman C.L., LeJemtel T.H., Costanzo M.R., Abraham W.T. et al. ADHERE Scientific Advisory Committee and Investigators. Characteristics and outcomes of patients hospitalized for heart failure in the United States: Rationale, design, and preliminary observations from the first 100,000 cases in the Acute Decompensated Heart Failure National Registry (ADHERE) // Am. Heart J. 2005; 149: 209-216.
2. Aguilar M.I., O’Meara E.S., Seliger S., Longstreth W.T. Jr, Hart R.G., Pergola P.E., Shlipak M.G., Katz R., Sarnak M.J., Rifkin D.E. Albuminuria and the risk of incident stroke and stroke types in older adults // Neurology. 2010 Sep 1. [Epub ahead of print].
3. Ali F., Guglin M., Vaitkevicius P., Ghali J.K. Therapeutic potential of vasopressin receptor antagonists // Drugs. 2007; 67(6): 847-858.
4. Bart B.A., Boyle A., Bank A.J. et al. Ultrafiltration versus usual care for hospitalized patients with heart failure: the relief for acutely fluid-overloaded patients with decompensated congestive heart failure (RAPID-CHF) trial // J. Am. Coll. Cardiol. 2005; 46(11): 2043-2046.
5. Bart B.A., Walsh M.M., Blake D., Goldsmith S.R. Ultrafiltration for cardiorenal syndrome // J. Cardiac Failure. 2008; 14(6): 531-532.
6. Berl T., Henrich W. Kidney-Heart interactions: Epidemiology, pathogenesis, and treatment // Clin. J. Am. Soc. Nephrol. 2006; 1: 8-18.
7. Bock J.S., Gottlieb S.S. Cardiorenal syndrome: new perspectives // Circulation. 2010; 121(23): 2592-600.
8. Bolignano D., Coppolino G., Criseo M., Campo S., Romeo A., Buemi M. Aquaretic agents: what’s beyond the treatment of hyponatremia? // Curr. Pharm. Des. 2007; 13(8): 865-871.
9. Bongartz L.G., Cramer M.J., Doevendans P.A., Joles J.A., BraamB. The severe cardiorenal syndrome: «Guyton revisited» // Eur. Heart J. 2005; 26: 11-17.
10. Butler J., Emerman C., Peacock W.F. et al. The efficacy and safety of B-type natriuretic peptide (nesiritide) in patients with renal insufficiency and acutely decompensated congestive heart failure // Nephrol. Dial. Transplant. 2004; 19: 391-399.
11. Cataliotti A., Boerrigter G., Costello-Boerrigter L.C. et al. Brain natriuretic peptide enhances renal actions of furosemide and suppresses furosemide-induced aldosterone activation in experimental heart failure // Circulation. 2004; 109: 1680-1685.
12. Chen H.H., Redfield M.M., Nordstrom L.J. et al. Subcutaneous administration of the cardiac hormone BNP in symptomatic human heart failure // J. Card. Fail. 2004; 10: 115-119.
13. Cleland J.G., Freemantle N., Coletta A.P., Clark A.L. Clinical trials update from the American Heart Association: REPAIR-AMI, ASTAMI, JELIS, MEGA, REVIVE-II, SURVIVE, and PROACTIVE // Eur. J. Heart Fail. 2006; 8: 105-110.
14. Coca S.G., Yalavarthy R., Concato J., Parikh C.R. Biomarkers for the diagnosis and risk stratification of acute kidney injury: a systematic review // Kidney International. 2008; 73(9): 1008-1016.
15. Cooper H.A., Dries D.L., Davis C.E. et al. Diuretics and risk of arrhythmic death in patients with left ventricular dysfunction // Circulation. 1999; 100: 1311-1315.
16. Costanzo M.R., Guglin M.E., Saltzberg M.T. et al. Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure // J. Am. Coll. Cardiol. 2007; 49(6): 675-683.
17. Costello-Boerrigter L.C., Boerrigter G., Burnett J.C. Jr. V2-receptor antagonism with tolvaptan in heart failure // Expert Opin. Investig. Drugs. 2007; 16(10): 1639-1647.
18. Damman K., Navis G., Smilde T.D.J. et al. Decreased cardiac output, venous congestion and the association with renal impairment in patients with cardiac dysfunction // Eur. J. Heart Failure. 2007; 9(9): 872-878.
19. De Gennaro L., Brunetti N.D., Cuculo A., Pellegrino P.L., Izzo P., Roma F. et al. Increased troponin levels in nonischemic cardiac conditions and noncardiac diseases // J. Interv. Cardiol. 2008; 21: 129-139.
20. Determining Optimal Dose and Duration of Diuretic Treatment in People with Acute Heart Failure (The DOSE-AHF Study), August 2010; http://clinicaltrials.gov/ct2/show/NCT00577135.
21. Doust J.A., Pietrzak E., Dobson A., Glasziou P. How well does B-type natriuretic peptide predict death and cardiac events in patients with heart failure // BMJ. 2005; 330: 625-631.
22. Efectiveness of Ultrafiltration in Treating People With Acute Decompensated Heart Failure and Cardiorenal Syndrome (The CARRESS Study), August 2010; http://clinicaltrials.gov/ct2/show/NCT00608491.
23. Eilers H., Liu K.D., Gruber A., Niemann C.U. Chronic kidney disease: implications for the perioperative period // Minerva Anestesiol. 2010; 76(9): 725-736.
24. Eriksen B.O., Mathisen U.D., Melsom T., Ingebretsen O.C., Jenssen T.G., Njшlstad I., Solbu M.D., Toft I. Cystatin C is not a better estimator of GFR than plasma creatinine in the general population // Kidney Int. 2010; 78(12): 1305-1311.
25. Felker G.M., Benza R.L., Chandler A.B. et al. Heart failure etiology and response to milrinone in decompensated heart failure: results from the OPTIME-CHF study // J. Am. Coll. Cardiol. 2003; 41(6): 997-1003.
26. Follath F., Cleland J.G., Just H. et al. Efficacy and safety of intravenous levosimendan compared with dobutamine in severe low-output heart failure (the LIDO study): a randomised double blind trial // Lancet. 2002; 360: 196-202.
27. Fonarow G.C. The treatment targets in acute decompensated heart failure // Rev. Cardiovasc. Med. 2001; 2 (Suppl. 2): S7-S12.
28. Gheorghiade M., Gattis W.A., O’Connor C.M. et al. Effects of tolvaptan, a vasopressin antagonist, in patients hospitalized with worsening heart failure: a randomized controlled trial (ACTIV in CHF) // JAMA. 2004; 291: 1963-1971.
29. Gheorghiade M., Konstam M.A., Udelson J.E. et al. Vasopressin receptor blockade with tolvapatan in chronic heart failure: differential effects in normonatremic and hyponatremic patients // J. Am. Coll. Cardiol. 2002; 39: 171A.
30. Givertz M.M., Massie B.M., Fields T.K., Pearson L.L., Dittrich H.C. The effects of KW-3902, an adenosine A1-receptor antagonist, on diuresis and renal function in patients with acute decompensated heart failure and renal impairment or diuretic resistance // J. Am. Coll. Cardiol. 2007; 50(16): 1551-1560.
31. Goldsmith S.R. Vasopressin: a therapeutic target in congestive heart failure? // J. Cardiac Failure. 1999; 5: 347-356.
32. Greenberg A., Verbalis J.G. Vasopressin receptor antagonists // Kidney Int. 2006; 69: 2124-2130.
33. Greenberg А. Tolvaptan, an Oral Vasopressin V2 Receptor Antagonist for Heart Failure? // Am. J. Kidney Diseases. 2007; 50(6): 904-907.
34. Griffin M.J., Hines R.L. Management of perioperative ventricular dysfunction // J. Cardiothorac. Vasc. Anesth. 2001; 15: 90-106.
35. Haase M., Bellomo R., Devarajan P., Schlattmann P., Haase-Fielitz A. Accuracy of neutrophil gelatinase-associated lipocalin (NGAL) in diagnosis and prognosis in acute kidney injury: a systematic review and meta-analysis // Am. J. Kidney Diseases. 2009; 54(6): 1012-1024.
36. Hamaguchi S., Tsuchihashi-Makaya M., Kinugawa S., Yokota T., Ide T., Takeshita A. et al. Chronic kidney disease as an independent risk for long-term adverse outcomes in patients hospitalized with heart failure in Japan: Report from the Japanese Cardiac Registry of Heart Failure in Cardiology (JCARE-CARD) // Circ. J. 2009; 73: 1442-1447.
37. Han W.K., Bailly V., Abichandani R., Thadhani R., Bonventre J.V. Kidney Injury Molecule-1 (KIM-1): a novel biomarker for human renal proximal tubule injury // Kidney International. 2002; 62(1): 237-244.
38. Hillege H., Van Gilst W., de Zeeuw D. et al. Renal function as a predictor of prognosis in chronic heart failure // Heart Fail. Monit. 2002; 2: 78-84.
39. Ix J.H., Wassel C.L., Stevens L.A. et al. Equations to Estimate Creatinine Excretion Rate: The CKD Epidemiology Collaboration // Clin. J. Am. Soc. Nephrol. 2011; 6: 184-191.
40. Jensen K.T., Carstens J., Pedersen E.B. Effect of BNP on renal hemodynamics, tubular function and vasoactive hormones in humans // Am. J. Physiol. 1998; 274: F63-F72.
41. Jensen K.T., Eiskjaer H., Carstens J. et al. Renal effects of brain natriuretic peptide in patients with congestive heart failure // Clin Sci. 1999; 96: 5-15.
42. Keating G.M., Goa K.L. Nesiritide: a review of its use in acute decompensated heart failure // Drugs. 2003; 63: 47-70.
43. Kobori H., Nangaku M., Navar L.G., Nishiyama A. The Intrarenal Renin-Angiotensin System: From Physiology to the Pathobiology of Hypertension and Kidney Disease // Pharmacol. Rev. 2007; 59(3): 251-287.
44. Kumar S., Rubin S., Mather P.J., Whellan D.J. Hyponatremia and vasopressin antagonism in congestive heart failure // Clin. Cardiol. 2007; 30(11): 546-551.
45. Le Bricon T.L., Leblanc I., Benlakehal M., Gay-Bellile C., Erlich D., Boudaoud S. Evaluation of renal function in intensive care: plasma cystatin C vs creatinine and derived glomerular filtration rate estimates // Clin. Chem. Lab. Med. 2005, 43: 953-957.
46. Leier C.V. Renal roadblock in managing low output heart failure // Critical Care Medicine. 2004; 32(5): 1228-1229.
47. Levey A.S., Greene T., Kusek J.W., Beck G.J. A simplified equation to predict glomerular filtration rate from serum creatinine // Am. Soc. Nephrol. 2000; 11: A0828.
48. Lilleberg J., Ylonen V., Lehtonen L., Toivonen L. The calcium sensitizer levosimendan and cardiac arrhythmias: an analysis of the safety database of heart failure treatment studies // Scand. Cardiovasc. J. 2004; 38: 80-84.
49. McAlister F.A., Ezekowitz J., Tonelli M. et al. Renal insufficiency and heart failure: prognostic and therapeutic implications from a prospective cohort study // Circulation. 2004; 109: 1004-1009.
50. McMurray J., Pitt B., Latini R. et al. Effects of the oral direct inhibitor aliskiren in patients with symptomatic heart failure // Circ. Heart Fail. 2008; 11: 17-24.
51. Mebazaa A., Nieminen M.S., Packer M. et al. Levosimendan vs dobutamine for patients with acute decompensated heart failure: the SURVIVE randomized trial // J. Am. Med. Association. 2007; 297(17): 1883-1891.
52. Moiseyev V.S., Poder P., Andrejevs N. et al. Safety and efficacy of a novel calcium sensitizer, levosimendan, in patients with left ventricular failure due to an acute myocardial infarction. A randomized, placebo-controlled, double-blind study (RUSSLAN) // Eur. Heart J. 2002; 23: 1422-1432.
53. Mullens W., Abrahams Z., Skouri H.N., Francis G.S., Taylor D.O., Starling R.C. et al. Elevated intra-abdominal pressure in acute decompensated heart failure: A potential contributor to worsening renal function? // J. Am. Coll. Cardiol. 2008; 51: 300-306.
54. National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. http://www.kidney.org/professionals/KDOQI/guidelines_ckd/p5_lab_g4.htm (accessed February 1, 2007).
55. Nickolas T.L., Barasch J., Devarajan P. Biomarkers in acute and chronic kidney disease // Curr. Opin. Nephrol. Hypertens. 2008; 17: 127-132.
56. Ninomiya T., Kiyohara Y., Kubo M., Tanizaki Y., Doi Y., Okubo K. et al. Chronic kidney disease and cardiovascular disease in a general Japanese population: The Hisayama Study // Kidney Int. 2005; 68: 228-236.
57. Nohria A., Hasselblad V., Stebbins A., Pauly D.F., Fonarow G.C., Shah M. et al. Cardiorenal interactions: Insights from the ESCAPE trial // J. Am. Coll. Cardiol. 2008; 51: 1268-1274.
58. Ozer J.S., Dieterle F., Troth S., Perentes E., Cordier A., Verdes P., Staedtler F., Mahl A., Grenet O., Roth D.R., Wahl D., Legay F., Holder D., Erdos Z., Vlasakova K., Jin H., Yu Y., Muniappa N., Forest T., Clouse H.K., Reynolds S., Bailey W.J., Thudium D.T., Topper M.J., Skopek T.R., Sina J.F., Glaab W.E., Vonderscher J., Maurer G., Chibout S.D., Sistare F.D., Gerhold D.L. A panel of urinary biomarkers to monitor reversibility of renal injury and a serum marker with improved potential to assess renal function // Nat. Biotechnol. 2010; 28(5): 486-494.
59. Palm C., Pistrosch F., Herbrig K., Gross P. Vasopressin antagonists as aquaretic agents for the treatment of hyponatremia // Am. J. Med. 2006; 119(7 Suppl. 1): S87-92.
60. Patel P.C., Ayers C.R., Murphy S.A. et al. Association of Cystatin C With Left Ventricular Structure and Function. The Dallas Heart Study // Circulation: Heart Failure. 2009; 2: 98-104.
61. Poole-Wilson P.A., Xue S.R. New therapies for the management of acute heart failure // Curr Cardiol Rep. 2003; 5: 229-236.
62. Remme W.J. Positive inotropes: a new horizon or still a dead end? // Cardiovasc. Drugs Ther. 2001; 15: 375-377.
63. Ronco C., Haapio M., House A.A., Anavekar N., Bellomo R. Cardiorenal syndrome // J. Am. Coll. Cardiol. 2008; 52: 1527-1539.
64. Ronco C., McCullough P., Anker S.D., Anand I., Aspromonte N., Bagshaw S.M. et al. Acute Dialysis Quality Initiative (ADQI) consensus group. Cardiorenal syndromes: Report from the consensus conference of the acute dialysis quality initiative // Eur. Heart J. 2010; 31: 703-711.
65. Rossi J., Bayram M., Udelson J.E., Lloyd-Jones D., Adams K.F., Oconnor C.M., Stough W.G., Ouyang J., Shin D.D., Orlandi C., Gheorghiade M. Improvement in hyponatremia during hospitalization for worsening heart failure is associated with improved outcomes: insights from the Acute and Chronic Therapeutic Impact of a Vasopressin Antagonist in Chronic Heart Failure (ACTIV in CHF) trial // Acute Card. Care. 2007; 9(2): 82-86.
66. Shoji M., Yasujima M. Recent progress in vasopressin research on cardiovascular diseases // Rinsho Byori. 2007; 55(6): 544-548.
67. Slawsky M.T., Colucci W.S., Gottlieb S.S. et al. Acute hemodynamic and clinical effects of levosimendan in patients with severe heart failure. Study Investigators // Circulation. 2000; 102: 2222-2227.
68. Smith G.L., Lichtman J.H., Bracken M.B., Shlipak M.G., Phillips C.O., DiCapua P. et al. Renal impairment and outcomes in heart failure: Systematic review and meta-analysis // J. Am. Coll. Cardiol. 2006; 47: 1987-1996.
69. Soni S., Fahuan Y., Ronco C., Cruz D.N. Cardiorenal syndrome: biomarkers linking kidney damage with heart failure // Biomarkers Med. 2009; 3(5), 549-560.
70. Stevenson L.W. Clinical use of inotropic therapy for heart failure // Circulation. 2003; 108: 367-372.
71. Tang W.H., Francis G.S., Morrow D.A., Newby L.K., Cannon C.P., Jesse R.L. et al. National Academy of Clinical Biochemistry Laboratory Medicine practice guideline: Clinical utilization of cardiac biomarker testing in heart failure // Circulation. 2007; 116: e99-e109.
72. Thackray S., Easthaugh J., Freemantle N. et al. The effectiveness and relative effectiveness of intravenous inotropic drugs acting through the adrenergic pathway in patients with heart failure — a meta regression analysis // Eur. J. Heart Fail. 2002; 4: 515-529.
73. Toivonen L., Viitasalo M., Sundberg S., Akkila J., Lehtonen L. Electrophysiologic effects of a calcium sensitizer inotrope levosimendan administered intravenously in patients with normal cardiac function // J. Cardiovasc. Pharmacol. 2000; 35: 664-669.
74. Vasan R.S. Biomarkers of cardiovascular disease: Molecular basis and practical considerations // Circulation 2006; 113: 2335-2362.
75. Veeraveedu P.T., Watanabe K., Ma M., Palaniyandi S.S., Yamaguchi K., Kodama M., Aizawa Y. Effects of V2-receptor antagonist tolvaptan and the loop diuretic furosemide in rats with heart failure // Biochem. Pharmacol. 2008; 75(6): 1322-1330.
76. VMAC Investigators. Intravenous nesiritide vs. nitroglycerin for treatment of decompensated congestive heart failure: a randomized controlled trial // JAMA. 2002; 287: 1531-1540.
77. Wagner С. Cystatin C, Renal Function and Cardiovascular Risk // Eur. Nephrology. 2010; 4: 49-54.
78. Whang W., Mittleman M.A., Rich D.Q. et al. Heart failure and the risk of shocks in patients with implantable cardioverter defibrillators: results from the Triggers of Ventricular Arrhythmias (TOVA) study // Circulation. 2004; 109: 1386-1391.
79. Yilmaz M.B., Yalta K., Yontar C. et al. Levosimendan improves renal function in patients with acute decompensated heart failure: comparison with dobutamine // Cardiovascular Drugs and Therapy. 2007; 21(6): 431-435.
80. Yokoshiki H., Katsube Y., Sunagawa M. et al. Levosimendan, a novel Ca2+ sensitizer, activates the glibenclamide-sensitive K+ channel in rat arterial myocytes // Eur. J. Pharmacol. 1997; 333: 249-259.