Журнал «Травма» Том 11, №4, 2010
Вернуться к номеру
Возможность использования интраоперационного раневого отделяемого для получения обогащенного тромбоцитами и клетками костного мозга концентрата
Авторы: А.И. Швец, А.А. Самойленко, П.К. Бойченко, Г.В. Самойленко - Луганский государственный медицинский университет, Луганская диагностическая лаборатория, Луганск,Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Исследован состав крови и состав отделяемого из костной раны во время выполнения стабилизирующих операций на проксимальном отделе бедра у 15 пациентов. Клинический анализ крови выполнялся на гемоанализаторе “Mythic-18”. Определялось количество эритроцитов, лейкоцитов, тромбоцитов, клеток предшественников, гематокрит. Количество тромбоцитов в раневом отделяемом значительно не отличалась от их уровня в венозной крови, а иногда превышала. В раневом отделяемом на 100 клеток встречались от 2 до 6 клетки предшественники. Использование раневого отделяемого для получения богатой тромбоцитами плазмы имеет преимущества, потому что наличие клеток костного мозга позволяет более эффективно влиять на репаративний остеогенез.
Досліджено склад крові та склад відділяємого з кісткової рани під час виконання стабілізуючих операцій на проксимальному відділі стегна у 15 пацієнтів. Клінічний аналіз крові виконувався на гемоаналізаторі “Mythic-18”. Визначалась кількість еритроцитів, лейкоцитів, тромбоцитів, клітин попередників, гематокріт. Кількість тромбоцитів в раневому відділяємому значно не відрізнялась від їх рівня в венозній крові, а іноді перевищувала. В раневому відділяємому на 100 клітин зустрічали від 2 до 6 клітин попередників. Використання раневого відділяємого для приготування багатої на тромбоцити плазми має певні переваги, бо наявність клітин кісткового мозку дозволяє більш ефективно впливати на репаративний остеогенез.
Composition of blood and composition of intraosseous hemorrahage was examined while performing stabilizing operations proximal femur of fifteen patients. Clinical blood analysis was done on hemoanalyzer “Mythic-18”, erythrocytes, throbocytes, leucoccytes, hemathocrit count was determined. Trombocytes count wasn''t differed in the wound discharge from that in the central blood flow. The use of wound discharge for preparation of thrombocytes rich and bone marrow cells concentration has certain advantagas because bone marrow cells present in it have a more positive effect on reparative osteogenesis.
регенерация, остеогенез, костномозговой канал, венозная кровь
регенерація, остеогенез, костномозковий канал, венозна кров
regeneration, osteogenesis, bone marrow canal, venous blood
Несмотря на значительные успехи в разработке фиксирующих устройств для стабилизации переломов, процессы заживления переломов костей в 2,5 % – 18 % проходят с нарушением репаративной регенерации, а в некоторых случаях заканчиваются несращением перелома или формированием ложного сустава. По нашим данным [2], у пациентов старшей возрастной группы такие нарушения встретились у 12 % больных после выполнения стабилизирующих операций. Значительные материальные затраты на лечение, необходимость повторных оперативных вмешательств ставят перед травматологами задачу оптимитизации процессов репаративной регенерации в каждом конкретном случае. Профилактика расстройств репаративной регенерации кости, оптимизация условий сращения переломов является актуальной задачей для большинства отечественных и зарубежных ученых [6]. Существует большое количество работ, посвященных этой проблеме. Поэтому в поле зрения травматологов постоянно находится костная ткань, изучаются возможности воздействия на остеогенез на различных этапах лечения, разрабатываются технологии использования остеоплас- тических материалов, которые должны быть безопасны, биосовместимы, обладать не только свойствами остеоиндукции и остеокондукции, но и остеогенными свойствами. Существует большое количество исследований, в которых используется аутокость, аллокость, ксенокость, костный матрикс, биокерамика, технологии тканевой инженерии. Тем не менее, проблема поиска новых средств и методов профилактики и лечения нарушений репаративной регенерации остается актуальной. В последнее десятилетие, усилия ученых направлены на получение остеогенных материалов, взятых из крови пациентов [1,3,4,8,13], костного мозга [5,7,14,15] или сочетания тромбоцитарного концентрата и клеток костного мозга [10]. Но применение композитных материалов в клинических условиях не всегда эффективно [9,11,12]. Улучшение процессов регенерации в совокупности с уменьшением травматичности вмешательства особенно важно у пациентов старшей возрастной группы.
В связи с этим, целью наших исследований стало изучение раневого отделяемого при выполнении стабилизирующих операций на проксимальном отделе бедра у больных старшей возрастной группы, как материала для получения тромбоцитарного концентрата и клеток костного мозга.
Материалы и методы
Нами изучены клеточный состав венозной крови и материал внутрикостного отделяемого из фрезевых отверстий в проксимальном отделе бедра, выполненных для установки фиксатора DHS у 15 пациентов. Из них 11 женщин и 4 мужчин, возраст от 62 до 74 лет. Операция остеосинтеза проксимального отдела бедра выполнялась на 2 – 6 сутки после травмы. Во время выполнения операции из вены забиралась кровь в моноветт с ЭДТА в объеме 5 мл. На этапе формирования ступенчатой фрезой канала в проксимальном отделе бедра для винта Ричардса, кровянистое отделяемое из костной раны также забиралось в моноветт с ЭДТА в объеме 5 мл. В Луганской диагностической лаборатории выполнялся клинический анализ содержимого моноветтов на гемоанализаторе “Mythic-18”. Определялось содержание эритроцитов, лейкоцитов, тромбоцитов, клеток предшественников, гематокрит. Полученные цифровые данные обрабатывались методами вариационной статистики с использованием пакета Statistica 5.11 for Windows.
Результаты и обсуждение
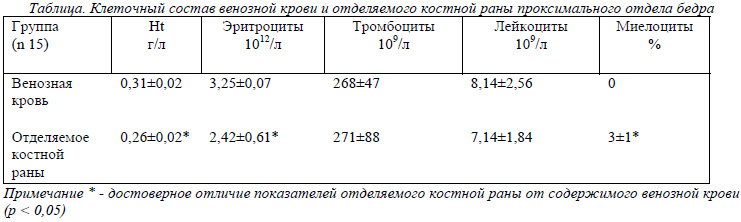
При оценке всех полученных результатов проводилось сравнение показателей клеточного состава венозной крови и содержимого отделяемого из костного канала в проксимальном отделе бедра, поиска клеток костного мозга, что отражено в таблице. Гематокрит раневого отделяемого был всегда ниже его уровня венозной крови (p < 0,05), также снижено количества клеток, особенно эритроцитов (p < 0,05). Но количество лейкоцитов в раневом отделяемом снижалось незначительно, при этом среди них было до 3 % миелоцитов (p < 0,05). Количество тромбоцитов значительно не отличалось от их уровня в венозной крови, а иногда даже превышало их уровень. Во всех анализах раневого отделяемого на 100 клеток определялось от 2 до 6 клеток предшественников (нормобласты, кариобласты, ретикулярные клетки).
Наличие в костной ране клеток эндоста, стромы костного мозга, малодифференцированных клеток- предшественников, у которых функция пролиферации не блокирована, позволяет получить на месте костных дефектов новую кость. Насыщенное активными клетками раневое костное отделяемое может быть полезно в составе композитных материалов для влияния на индукцию костеобразования взамен или в дополнение костной аутопластики.
Выводы
Полагаем использование концентрата, полученного из костного раневого отделяемого, в травматологии перспективным. Получение и применение тромбоцитарного концентрата, получаемого из раневого отделяемого во время стабилизирующих операций на проксимальном отделе бедра, возможно в условиях травматологических отделений городских больниц. Использование отделяемого из костной раны для приготовления клеточного концентрата имеет преимущества над багатой тромбоцитами плазмой, т.к. содержит, помимо тромбоцитов, клетки костного мозга, что способствует повышению активности репаративного остеогенеза. Использование такой обогащенной клеточной смеси при остеопластических манипуляциях, в ряде случаев, может заменить аутокость, благодаря способности остеогенных клеток и тромбоцитов активизировать и индуцировать процессы костной регенерации.
Перспективы дальнейших исследований. Для подтверждения выявленных закономерностей будет проведено цитологическое и гистологическое исследование клеточного концентрата, полученного из крови и костного раневого отделяемого.
- Брехов В.Л. Хирургическое лечение больных с дефектом костной и хрящевой ткани с применением богатой тромбоцитами аутоплазмы: автореф.дис. …канд.мед.наук. Курск, 2007. – 20 с.
- Ивченко В.К., Швец А.И., Гаврилов И.И. с соавт. Осложнения погружного металлостеосинтеза переломов проксимального отдела бедра // Український журнал екстремальної медицини ім.Г.О.Можаєва.- 2009.-Т.10 № 2.– С. 82-86.
- Калашников А.В., Зубенко А.Г. Возможность использования обогащенной тромбоцитами плазмы для оптимизации репаративного остеогенеза (обзор литературы) // Український журнал екстремальної медицини ім.Г.О.Можаєва.- 2009.- Т. 10 № 2. – С. 166 - 171.
- Кирилова И.А., Фомичев Н.Г., Подорожная В.К., Этитейн Ю.В. Сочетанное использование остеопластики и богатой тромбоцитами плазмы в травматологии и ортопедии (обзор литературы) // Травматология и ортопедия России.- 2008, № 3 (49). – С. 63 – 67.
- Климовицкий В.Г., Гринь В.К., Оксимец В.М., Попандопуло А.Г., Зубов Д.А. Механизмы влияния мезенхимальных стволовых клеток на репаративный остеогенез // Травма.- 2009.- Т. 10, № 2.- С. 123 – 133.
- Омельяненко Н.П., Миронов С.П.,Денисов-Никольский Ю.И. с соавт. Современные возможности оптимизации репаративной регенерации костной ткани //Вестник травматологии и ортопедии им. Н.Н. Приорова – 2002 – №4 – С.85 – 88
- Савинцев А.М., Смолянинов А.Б., Булгин Д.В., Булатов М.А. Перспективы применения клеточных технологий в травматологии и ортопедии // Травматология и ортопедия России.- 2007, № 4 (46). – С. 58 – 60.
- Самодай В.Г. Использование богатой трмбоцитами аутоплазмы в лечении псевдартрозов и инфицированных дефектов костной ткани // Материалы 111 Всероссийского симпозиума с международным участием Актуальные вопросы тканевой и клеточной трансплантологии» Москва. 25-26 апр.2007. – М. 2007. – С. 148-150.
- Connolloy J.F. Injectable bone marrow preparation to stimulate osteogenic repair. //Clin. Orthop. – 1995 - №313 – P. 8 – 18.
- Dallari D., Savarino L., Stagni C. et al. Enhanced Tibial Osteotomy Healing with Use of Bone Grafts Supplemented with Platelet Gel or Platelet Gel and Bone Marrow Stromal Cells. //The Journal of Bone and Joint Surgery [American]. – 2007 – № 89 – P. 2413 – 2420.
- DeCoster T. A., Gehlert R. J., Mikola E. A., Pirela-Cruz M. A. Management of Posttraumatic Segmental Bone Defects // J Am Acad Orthop Surg – 2004, Vol. 12, No 1, January/February.- Р. 28 - 38.
- Healey J.H., Zimmerman P.A., Mc Donnel J.M. Percutaneous autologous bone marrow grafting of delayed union and nonunion in cancer patients. // Clin Ortop – 1990 – Vol. 256 – P. 280 – 285.
- Lowery G.L., Kulkarni S., Pennisi A.E. Use of autologous growth factors in lumbar spinal fusion. // Bone – 1999 – № 2 – P. 47 – 50.
- Muschler G. Connective tissue progenitors: practical concepts for clinical applications / G.Muschler, R.G.Midura // Clin. Orthop.- 2002.- № 395. – P. 66 – 80.
- Muschler G. Spine fusion using cell matrix composites enriched in bone marrow-derived cells / G.Muschler, et al. // Clin. Orthop.- 2003.- № 407. – P. 102 – 118.