Журнал «Травма» Том 11, №5, 2010
Вернуться к номеру
Эффективность миокальцика при лечении остеопоротических крыс с тяжелой черепно-мозговой травмой по данным изменения отдельных показателей кальциевого обмена и цитокинов
Авторы: С.Е. Золотухин, Н.А. Зенько, Т.М. Чирах - НИИ травматологии и ортопедии Донецкого национального медицинского университета им. М. Горького, Донецк, Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Работа посвящена оценке эффективности кальцитонина лосося («Миокальцика») при тяжелой черепно-мозговой травме, протекающей на фоне остеопороза. В работе использованы физиологичные, патофизиологические, рентгенологические, биохимические и статистические методы исследования. Эффективность препарата определяли путем сравнения продолжительности жизни животных, имеющих тормозный (смертельный) тип течения посттравматической реакции, развивающийся при стандартной по силе воздействия травме мозга и при глюкокортикоидном остеопорозе легкой степени тяжести в двух группах животных (леченных кальцитонином и нелеченных). Эффективность кальцитонина лосося при глюкокортикоидном остеопорозе и травме изучали также по изменению комплекса биохимических показателей крови в двух группах крыс, которым вводили препарат (опытная группа 2 и крыс с остеопорозом и травмой без введения препарата (контрольная группа 2).
Робота присвячена оцінці ефективності кальцитоніну лосося ("Міокальцику") при тяжкій черепно-мозковій травмі з перебігом на тлі остеопорозу. У роботі використані фізіологічні, патофізіологічні, рентгенологічні, біохімічні, статистичні методи дослідження. Ефективність препарату визначали шляхом порівняння тривалості життя тварин з гальмівним (смертельним) типом перебігу посттравматичної реакції, що розвивається при стандартній за силою дії травмі мозку при глюкокортикоїдному остеопорозі легкого ступеню тяжкості, в двох групах тварин (лікованих кальцитоніном і нелікованих). Ефективність кальцитоніну лосося при глюкокортикоїдному остеопорозі травмі вивчали також за зміною комплексу біохімічних показників крові в двох групах щурів, яким вводили препарат (дослідна група 2) і щурів з остеопорозом і травмою без введення препарату (контрольна група 2).
Is devoted to assessing the effectiveness of salmon calcitonin (“Miocalcic”) in severe traumatic brain injury occurring on the background of osteoporosis. We used the physiological, pathophysiological, radiological, biochemical and statistical methods. Efficacy was determined by comparing the longevity of the animals that are inhibitory (lethal) type of a posttraumatic reac- tion, developing a standard for the force of impact injury to the brain and glucocorticoid osteoporosis, mild in two groups of animals (treated with calcitonin and untreated). The effectiveness of salmon calcitonin in glucocorticoid induced osteoporosis, and trauma have also studied the change of the complex biochemical indices of blood in the two groups of rats injected with the drug (experimental group 2) and rats with osteoporosis, and trauma without drug administration (control group 2).
тяжелая черепно-мозговая травма, глюкокортикоидный остеопороз, кальцитонин лосося.
тяжка черепномозкова травма, глюкокортикоїдний остеопороз, кальцитонін лосося.
craniocerebral trauma, glucocorticoid osteoporosis, calcitonin salmon.
В настоящее время частота и тяжесть механических повреждений, обусловленных факторами цивилизации, не имеют тенденции к снижению [3, 4]. В структуре общего травматизма, по данным ВОЗ, поражения головного мозга составляют 25-30 % [8]. На долю черепно-мозговой травмы (ЧМТ) приходится 2/3 смертельных исходов [7]. Среди всех сочетанных повреждений сочетанная ЧМТ составляет 89,4 % [8]. Травмы мозга являются одной из причин высокой инвалидности и временной утраты трудоспособности [7]. Летальность от ЧМТ возрастает в случае присоединения к ней шока – она увеличивается до 90 % [3, 4].
Особенно неблагоприятно протекает травматическая болезнь у людей, имеющих тяжелые фоновые заболевания, в том числе и остеопороз [2,6]. Тяжелая ЧМТ, полученная на фоне глюкокортикоидного остеопороза, характеризуется высокой летальностью и частотой осложнений [1,6]. В настоящее время эффективность кальцитонина у пострадавших с тяжелой ЧМТ и сопутствующим остеопорозом не изучены, а механизмы его лечебного действия нуждаются в уточнении.
Цель исследования – оценить эффективность миокальцика (кальцитонина лосося) по характеру изменения отдельных показателей кальциевого обмена и цитокинов у крыс с глюкокортикоидным остеопорозом и тяжелой черепно-мозговой травмой.
Материал и методы
Экспериментальные исследования выполнены на 46 белых беспородных крысах весом 250-300 г. Подготовка животных к эксперименту, травмирование и выведение из эксперимента осуществляли при соблюдении общих требований и положений Европейской конвенции по защите позвоночных животных, используемых для исследовательских и других целей (Страсбург, 1986).
В исследовании изучали эффективность кальцитонина лосося (фармакологический препарат «Миокальцик», выпускаемый фирмой Novartis Pharma в форме ампульного раствора для инъекций). 1мл препарата содержал 100 МЕ синтетического кальцитонина лосося (1 МЕ биологической активности препарата соответствовал 0,2 мкг активного вещества) [9, 10].
На предварительном этапе исследования эффективность кальцитонина лосося при ЧМТ, а также при сочетании ЧМТ с остеопорозом изучали по увеличению измерением электрокожного сопротивления у травмированных крыс [4].
Типы посттравматической реакции при ЧМТ определяли с помощью модифицированного метода измерения электропроводности кожи посредством показателя «К» в динамике по С.Е. Золотухину [5]. В частности, показатель «К» вычисляли по формуле:
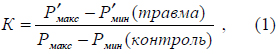
где: Рмакс – величина электрического сопротивления кожи, измеряемого при напряжении 0,6 В; Рмин – при напряжении 0,2
В.
На предварительном этапе исследования эффективность кальцитонина лосося при ЧМТ, а также при сочетании ЧМТ с остеопорозом изучали по увеличению продолжительности жизни крыс, леченных препаратом (опытная группа), по сравнению со временем жизни крыс без лечения (группа контроля). Препарат вводили через 4 часа после нанесения травмы и типирования посттравматической реакции. В опытной группе крыс кальцитонин лосося вводили внутрибрюшинно в дозе 25 МЕ/кг (в объемном эквиваленте это составляло 0,4 мл/кг официнального раствора). Эффективность кальцитонина лосося при моделируемой патологии в основной серии экспериментов изучали по изменению комплекса биохимических показателей крови в двух группах крыс, которым вводили препарат (опытная группа 2) и крыс с остеопорозом и травмой без введения препарата (контрольная группа 2). В каждой группе животных было по 8 особей. 10 крыс использованы для сравнения (контроль - интактные животные).
ЧМТ моделировали путем нанесения одного удара пружинным ударником по черепу крыс силой 1325 Н/см2. При отработке методики моделирования посттравматической реакции все параметры летальности и исследуя морфологические изменения в области травмы черепа и мозга. В целом травма мозга идентифицировалась как ЧМТ средней и тяжелой степени тяжести. Летальность в остром периоде ЧМТ (до 1 суток) составила 40,0%. Продолжительность жизни животных при моделируемой патологии лежала в широком интервале значений – от 12 до 75 часов, в среднем 34,5±3,3 часа. Большой разброс данных времени жизни крыс вызвал необходимость учета роли индивидуальной реактивности животных. Для этого была применена методика, связанная с где: Рмакс – величина электрического сопротивления кожи, измеряемого при напряжении 0,6 В; Рмин – при напряжении 0,2В.
Само электрическое сопротивление снимали с помощью электродов-прищепок с передних лап крыс и определяли по закону Ома. Числитель уравнения 1 отражал изменения электрического сопротивления кожи, полученные в динамике посттравматической реакции, знаменатель – в контроле (до нанесения травмы у каждого животного). На основании дискретных значений показателя «К», вычисляемых в течение 4 часов после травмы у животных, находящихся в иммобилизированном состоянии, строили графики. Для выяснения связи изменений показателя «К» с фазами посттравматической реакции проведены сопоставления этого показателя с параметрами АД, ЧСС и ЧД. Они подтвердили фазный характер развития ЧМТ [3, 4]. Характер повреждений мозга и изменений индивидуальной реактивности животных, определяемый по электрокожной сопротивляемости, лежал в основе определения типов посттравматической реакции и имел важное прогностическое значение. В динамике ЧМТ на основании значений показателя «К» дифференцировали три ее основных типа. Первый тип реакций крыс, погибших на третьи сутки после травмы, назван нами «возбудимым», второй тип реакций крыс, погибших на вторые сутки, «промежуточным», а третий тип реакций крыс, погибших в течение первых суток, «тормозным». В процентном отношении структура распределения типов выглядело соответственно 30:30:40.
В настоящем исследовании использованы крысы, у которых дифференцировался только тормозный (как наиболее тяжелый) тип посттравматической реакции.
Моделирование остеопороза осуществляли путем внутримышечного введения 3 мг/кг метилпреднизолона (фирма «Pfizer», США) в сутки на протяжении 4-5 недель под непосредственным еженедельным рентгенологическим контролем длины пояснично-грудного отдела позвоночника крысы и учета степени уменьшения средней длины одного позвонка этого сегмента, по которой и определяли (посредством вычисления показателя R) тяжесть остеопороза [2]. В исследовании использованы крысы, у которых развивался остеопороз легкой степени (при более тяжелых формах остеопороза и тяжелой ЧМТ имела место ранняя летальность).
При моделировании сочетанной патологии первоначально вызывали у крыс остеопороз, а затем наносили травму.
Определение содержания гормонов (кальцитонина, КТ, паратиреоидного гормона, ПТГ, тиреотропного гормона, ТТГ, тироксина, Т4, трийодтиронина и Т3, цитокинов (интерлейкина – 6, ИЛ-6) и фактора некроза опухоли – альфа (ФНО-α) проводили иммуноферментным и радиоиммунологическим (метка радиоактивным изотопом I125) методами (с использованием стандартных коммерческих наборов реактивов для определения исследуемых веществ в образцах плазмы крови крыс). Содержание ионизированного кальция в сыворотке крови определяли с помощью ионоселективных электродов на анализаторе «Эксперт 001».
Статистическая обработка результатов анализа выполнена с использованием метода вариационной статистики.
Результаты и обсуждение
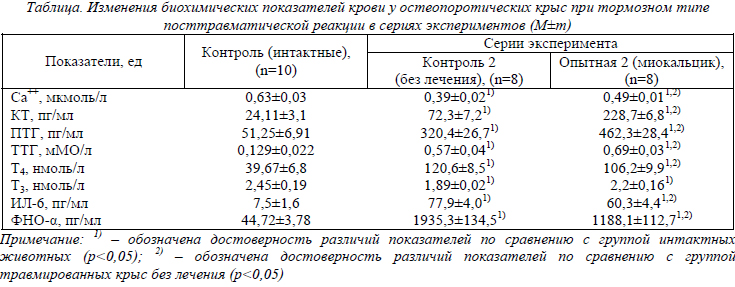
Продолжительность жизни у остеопоротических (остеопороз легкой степени тяжести) крыс с травмой при тормозном типе посттравматической реакции (контроль 1) была равна 12,2±2,2 часа (без лечения). Для сравнения продолжительность жизни крыс с тормозным типом посттравматической реакции без остеопороза и лечения составила 19,3±3,2 часа. Продолжительность жизни крыс в опытной серии (с остеопорозом, с ЧМТ и с лечением) составила - 19,7±2,3 часа. Разница по сравнению с соответствующим контролем составила 7,5 часа (p<0,05). Результаты биохимических исследований у крыс контрольных и опытной серий представлены в таблице.
Как видно из представленных данных, у крыс с тормозным типом посттравматической реакции и остеопорозом легкой степени через 8 часов после травмы (контрольная серия) наблюдались глубокие нарушения метаболизма Са++, выраженная нейроэндокринная реакция и гиперцитокинемия. Изменения исследованных биохимических показателей в этой серии характеризовали тяжесть и необратимость патологического процесса у животных с тормозным типом посттравматической реакции и остеопорозом (они касались в первую очередь уровня ионизированного кальция и цитокинов - ИЛ- 6 и ФНО-α). У животных, которым вводили внутрибрюшинно миокальцик, наблюдались изменения, отличающиеся от контроля (травма без лечения). Обращало на себя внимание, что возрастала на 15,8% (p<0,05) концентрация ионизированного кальция, резко в 3,2 раза увеличивалась концентрация КТ (p<0,05), в 1,4 раза возрастала концентрация ПТГ (p<0,05) и в 1,2 раза – концентрация ТТГ (p<0,05).
При этом на 36% снижалась концентрация Т4 (p<0,05). Уровень Т3 не изменялся. Уровень ИЛ-6 снижался в 1,3 раза (p<0,05), а ФНО-α – в 1,6 раза (p<0,05). Изменение всех показателей следует считать благоприятным, поскольку у животных с аналогичной тяжестью и дозой миокальцика наблюдалось увеличение продолжительности жизни. Благоприятную картину состояния животных по сравнению с контрольной группой также подчеркивают увеличение концентрации кальция и некоторое снижение цитокиновых показателей. Возросшая в 3,2 раза концентрация КТ говорила об экзогенно введенном кальцитонине (в составе фармпрепарата «Миокальцик»), который детектировался используемым аналитическим методом. Увеличение концентрации ПТГ и ТТГ после введения миокальцика крысам с тормозным типом посттравматической реакции и остеопорозом также следует считать результатом действия миокальцика. Исходя из функционально антагонистических механизмов влияния КТ и ПТГ на кости и кальциевый обмен в целом, можно было бы предполагать, что уровень ПТГ после введения КТ лосося должен снижаться. На самом деле, как видно из таблицы, он повысился, причем повысился вместе с ТТГ. Повышение ПТГ и ТТГ в крови вызвано, вероятно, усилением гипофизарного синтеза и выброса гормонов в кровь. Влияние миокальцика на ЦНС подтверждают литературные источники, в частности данные о наличии в ЦНС специфических рецепторов для связывания кальцитонина лосося [3, 9]. Вероятно, с этими свойствами миокальцика связан и его анальгетический эффект. С увеличением концентрации ТТГ не происходило существенных отклонений в уровне гормонов Т4 и Т3, однако незначительные, хотя и достоверные изменения Т4 свидетельствовали о сдвиге в сторону восстановления функциональной связи гипоталамуса и гипофиза с щитовидной железой. Данные о снижении уровня гиперцитокинемии при введении крысам миокальцика, вероятно, были вызваны положительным влиянием препарата на желудочно-кишечный тракт. Известно, что миокальцик снижает желудочную и экзокринную панкреатическую секрецию [10]. Эти свойства препарата обусловливают его эффективность в лечении острого панкреатита [6]. При травматическом процессе указанные механизмы миокальцика препятствуют неполноценному перевариванию пищи, содержащейся в желудочно-кишечном тракте животных, действию агрессивных соков на слизистую оболочку этого тракта и, как следствие, уменьшению всасываемости непереваренных (полноценная функция желудочно- кишечного тракта при тяжелой механической травме нарушается) компонентов пищи в кровь. Следует считать, что за счет снижения интоксикации организма со стороны токсических продуктов желудочно-кишечного тракта снижался уровень ИЛ-6 и ФНО-α.
Таким образом, результаты влияния миокальцика на отдельные показатели кальциевого обмена, нейроэндокринной, цитокиновой реакции у животных с тормозным типом посттравматической реакции и остеопорозом свидетельствуют о наличии выраженного лечебного действия препарата. Лечебное действие миокальцика при ЧМТ реализуется за счет механизма его нейротропного действия на ЦНС и, в частности, на гипоталамо-гипофизарную систему. Таким путем повышается в 1,4 раза (p<0,05) и в 1,2 раза (p<0,05) концентрация в крови ПТГ и ТТГ соответственно. Миокальцик также, вероятно, уменьшает интоксикацию организма токсическими продуктами кишечника. Благодаря этому механизму концентрация ИЛ-6 в крови снижается в 1,3 раза (p<0,05), а концентрация ФНО-α – в 1,6 раза (p<0,05).
Таким образом, проведена оценка эффективности кальцитонина лосося при тяжелой механической травме и сопутствующем глюкокортикоидном остеопорозе в эксперименте. Она показала эффективность препарата при тормозном типе посттравматической реакции и глюкокортикоидном остеопорозе легкой степени. Лечебное действие миокальцика при ЧМТ, вероятно, реализуется за счет механизма его нейротропного действия на ЦНС и, в частности, на гипоталамо- гипофизарную систему. Таким путем повышается в 1,4 раза (p<0,05) и в 1,2 раза (p<0,05) концентрация в крови ПТГ и ТТГ соответственно. Миокальцик, вероятно, также уменьшает интоксикацию организма токсическими продуктами кишечника. Благодаря этому механизму концентрация ИЛ-6 в крови снижается в 1,3 раза (p<0,05), а концентрация ФНО-α – в 1,6 раза (p<0,05).
Выводы
- Миокальцик (кальцитонин лосося) обладает лечебной эффективностью при тяжелой черепно-мозговой травме. У животных с сочетанной патологией (тормозный тип посттравматической реакции, развивающийся у животных с легкой степенью остеопороза) продолжительность жизни крыс по сравнению с контролем (без лечения) увеличивается на 7,5 часа (p<0,05).
- Механизм лечебного действия миокальцика реализуется за счет его нейротропного действия на ЦНС и, в частности, на гипоталамо-гипофизарную систему, а также за счет ограничения процессов пищеварения, что в условиях тяжелой ЧМТ уменьшает проникновение в кровь из желудочно-кишечного тракта токсических продуктов гниения и брожения пищи.