Журнал «Травма» Том 10, №2, 2009
Вернуться к номеру
Рентгеноструктурное исследование минерала при пластике костных де-фектов биогенным гидроксилапатитом, легированным селеном
Авторы: В.К. Ивченко, В.И. Лузин, Д.В. Ивченко, А.Н. Скоробогатов - Луганский государственный медицинский университет, Луганск, Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
В эксперименте по данным фазового рентгеноструктурного анализа установлено, что легирование биогенного гидроксилапатитного материала ОК-015 селеном сопровождается активизацией процессов его биологической резорбции. Наиболее предпочтительной является концентрация селена в имплантируемом материале в пределах 0,30-0,50%. Сделано предположение, что присутствие ионов селена в области формирующегося регенерата оптимизирует процессы репаративной регенерации кости.
В експерименті за даними фазового рентгеноструктурного аналізу встановлено, що легування біогенного гідроксилапатитного матеріалу ОК-015 селеном супроводжується активізацією процесів його біологічної резорбції. Найбільш ефективною концентрацією селену в імплантованому матеріалі є концентрація в межах 0,30-0,50%. Зроблено припущення, що присутність іонів селену в ділянці регенерата, що формується, оптимізує процеси репаративної регенерації кістки.
In the experiment we demonstrated that enhancing of conventional hydroxyapatite with selenium results in more active resorption of ceramic implanted. The most preferred concentration ranges within 0,30-0,50%. Basing on the data obtained we assumed that selenium ions optimize regeneration processes.
костный дефект, гидроксилапатит, костный минерал, селен
кістковий дефект, гідроксилапатит, кістковий мінерал, селен
bone defect, hydroxyapatite, bone mineral, selenium
В настоящее время для замещения костных дефектов различного происхождения широко используются материалы на основе гидроксилапатита (ГОА), содержащие в своем составе ионы различных металлов [1, 2]. Достаточно подробно исследовано гистологическое строение регенерата, формирующегося в данных условиях, его тканевой и химический состав, имеются единичные сведения о структуре кристаллической решетки формирующегося минерала [1-4]. Однако фазовый состав минерала, формирующегося при пластике костных дефектов ОК-015, легированного различными металлами, до сих пор не исследовался.
Цель исследования: исследовать фазовый состав костного минерала, который формируется при пластике метадиафизарных дефектов трубчатых костей отечественным материалом на основе биогенного гидроксилапатита «Остеоапатит керамический» - ОК-015, содержащего в своем составе селен в концентрации 0,15, 0,30 и 0,50 объемных процентов.
Работа является фрагментом межкафедральной НИР Луганского государственного медицинского университета “Особенности роста, строения и регенерации трубчатых костей при пластике костных дефектов материалами на основе гидроксилапатита” (государственный регистрационный номер - 0103U006651).
Материал и методы
Исследование проведено на 210 белых крысах-самцах с исходной массой 135-145 г, распределенных на 5 групп. В 1-й группе крысам под эфирным наркозом стандартным стоматологическим бором наносили на границе между проксимальным метафизом и диафизом большеберцовых костей сквозной дырчатый дефект диаметром 2,2 мм. Поскольку передне-задний размер большеберцовой кости в этой области составляет не менее 3 мм, манипуляция не сопровождалась нарушением целостности костного органа и создавались условия для сохранения функциональной нагрузки [5]. Во 2-й группе дефект заполняли блоком соответствующего диаметра из материала ОК-015, а в 3-5-й группах – ОК-015, легированного селеном в концентрациях соответственно 0,15%, 0,3% и 0,5%.
Все манипуляции на животных выполняли в соответствии с правилами европейской конвенции защиты позвоночных животных, использующихся в экспериментальных и других научных целях [6]. По истечении сроков эксперимента (от 7 до 180 дней) выделяли фрагмент кости, соответствующий области нанесенного дефекта, растирали в порошок и исследовали методом рентгеноструктурного анализа по методике внутреннего контроля [7]. Определяли объемное содержание кристаллического фосфата кальция – гидроксилапатита, а также содержание аморфного фосфата кальция (β-трикальцийфосфата либо витлокита) и карбоната кальция (кальцита). Полученные цифровые данные обрабатывали методами вариационной статистики с использованием пакета Statistica 5.11 for Windows.
Результаты и обсуждение
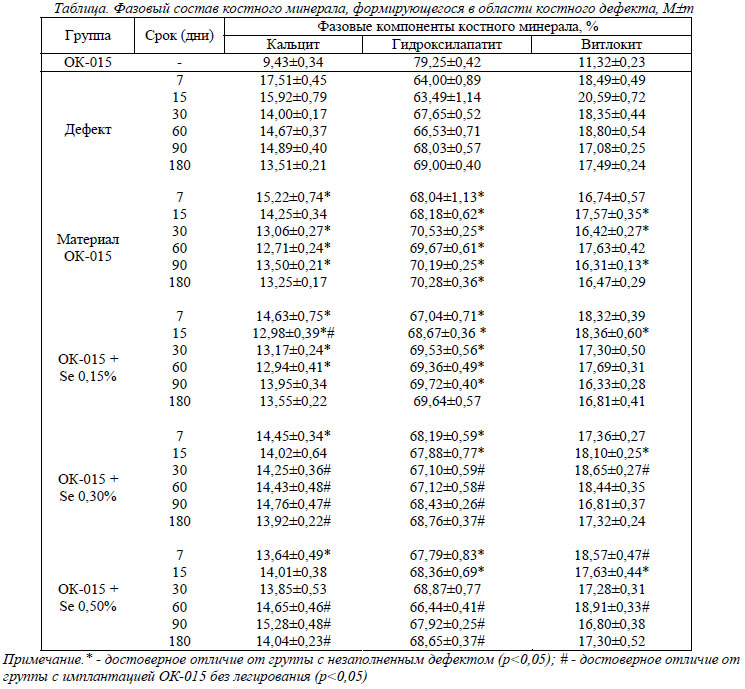
В первую очередь исследованию были подвергнуты образцы материала для имплантации – ОК-015. В его составе значительно преобладал кристаллический фосфат кальция – гидроксилапатит – 79,25±0,42%, аморфный фосфат кальция – витлокит – составлял 11,32±0,23%, а карбонат кальция – кальцит – только 9,43±0,34%.
Динамика изменений фазового состава минерала, формирующегося в области незаполненного дефекта (1-я группа), не отличалась от описанной нами ранее [7-9]: в начальные сроки доля аморфных составляющих (кальцита и витлокита) была наибольшей, а доля кристаллической составляющей – гидроксилапатита – наименьшей. С увеличением срока с момента операции доля аморфных составляющих постепенно уменьшалась, а доля гидроксилапатита – возрастала. К 180 дню фазовый состав костного минерала, соответствующего месту нанесенного дефекта, практически не отличался от фазового состава интактной кости: доля гидроксилапатита составила 69,00±0,40%, витлокита – 17,49±0,24%, а карбоната кальция – 13,51±0.21%. Следует отметить, что костный биоминерал отличается от имплантируемого материала ОК-015 большей степенью аморфности – содержание кристаллической фазы в нем ниже, а аморфных – выше.
Во 2-й группе фазовый состав костного минерала изменялся следующим образом: содержание кристаллической фазы достоверно превосходило показатели группы без имплантации ОК-015 на протяжении всего эксперимента на 6,32%, 7,39%, 4,25%, 4,70%, 3,18% та 1,87% соответственно установленным срокам. Доля аморфного фосфата кальция в составе регенерата была достоверно меньше, чем в 1-й группе, также на протяжении всего эксперимента - 6,32%, 7,39%, 4,25%, 4,70%, 3,18% и 1,87%, а доля кальцита - на 13,08%, 10,08%, 6,73%, 13,35%, 9,30% и 1,94%.
Таким образом, при имплантации в область костного дефекта материала ОК-015, в сравнении с 1-й группой, в фазовом составе регенерата преобладают кристаллические составляющие, а доля аморфных фаз ниже. По мере увеличения сроков эксперимента эти отличия нивелируются. Это объясняется наличием в регенерате постепенно резорбирующихся фрагментов имплантированного материала ОК-015.
Имплантация ОК-015, легированного селеном в различных концентрациях (3-5-ая группы), в сравнении с 1-й группой, сопровождалась изменениями фазового состава биоминерала регенерата, аналогичными по направленности показателям 2-й группы (ОК-015 без легирования селеном). Сравнение полученных результатов со значениями 2-й группы выявило, что в 3-й группе (ОК-015, легированный селеном в концентрации 0,15%) фазовый состав биоминерала регенерата практически не претерпевал достоверных отличий. Лишь к 15-му дню доля кальцита была на 8,93% меньше показателей 2-й группы (р<0,05). В остальных подопытных группах (4-я и 5-я) динамика фазового состава биоминерала регенерата была иной. При легировании имплантата селеном в концентрации 0,30% достоверные отличия от показателей 2-й группы наблюдались с 30-го дня эксперимента. Удельное содержание кристаллической фазы в регенерате было меньше контрольных значений 2-й группы к 30-му дню на 4,86%, к 60-му дню – на 3,64%, к 90-му дню – на 2,51% и к 180-му дню – на 2,17% (р<0,05 во всех случаях). Доли аморфных фаз в формирующемся регенерате, напротив, возрастали. Содержание кальцита превосходило контрольные показатели 2-й группы в те же сроки соответственно на 9,16%, 13,55%, 9,31% и 5,05% (р<0,05 во всех случаях), а содержание аморфного фосфата кальция – на 13,58% (р<0,05), 4,60%, 3,09% и 5,19%.
При использовании имплантата, легированного селеном в более высокой концентрации – 0,50%, достоверные отличия от показателей 2-й группы выявлялись несколько позже – с 60-го дня эксперимента. Содержание кристаллического фосфата кальция в регенерате в период с 60-го по 180-й день наблюдения было меньше показателей 2-й группы соответственно на 4,62%, 3,23% и 2,32% (р<0,05 во всех случаях). В то же время содержание аморфных фаз в регенерате превосходило контрольные показатели: кальцита соответственно на 15,25%, 13,18% и 5,99% (р<0,05 во всех случаях), а витлокита – на 7,24% (р<0,05), 3,00% и 5,07%.
Поскольку в период с 30-го дня эксперимента достоверные отличия показателей 4-5-й групп от значений 1-й группы (без имплантации) не наблюдались, полученные результаты можно объяснить тем, что присутствие в имплантате селена в концентрации 0,30% и 0,50% сопровождается более активными процессами биорезорбции материала ОК-015.
Выводы
В результате проведенных исследований установлено, что костный биоминерал отличается от биогенного гидроксилапатитного материала ОК-015 большей степенью аморфности: содержание кристаллической фазы в нем ниже, а аморфных – выше. В биологическом минерале регенерата, формирующегося в области незаполненного костного дефекта, в начальные сроки эксперимента доли аморфных составляющих (кальцита и витлокита) были наибольшими, а доля кристаллического фосфата кальция – гидроксилапатита – наименьшей. С увеличением срока с момента нанесения дефекта доля аморфных составляющих постепенно уменьшалась, а доля гидроксилапатита – возрастала. К 180-му дню фазовый состав костного минерала, соответствующего месту нанесенного дефекта, практически не отличался от фазового состава минерала интактной кости.
При имплантации в область костного дефекта материала ОК-015 без легирования в фазовом составе регенерата, в сравнении с группой без имплантации, преобладали кристаллические составляющие, а доля аморфных фаз была ниже. По мере увеличения сроков эксперимента эти отличия постепенно нивелировались. По-видимому, это объясняется наличием в регенерате постепенно резорбирующихся фрагментов имплантированного материала ОК-015, признаки присутствия которых определяются и через 180 дней после начала эксперимента.
Фазовый состав регенерата, формирующегося при имплантации в область дефекта материала ОК-015, легированного селеном в различных концентрациях, в ранние сроки эксперимента практически не отличался от фазового состава регенерата при имплантации ОК-015 без легирования. В дальнейшем, в случае имплантации ОК-015, легированного селеном в концентрации 0,15%, достоверные отличия от показателей группы с имплантацией ОК-015 также не определялись. С увеличением концентрации селена в имплантате было выявлено снижение содержания кристаллической фазы в регенерате в сравнении с группой без легирования и увеличение содержания аморфных составляющих. В группе с имплантацией ОК-015, легированного селеном в концентрации 0,30%, эти изменения определялись с 30-го дня эксперимента, а при концентрации селена 0,50% - с 60-го дня.
Выявленные изменения следует рассматривать как ускорение процессов биорезорбции имплантированного материала ОК-015 и формирования регенерата в присутствии ионов селена. Наиболее предпочтительной является концентрация селена в имплантируемом материале в пределах 0,30-0,50%.
Перспективы дальнейших исследований: для подтверждения выявленных закономерностей будет проведено исследование гистологического строения и ультраструктуры регенерата, формирующегося при пластике костных дефектов биогенным гидроксилапатитом, легированным селеном.
- Ивченко В.К., Лузин В.И., Ивченко Д.В., Скоробогатов А.Н., Панкратьев А.А. Особенности химического состава регенерата, формирующегося при пластике костных дефектов материалами на основе гидроксиапатита с различным содержанием марганца // «Новое в травматологии и ортопедии». Материалы Всеукраинской научно-практической конференции молодых ученых, посвященной 50-летию НИИ травматологии и ортопедии Донецкого государственного медицинского университета им. М.Горького. – Донецк, 2006. – С. 25-26.
- Лузин В.И., Ивченко В.К., Ивченко Д.В., Скоробогатов А.Н., Лубенец А.А. Особенности продольного роста длинных тубчатых костей при имплантации в метадиафизарную зону «Остеоапатита керамического – 015» с различным содержанием марганца // Український морфологічний альманах. – 2006. - Том 4, №2. – С. 108-111.
- Luzin V.I., Ivchenko V.K., Ivchenko A.V., Skorobogatov A.N., Pankratyev A.A. Cechy związkуw chemicznych regeneratu ubytkуw przynasad wypełnionych materiałem opartym na hydroksyapatycie // Ortopedia, Traumatologia, Rehabilitacja. - 2005. - Vol. 7 (Suppl. 1). - P69.
- Лузин В.И., Ивченко В.К., Ивченко Д.В., Скоробогатов А.Н., Лубенец А.А. Прочность плечевой кости при имплантации в большеберцовую кость гидроксиапатитного материала ОК-015 // Травма. 2007. – Том 8, №4. – С. 387-389.
- Лузин В.И., Ивченко Д.В., Панкратьев А.А., Скоробогатов А.Н., Самойленко А.А. Методика моделирования костного дефекта у лабораторных животных // Український медичний альманах. – 2005. – Том 8, №2 (додаток). – С. 162.
- European convention for the protection of vertebrate animals used for experimental and other scientific purpose: Council of Europe 18.03.1986. - Strasbourg, 1986. - 52 p.
- Лузин В.И. Применение рентгеноструктурного анализа для исследования фазового состава костного минерала // Український морфологічний альманах. – 2005. - Том 3, №4. – С. 61-64.
- Маврич В.В. Фазовый состав различных зон поясничных позвонков по данным рентгеноструктурного анализа // Український морфологічний альманах. – 2004. – Том 2, №1 (додаток). – С.51-53.
- Лузин В.И., Бережной Е.П., Кучеренко С.Л., Глущенко Р.В. Сравнительное исследование ультраструктуры костного и керамического гидроксиапатита методом рентгеноструктурного анализа // Таврический медико-биологический вестник. – 2006. – Том 9, №3. – С. 105-108.