Журнал «Травма» Том 10, №2, 2009
Вернуться к номеру
Опыт хирургического лечения и анестезиологического обеспечения ново-образований задней черепной ямки у детей младшего школьного возраста
Авторы: В.И.Черний, А.М.Кардаш, А.Н.Колесников, В.А.Гюлямерьянц, Т.А.Мустафин, С.Н.Кузнецов, О.А.Гайдаренко, О.С.Антропова - Донецкий национальный медицинский университет им.М.Горького, Донецкое областное клиническое территориальное медицинское объединение, Донецк, Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
У детей среди патологических процессов опухолевой природы новообразования головного мозга являются самыми распространенными после онкогема-тологических заболеваний. В статье представлен опыт хирургического лечения и анестезиологического обес-печения новообразований задней черепной ямки у детей младшего школьного возраста.
У дітей серед патологічних процесів пухлинної природи новотвори головного мозку є найпоширенішими після он-когематологічних захворювань. У статті представлений досвід хірургічного лікування й анестезіологічного забез-печення новотворів задньої черепної ямки в дітей молодшого шкільного віку.
This paper is dedicated to experience of surgery and anestesiological support for treatment of tumors of posterior skull fossa at children.
опухоли задней черепной ямки, хирургическое лечение, анестезиологическое обеспечение
пухлини задньої черепної ямки, хірургічне лікування, анестезіологічне забезпечення
tumors of posterior skull fossa, surgery, anestesiological support
У детей среди патологических процессов опухолевой природы новообразования головного мозга являются самыми распространенными после онкогематологических заболеваний. К сожалению, распространенность данного заболевания очень высока и составляет 3-5 случаев заболевания на 100 тыс. При этом в детском возрасте в 2/3 случаев речь идет об новообразованиях задней черепной ямки (НЗЧЯ) [1]. Особенностью локализации НЗЧЯ у детей является преимущественное расположение их по средней линии (мозговой ствол, червь мозжечка, IV желудочек). По своей гистологической природе новообразования субтенториальной локализации очень разнообразны, но у пациентов детского возраста есть определенные особенности. Чаще всего встречаются астроцитомы (60%) и медуллобластомы (30%). Остальные 10% приходятся на эпендимомы, олигодендроглиомы, ангиоретикулемы, хориоидпапилломы, дермоидные опухоли и др.[2]. Учитывая близкое расположение опухолей ЗЧЯ к жизненно важным образованиям ствола, техника хирургического вмешательства и анестезиологического обеспечения требует дальнейшего усовершенствования. Увеличение объёма вмешательств при данной патологии было бы невозможно без соответствующего развития анестезиологии и интенсивной терапии с углубленным изучением клинико-физиологических особенностей операций на головном и спинном мозге [3].
Головной мозг в условиях многокомпонентного анестезиологического обеспечения функционирует как орган, формирующий состояние наркоза для самого себя [4]. При прямом воздействии он генерирует эфферентную информацию в виде рефлексов и обеспечивает коррекцию отклонений функциональных параметров, вызываемых этими рефлексами [5].
Перечисленные особенности операции на головном мозге заставляют искать пути оптимизации периоперационой защиты как пациентов, так и собственно ЦНС от хирургической агрессии, обусловливая актуальность проблемы [6].
Цель исследования: повышение качества хирургического лечения НЗЧЯ у детей путем разработки новых подходов к анестезиологической защите и интенсивной терапии.
Материал и методы
Исследование проводилось во II нейрохирургическом отделении Донецкого областного клинического территориального медицинского объединения (ДОКТМО). Обследовано 20 детей (возраст от 7 лет до 15 лет) с НЗЧЯ в период с 2003 по 2008 года.
Программа исследования включала в себя:
1) стандартный интраоперационный мониторинг: ЭКГ мониторинг в 3 отведениях, пульсоксиметрию, неинвазивное измерение АД (мм рт.ст.), капнометию с помощью монитора РМ-7000;
2) изучение параметров центральной гемодинамики (ЦГД) на до-, интра- и послеоперационном этапах - среднее артериальное давление (САД, мм рт. ст.), ударный объём сердца (УОС, мл), минутный объём сердца (МОС, л/мин), общее периферическое сопротивление (ОПСС, дин´с´см-5) - расчетным методом по следующим формулам:
САД = АДдиаст + ПД*0,427, где ПД – пульсовое давление по формуле Вецлера и Богера [7];
ударный объем сердца по формуле J.Starr: УОС= 90,97 + 0,54 * ПД - 0,57 * АДдиаст - 0,61 * В, где В – возраст в годах [7];
МОС = УОС * ЧСС/ 1000 [7];
ОПСС = САД * 1333 * 60/ МОС [7];
изучали параметры мозговой гемодинамики в до- и интраоперационном периоде; определялось перфузионное давление мозга (ПДМ), как разница между средним артериальным и внутричерепным давлениями (ВЧД): ПДМ = САД – ВЧД; измерение ВЧД производилось путем люмбальной пункции (при отсутствии противопоказаний) и при проведении вентрикулостомии.
Детей младшего школьного возраста мы старались оперировать в положении сидя. Мы считаем, что проведение операций у детей на задней черепной ямке предпочтительно осуществлять в положении пациента сидя, начиная с 6-7-летнего возраста, невзирая на возможные осложнения в виде высокого риска пастуральных реакций и газовой эмболии. В данном положении значительно облегчается доступ к анатомическим структурам кранио-вертебрального перехода, уменьшается венозное кровотечение, создается хороший обзор операционной раны и удобное положение рук хирурга и ассистента. Это особенно важно при манипуляциях в области IV желудочка. А также, что немаловажно, продолжительность операции сокращается на 20-30 % [4, 12, 13]. При опухолях IV желудочка и червя мозжечка нами применялась срединная субокципитальная, краниоцервикальная краниотомия с предварительной пункцией заднего рога бокового желудочка в точке Денди. У детей раннего и дошкольного возраста, у которых мышечно-апоневротический шейно-затылочный пласт тонок и затылочная кость стоит более вертикально, срединный разрез позволяет более полно рассмотреть оба полушария мозжечка и другие отделы задней черепной ямки. Разрез мягких тканей начинался на 4 см выше наружного затылочного бугра и доходил вниз до остистого отростка VI шейного позвонка. Во всех случаях выполнялась резекция дуги атланта. Резекцию дуги С2 позвонка мы не проводили. Твердую мозговую оболочку вскрывали Y-образно. При опухолях полушарий мозжечка мы проводили парамедианную субокципитальную краниотомию также с предварительной вентрикулостомией [12, 13]. Следует подчеркнуть, что всем пациентам с опухолями задней черепной ямки проводилась вентрикулостомия даже при отсутствии признаков окклюзионной гидроцефалии, что позволяло нам контролировать уровень внутричерепного давления. Во всех случаях после удаления опухоли твердая мозговая оболочка ушивалась наглухо с дополнительной герметизацией «Тахокомбом». Использование микрохирургической техники позволяло повысить радикальность вмешательств, выполняемых в узкой глубокой операционной ране, где угол операционной атаки весьма ограничен .
Основной проблемой у данного контингента является нестабильная гемодинамика вследствие неадекватного лечения на догоспитальном этапе (основанном на введении глюкокортикостероидов и фуросемида). Поэтому был разработан протокол предоперационной подготовки, включающий метод коррекции повышенного внутричерепного давления. Нами разработан и применяется метод комплексной терапии отека головного мозга с использованием нового отечественного противоотечного и эндотелиопротекторного препарата L-лизина эсцината, реосорбилакта и сорбилакта. На данный метод получен патент Украины на полезную модель № 36539 «Способ корекции повышенного внутричерепного давления» [8]. Метод осуществляется путем проведения фармакотерапии, которая отличается тем, что фармакотерапия проводится путем комплексного последовательного внутривенного капельного введения раствора L-лизина есцината 0,15-0,2 мг/кг на 50,0-200,0 мл 0,9% раствора NaCL 2 раза в сутки, после каждого введения L-лизина есцината через 10-15 минут внутривенно капельнно вводят препарат сорбитола (реосорбилакт или сорбилакт) курсовым или разовым введением. При этом для детского контингента вводят внутривено капельно раствор L-лизина есцината 0,15-0,2 мг/кг на 50,0-100,0 мл 0,9% раствора NaCL 2 раза в сутки, потом после каждого введения L-лизина через 10-15 минут внутривено капельно вводят реосорбилакт в дозе 3-10 мл/кг [11].
Данную терапию начинали за 2 суток до операции, непосредственно перед операцией на ночь назначали 10% альбумин в дозе 2 мл/кг внутривенно капельно.
Анестезиологическое обеспечение данных операций представляет собой предмет отдельного исследования. Из неингаляционных анестетиков барбитураты, этомидат, пропофол, являясь вазоконстрикторами, уменьшают мозговой кровоток (МК) и сохраняют сопряжение между метаболизмом мозга и МК, не нарушают его ауто- и химическую регуляцию. Бензодиазепины снижают МК и метаболические потребности мозга, но в меньшей степени, чем барбитураты. Опиаты не оказывают значительного влияния на метаболизм мозга и МК. Влияние анестетика на мозговой кровоток – это ключевой момент в нейроанестезиологии. При увеличении МК возрастает внутричерепной объем крови и как следствие повышается ВЧД. Анестетики, расширяющие сосуды головного мозга (церебральные вазодилататоры), увеличивают ВЧД. Анестетики, сужающие сосуды головного мозга (церебральные вазоконстрикторы), уменьшают ВЧД. Неингаляционные анестетики уменьшают ВЧД. Однако барбитураты, являясь прекрасным средством для индукции и анестезии, не годятся для поддержания, потому что значительно (на многие часы) замедляют пробуждение, то же самое, хотя и в меньшей степени, относится и к бензодиазепинам (особенно к диазепаму) [10].
Среди препаратов, обладающих стресс-лимитирующей активностью, нас заинтересовал натрия оксибутират. К основным центральным стресс-лимитирующим системам относятся ГАМК-эргическая система (продуцирующая гамма-аминомасляную кислоту (ГАМК), обладающую тормозным действием на нейроны головного и спинного мозга) и опиоидергическая система (объединяющая нейроны в гипоталамусе и секреторные клетки в гипофизе, продуцирующие опиоидные пептиды (ОП)). При активации стресс-системы выделившиеся гормоны стимулируют секрецию ГАМК и ОП, которые ограничивают, но не угнетают активность стресс-системы в целом. Как известно, оксибутират натрия получен синтетически согласно структурной аналогии ГАМК. Мы считаем, что применение оксибутирата натрия в чистом виде нецелесообразно у детей с нейрохирургической патологией, его необходимо применять с препаратами, обладающими выраженной противосудорожной активностью и снижающими ВЧД [10].
В последнее время возобновился интерес к кетамину как к препарату с возможностью использования в нейрохирургии. Принятой точкой зрения является отказ от применения кетамина в связи с его возможностью повышать ВЧД в дозировках 2 мг/кг, однако использование субнаркотических дозировок 0,2-0,25 мг/кг у детей с выраженными явлениями ликворной гипертензии и высоким ВЧД не вызывало клиники усиления ликворной гипертензии. Данный эффект можно объяснить тем, что стимулирующее влияние кетамина на симпатоадреналовую систему благотворно действует на системную гемодинамику и способствует стабилизации перфузионного давления головного мозга, что компенсирует отрицательное воздействие на мозговой кровоток. Кроме того, данный эффект может быть связан с его способностью блокировать NMDA-рецепторы. Во время ишемии выделяется глутамат и стимулирует NMDA-рецепторы, которые определяют поступление кальция в клетку через связанные каналы. Значительное повышение кальция в клетке ведет, в конечном счете, к ее гибели, если процесс не прерывается. Препарат обладает определенным нейропротекторным действием за счет блокады NMDA-рецепторов и уменьшение поступление Са в цитозоль нейронов [10].
По современным разработкам блокада NMDA-рецепторов относится к нейропротекторной терапии, поскольку они отвечают за запуск гиперпродукции оксида азота (NO) – путем активации нейрональной NO-синтазы. Предполагается, что оксид азота в высоких концентрациях может воздействовать на малые энкефалинергические интернейроны, которые блокируют вход ноцицептивной информации («контроль входных ворот»). В связи с этим интенсивная патологическая стимуляция не контролируется нейронами заднего рога. Перспективным антагонистом NMDA рецепторов со свойствами нейропротектора является кетамин. Кетамин и его метаболит норкетамин обладают способностью неконкурентно блокировать NMDA рецепторы коры головного мозга, дозозависимо блокировать синтез и секрецию фактора некроза опухоли (ФНО) и индуцированную ФНО лейкоцит-эндотелиальную адгезию, предотвращая, таким образом, вторичное поражение ЦНС при черепно-мозговой травме и геморрагическом инсульте. Можно сказать, что на современном этапе, кетамин получил вторую жизнь для применения в клинике нейрохирургии.
Синтез новейших представителей ряда ненаркотических аналгетиков существенно дополнил арсенал средств, с успехом применяемых в клинической практике. Одним из таких препаратов является и буторфанола-тартрат (стадол), который был предложен к применению в клинике еще в 1978 году. Особое внимание специалистов было привлечено к нему вследствие имеющихся агонист-антагонистических по отношению к опиоидным рецепторам свойств, а также выраженная аналгетическая активность в эквимолярном сравнении, превышающая эффект действия морфина в 5 раз, пентазоцина в 20 раз, а меперидина в 40 раз. На основании имеющихся литературных данных об исключительных аналгетических свойствах препарата нами было начато изучение возможности применения стадола в клинической анестезиологии на детском контингенте нейрохирургических больных. Пропофол характеризуется быстрым началом анестезии, короткой продолжительностью и быстрым пробуждением после прекращения введения. Пропофол снижает МК прямо пропорционально дозе препарата. При инфузии со скоростью 3,6 и 12 мг/кг/ч МК снижался на 7,28 и 39% соответственно. При повышении дозы до 12 мг/кг/ч, помимо снижения МК, уменьшается потребление кислорода на 22%, а интенсивность метаболизма глюкозы – на 36%. Ауторегуляция МК в ответ на изменение АД не нарушается. При изучении действия препарата на систему спинномозговой жидкости (СМЖ) было выявлено, что он не влияет на формирование и реабсорбцию СМЖ. Большой интерес вызвало сообщение о том, что у мышей, подвергнутых гипоксии, при выходе из наркоза пропофолом повышалась выживаемость. Однако мы считаем, что рекомендуемые дозы пропофола значительно завышены и не могут использоваться у детского контингента в связи с опасностью развития деприванового синдрома с резким нарушением ПДМ.
Исходя из приведенных выше данных, нами был разработан метод тотальной внутривенной анестезии с ИВЛ – стресс-лимитирующая анестезия (СЛА), патент Украины № № 12775 от 15.02.2006 [9], направленная на стимуляцию стрессовых систем организма.
Способ СЛА заключается в том, что премедикацию осуществляли атропином 0,1%-0,01 мг/кг, дипразином 2,5% - 1,5 мг/кг и кетамином 5%- 0,1-0,2 мг/кг в/м. У всех детей премедикация проводилась в палате за 20-30 минут до операции во избежание стресса, возникающего в момент разлучения ребенка с матерью. Затем начинали внутривенное введение L-лизина эсцината 0,15-0,2 мг/кг на 50,0-100,0 мл 0,9% NaCL. Вводную анестезию осуществляли путем внутривенного введения бутарфанола тартрата (стадола) в дозе 0,15 мг/кг (необходима экспозиция в течение не менее 10 минут для достижения максимального эффекта стадола), затем внутривенно вводили натрия оксибутират 20% - 100 мг/кг совместно с пропофолом 3,5-4 мг/кг. Всем пациентам проводилась преоксигенация в течение 5-7 минут при FiO2 100%, миорелаксация достигалась введением векурония бромида (0,08-0,1 мг/кг). Базисная анестезия включала пропофол 1-1,5 мг/кг/час, кетамин 1-2 мг/кг/час и бутарфанола тартрат (стадол) в дозе 0,05-0,1 мг/кг/ч инфузоматом. С интервалом в 50-60 минут вводят натрия оксибутират в дозе 100 мг/кг. Для поддержания газообмена дыхательный объем установили на уровне 8-10мл/кг, FiO2 50-75%. По окончании операции все пациенты переводились в отделение нейрореанимации для полного пробуждения.
Результаты и обсуждение
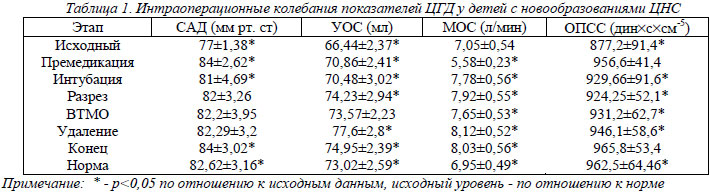
Оценивая показатели центральной и мозговой гемодинамики при поступлении, можно сказать, что (табл.1) у детей с НЗЧЯ отмечалось достоверное (р<0,05 по сравнению с показателями контрольной группы) исходное снижение уровней САД (77±1,38 мм рт. ст.) и УОС (66,44±2,37 мл). Исходно низкий уровень ударного объема сердца, на наш взгляд, свидетельствовал не только о наличии синдрома ВЧГ, но и о дефиците объема циркулирующей жидкости (ОЦК) вследствие неадекватного доклинического лечения мочегонными. Снижение уровня ОПСС (877,2±91,4 дин´с´см-5) и недостоверное повышение МОС (7,05±0,54 л/мин) (табл.1) является вариантом декомпенсации. Эти данные могут объясняться выраженными явлениями гистотоксической энцефалопатии как в результате токсического воздействия опухолевого процесса, так и механического сдавления структур мозга (в частности механического воздействия на сосудодвигательный центр).
При оценке параметров мозговой гемодинамики имело место статистически достоверное повышение уровня показателей ВЧД (62±8,72 мм рт. ст.), что, наш взгляд, обусловлено: во-первых, объемным процессом в полости черепа; во-вторых, явлениями токсической дисциркуляторной энцефалопатии и, как следствие, нарушением баланса ликворообразования и ликворосорбции, а также нарушением ауторегуляции мозгового кровотока. Декомпесацию адаптационных механизмов, по нашему мнению, отображает выявленные расстройства ЦГД (снижение уровня САД). Этот момент свидетельствует о хронической чрезмерной стрессовой реакции. Вследствие этого мы получили очень низкий уровень ПДМ (16,35±3,47 мм рт. ст.) . Эти явления могут сопровождаться непредсказуемой реакцией со стороны ЦГД и МГД на предстоящую операцию/анестезию.
Таким образом, можно сделать предварительный вывод о том, что у детей с новообразованиями ЦНС имеет место гипокинетический тип центральной гемодинамики – повышение ВЧД. Поэтому для подготовки таких детей к оперативному пособию был разработан протокол предоперационной подготовки. Вследствие вышеуказанных особенностей необходимо быть готовым к неадекватным реакциям со стороны сердечно-сосудистой системы на интраоперационную кровопотерю, в связи с чем необходим запас препаратов крови и кровезаменителей.
Учитывая положение ребенка сидя во время операции, необходима следующая тактика анестезиологического обеспечения, направленная на профилактику интраоперационных осложнений в виде опасности газовой эмболии и постуральных реакций сосудов: в операционной катетеризируются 2 перефирических вены и в течение 25-40 минут в зависимости от параметров ЦГД производится инфузия 50-100 мл 0,9% раствора NaCL с последующим переходом на реосорбилакт (7-10 мл/кг) и гелофузин (10-15 мл/кг) до стабилизациии параметров сердечно-сосудистой системы. Затем осуществляется вводная анестезия, интубация трахеи, перевод в сидячее положение под контролем АД, ЧСС, РСО2.
В результате применения разработанных методов анестезиологического обеспечения и периоперационной терапии было достигнута стабилизация параметров ЦГД в интра- и послеоперационном периодах. Так, у детей с НЗЧЯ, прооперированных в условиях СЛА с разработанным комплексом периоперационной терапии, отмечена стабильность параметров центральной гемодинамики во время операции (р<0,05 по сравнению с исходными значениями) и в конце операции они стабилизируются практически на уровне нормодинамии (р<0,05 по сравнению с исходными значениями и достоверно не отличалось от показателей группы контроля) (САД 84±3,02 мм рт. ст., УОС 74,95±2,39 мл, ОПСС 965,8±53,4 дин´с´см-5) (табл.1).
Данные изменения мы объясняли, во-первых, восполнением объема циркулирующей крови, а во-вторых, снижением уровня интоксикации организма, что также свидетельствовало о правильно выбранной тактике периоперационной интенсивной терапии и метода анестезии. Эти выводы подтвержадются колебаниями мозговой гемодинамики. Из таблицы видно, что имеет место значительное снижение уровня ВЧД (20±4,2 мм рт. ст.) (табл.2), которое устанавливается практически на уровне возрастной нормы. Эта реакция возможна за счет удаления дополнительного объема в виде новообразования. Стабилизация САД на уровне возрастной нормы, по нашему мнению, результат компенсации, то есть вследствие перехода хронического стресса в острый стрессовый ответ произошла стимуляция стрессовых систем организма. Стабилизация ПДМ практически на уровне возрастной нормы (64,7±7,29 мм рт. ст.) является результатом колебаний ВЧД и САД и свидетельствует об адекватной перфузии ткани мозга. Это также говорит об адекватной тактике периоперационной интенсивной терапии и анестезиологического пособия.
Весьма распространенной проблемой в интра- и раннем послеоперационном периоде является то, что нейрохирургические манипуляции происходят в непосредственной близости от ствола мозга (а зачастую и на нем), которая связана с ишемией последнего. Наиболее ранним симпотомокомплексом ишемии ствола мозга являются эпизоды брадикардии.
Но в процессе работы были выявлены очень кратковременные фрагменты тахикардии (начало ишемии ствола по нашему мнению), для коррекции данного состояния мы применяли внутривенные струйные инъекции тиоцетама 0,3-0,5 мг/кг и нейромедина 0,5% в дозе 0,2-0,3 мг/кг для улучшения трофики стволовых структур.
По нашему мнению, благоприятный исход у обследуемых детей с НЗЧЯ с полным восстановлением сознания, ранним восстановлением самостоятельного дыхания происходило за счет: достижения адекватных показателей центральной и мозговой гемодинамики вследствие соответствующей периоперационной интенсивной терапии и анестезиологического обеспечения; аккуратной нейрохирургической техники; выявленного момента возможно начальной ишемии ствола мозга с адекватным методом фармокологической коррекции.
Выводы
Не взирая на возраст, вес, а также возможные интраоперационные осложнения, положение пациента сидя при операциях на ЗЧЯ является предпочтительным. Исключением из этого может быть крайняя тяжесть состояния ребенка, стадия декомпенсации опухолевого процесса.
В качестве возможного избежания описанных проблем при операциях у детей с НЗЧЯ в положении сидя может применяться способы СЛА и комплекса периоперационной терапии, основанной на способе коррекции повышенного ВЧД.
- Зозуля Ю.А., Розуменко В.Д., Лисяный Н.И. Проблемы современной нейроонкологии. Журн АМН України 1999; 5 (3): 426–41.
- Орлов Ю. А. Эпидемиология и результаты лечения опухолей головного мозга у детей (обзор литературы). Укр ней-рохірург журнал 2000; 2: 5–14.
- Ромоданов А П., Зозуля Ю. А., Мосийчук Н. М., Чушкан Г. С. Атлас операций на головном мозге - Медицина, 1986 г.
- Кондратьев А.Н., Ивченко И.М. Анестезия и интенсивная терапия травмы ЦНС. – Спб: Санкт-Петербургское медицинское издательство, 2002.- 128 с.
- Земская А.Г., Кривошеина Ю.П. Краниофарингомы у детей// Вопросы детской нейрохирургии. – Л.: Медицина, 1985. – С. 5– 9.
- Черний В.И., Колесников А.Н., Себаи Слим, Мустафин Т.А., Антропова О.А., Ермилов Г.И. Особенности патогенеза и клинической диагностики новообразований центральной нервной системы у детей. Проблемы и перспективы анестезиологического обеспечения// Біль, знеболювання і інтенсивна терапія. - 2007.- №1.-С.7-21.
- Антонов А.А. Гемодинамика для клинициста/ [Электронный ресурс]: www.symona.ru-2004.– С.99.
- Черний В.И., Колесников А.Н., Городник Г.А., Мустафин Т.А., Колесникова В.В., Колесникова А.Г. Способ коррекции повышенного внутричерепного давления /Декларационный патент Украины на полезную модель № 36539 от 27.10.2008, бюллетень № 20.
- Черний В.И., Колесников А.Н., Смирнова Н.Н. и др. Способ стресс-лимитирующей анестезии / Декларационный патент Украины на изобретение № 12775 от 15.02.2006, бюллетень ВАК №2.
- Черний В.И., Ельский В.Н., Городник Г.А., Колесников А.Н. Острая церебральная недостаточность.- Донецк: ООО «ИПП»Промінь», 2007.
- Черний В.И., Городник Г.А., Колесников А.Н., Кардаш А.М. и др. Принципы и методы диагностики и интенсивной терапии внутричерепной гипертензии (методические рекомендации).- Киев, 2008.
- Bristot R. Malignant cerebellar astrocytomas. Pediatr Neurosurg 1999; 27: 280–5.
- Pollack I. F. Brain tumors in children. New Eng J Med 1994; 331 (22): 1500–7.