Журнал «Здоровье ребенка» 2 (29) 2011
Вернуться к номеру
Антиоксидантний захист недоношених новонароджених у разі гіпоксично-ішемічного ураження центральної нервової системи
Авторы: Маркевич В.Е., Тарасова І.В., Петрашенко В.О. Кафедра педіатрії з курсом медичної генетики медичного інституту Сумського державного університету
Рубрики: Педиатрия/Неонатология
Версия для печати
Стаття присвячена дослідженню антиоксидантної системи у недоношених новонароджених на фоні гіпоксичного ураження ЦНС. Напруженість системи антиоксидантного захисту оцінювали за показниками концентрації міді та церулоплазміну у крові. Встановлено, що перинатальна гіпоксія призводить до значного виснаження міді та церулоплазміну як антиоксидантів, що потребує розробки принципів корекції.
Гіпоксія, недоношені діти, мідь, церулоплазмін.
Вступ
Найбільшою проблемою в неонатології є гіпоксичні ушкодження головного мозку. Особливо велике значення має гіпоксичне ураження недоношених новонароджених, у яких воно в 10–15 разів частіше стає причиною загибелі дітей [1]. Гіпоксія плода спричиняє порушення мітохондріального окислювального фосфорилювання [2]. При цьому відбувається активація анаеробного метаболізму глюкози, зниження продукції макроергів, порушення активності АТФази та деполяризація пресинаптичних мембран [3]. Такі процеси призводять до підвищення внутрішньоклітинної концентрації кальцію, що, у свою чергу, запускає безліч біохімічних каскадів, у тому числі протеази, фосфоліпази, ендонуклеази, що викликають апоптоз клітини. Крім того, іони кальцію спричиняють утворення вільних радикалів та активують перекисне окислення ліпідів (ПОЛ) [4].
ПОЛ на фоні гіпоксії викликає активацію антиоксидантної системи організму, до складу якої входить і мідьумісна оксидаза церулоплазмін (ЦП). Церулоплазмін належить до білків, що містять катіони міді змінної валентності. Він включає 90–95 % іонів міді сироватки крові та є одним з основних антиоксидантів плазми [5]. Антирадикальні властивості ЦП пояснюються його здатністю зв’язувати катіони металів та супероксидні радикали, інгібувати активні кисневі метаболіти, попереджувати окислення ліпідів [6].
Участь міді та церулоплазміну в антиоксидантному захисті недоношених новонароджених на фоні гіпоксичного ураження центральної нервової системи залишається недослідженою.
Мета роботи — за показниками концентрації міді та церулоплазміну у плазмі крові дослідити стан антиоксидантної системи в недоношених новонароджених на фоні гіпоксично-ішемічного ураження ЦНС.
Матеріали і методи
Матеріалом для дослідження була периферична венозна кров новонароджених, яку брали шляхом венопункції зранку натщесерце. Визначення рівнів міді та церулоплазміну проводилося в сироватці крові 33 недоношених (І група) у разі гіпоксично-ішемічного ураження ЦНС легкого ступеня та у 40 передчасно народжених (ІІ група) на фоні тяжкої гіпоксії. Ступінь тяжкості гіпоксії визначався з урахуванням перебігу вагітності та пологів, стану після народження (оцінки за шкалою Апгар, наявності ознак порушення функцій центральної нервової системи, дихальної, серцево-судинної та сечовидільної систем протягом перших трьох діб життя), лабораторних (показники сечовини та креатиніну в крові, клінічний аналіз сечі, рН крові) та інструментальних (УЗД) даних.
Групу порівняння становили 26 умовно здорових недоношених новонароджених (ЗНН) (ІІІ група).
Для визначення міді в сироватці та еритроцитах застосовували атомно-абсорбційний спектрофотометр С-115М1, оснащений комп’ютерною приставкою для автоматичного обчислення вмісту МЕ, виробництва HBO Selmi (Україна).
Рівень церулоплазміну визначався імунотурбодиметричним методом, в основі якого лежить специфічна турбодиметрична реакція між поліклональною антисироваткою з антитілами до церулоплазміну та антигеном при оптимальній рН, з використанням наборів реактивів фірми «Sentinel CH» (Італія).
Статистична обробка результатів досліджень здійснювалася за допомогою програм Exсel та Statistica 6.0. Використовувалися методи варіаційної статистики, придатні для медико-біологічних досліджень. Визначали середньоарифметичне (М), похибку середньоарифметичного (m). За допомогою критерію Стьюдента (t) визначали показник вірогідності (Р).
Результати та їх обговорення
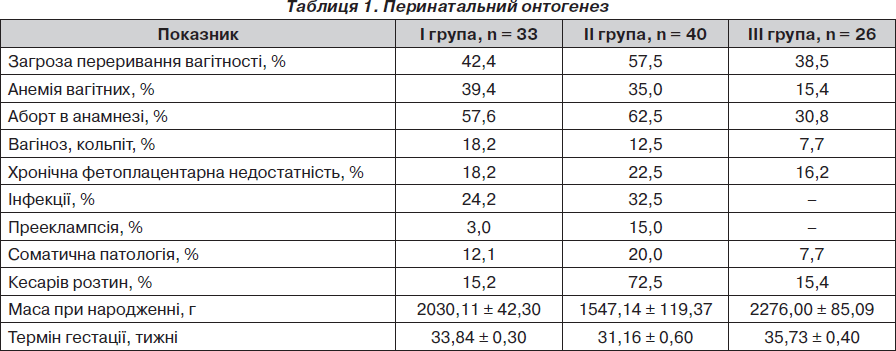
Аналіз перинатального онтогенезу досліджуваних груп наведений у табл. 1.
Серед малюків І групи (18 дівчаток та 15 хлопчиків) недоношені І ступеня становили 60,6 % (20) дітей, недоношені ІІ ступеня — 33,3 % (11) дітей, глибоко недоношені ІІІ–ІV ступеня — 6,1 % (2) новонароджених.
Оцінка ступеня асфіксії після народження за шкалою Апгар показала, що на першій хвилині життя 15 дітей (45,5 %) перебували у стані асфіксії легкого ступеня (6–7 балів за шкалою), 18 дітей (54,5 %) не мали клінічних ознак асфіксії (8–10 балів). На п’ятій хвилині життя всі діти мали оцінку за шкалою Апгар 8–10 балів.
Клінічне обстеження встановило, що 100 % дітей мали перинатальне гіпоксичне ураження ЦНС, що маніфестувало симптомами підвищеної нервово-рефлекторної збудливості у 84,8 % випадків (28 дітей) та симптомами пригнічення у 15,2 % випадків (5 малюків). Кисневу терапію у вигляді вільного потоку кисню отримували 30,3 % дітей (10 малюків), решта 69,7% (23) новонароджених були кисневонезалежними.
За даними нейросонографії (НСГ), 6 дітей (18,2 %) мали перивентрикулярні крововиливи, у такої ж кількості знаходили ознаки незрілості мозку, кісти спостерігалися в 1 недоношеного новонародженого (3 %). У всіх дітей була розрихленість хоріоїдальних сплетінь.
Серед малюків ІІ групи (18 дівчаток та 22 хлопчики) недоношені І ступеня становили 12,5 % (5) дітей, ІІ ступеня — 27,5 % (11) дітей, ІІІ–ІV ступеня — 60,0 % (24) новонароджених. Під час пологів туге обвиття пуповини навколо шиї діагностовано у 15,0 % (6) новонароджених. Визначення ступеня асфіксії за допомогою шкали Апгар показало, що на першій хвилині життя оцінку 0–3 бали отримали 7,5 % (3) дітей, 4–5 балів — 37,5 % (15) новонароджених, 6–7 балів отримали 55,0 % (22) малюків. На п’ятій хвилині життя 10,0 % (4) дітей мали оцінку за шкалою Апгар 4–5 балів, 85,0 % (34) недоношених мали 6–7 балів та 5,0 % (2) малюків були оцінені за шкалою Апгар у 8–10 балів.
Перинатальне гіпоксичне ураження ЦНС тяжкого ступеня мали 100 % дітей цієї групи. Воно проявлялося симптомами пригнічення у 87,5 % випадків (35 малюків) та підвищеної нервово-рефлекторної збудливості у 12,5 % випадків (5 дітей). Кисневу терапію у вигляді вільного потоку кисню отримували 10,0 % дітей (4 малюків), решта 90,0 % (36) новонароджених знаходилися на штучній вентиляції легень. За даними НСГ 9 дітей (22,5 %) мали перивентрикулярні крововиливи, ознаки незрілості мозку спостерігалися у 7 малюків (17,5 %). У всіх дітей знаходили розрихленість хоріоїдальних сплетінь.
ІІІ групу становили 26 умовно здорових недоношених новонароджених (13 хлопчиків та 13 дівчаток). Серед них недоношені І ступеня становили 65,4% (17 дітей), недоношені ІІ ступеня — 34,6 % (9 дітей).
За шкалою Апгар оцінку 6–7 балів на 1-й хвилині життя отримали 15,4 % (4) новонароджених, 8–10 балів — 84,8 % (22) дітей. На 5-й хвилині життя всі малюки були оцінені за шкалою Апгар у 8–10 балів. У пологовому залі всі діти оглянуті неонатологом. Шкірні покриви і видимі слизові були чистими й мали блідо-рожевий колір. Еластичність шкіри, тургор тканин та тонус скелетних м’язів були в задовільному стані. Патологічних відхилень із боку внутрішніх органів не виявлялося. Перкуторно над легенями визначався ясний легеневий звук, аускультативно — пуерильне дихання.
При визначенні рівня церулоплазміну в сироватці крові встановлено, що його рівень в умовно здорових недоношених новонароджених становив 0,298 ± ± 0,020 мг/мл (рис. 1). На фоні гіпоксії легкого ступеня концентрація цього ферменту в сироватці крові знижувалася на 28 % порівняно зі здоровими дітьми (р < 0,01) (рис. 1). Отже, навіть незначне гіпоксичне ураження ЦНС у недоношених новонароджених призводить до напруження антиоксидантної системи організму, що, у свою чергу, знижує адаптаційні можливості передчасно народжених. Перинатальна гіпоксія тяжкого ступеня призводила до виснаження цього антиоксиданту — вміст церулоплазміну зменшувався майже вдвічі порівняно з показником у ЗНН (р < < 0,001). Крім того, його концентрація на фоні тяжкої гіпоксії була на 17 % меншою порівняно з дітьми з легкою гіпоксією (р < 0,05) (рис. 1).
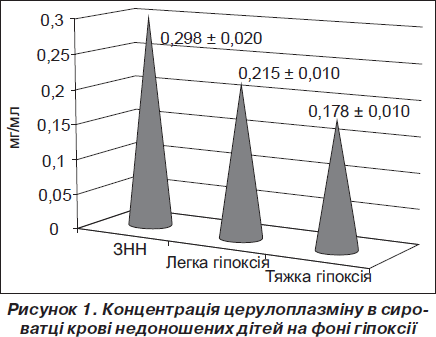
Таким чином, на фоні тяжкої гіпоксії відбувається пригнічення активності одного з основних компонентів антиоксидантної системи плазми крові — церулоплазміну.
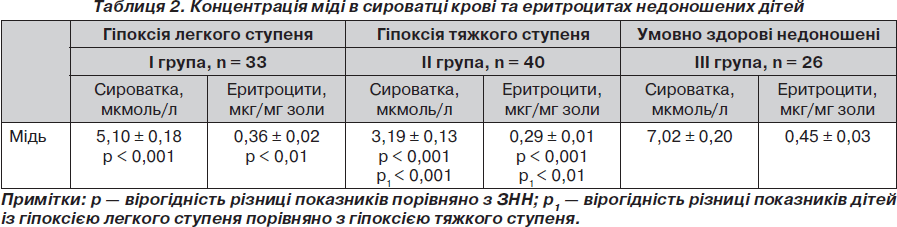
Відомо, що у структурі церулоплазміну міститься 6 іонів міді, 3 з яких формують центри, що беруть участь у процесах передачі електронів, а решта 3 — формують центр, що бере участь у каталітичному циклі супероксиддисмутази, це забезпечує видалення супероксидних радикалів [7].
Так, на фоні гіпоксії в сироватці крові та еритроцитах недоношених новонароджених спостерігалося вірогідне зниження концентрації міді порівняно з ЗНН (табл. 2). У передчасно народжених вміст міді на фоні гіпоксичного ураження легкого ступеня знижувався на 37 % у сироватці крові та на 26 % в еритроцитах. А при тяжкій гіпоксії становив 50 % від показника ЗНН як у сироватці, так і в еритроцитах (табл. 2).
Цікавим є дослідження кореляції між концентрацією церулоплазміну та рівнем міді в сироватці крові, оскільки 90–95 % міді знаходиться в організмі у складі цього ферменту.
Показники парної кореляції вмісту церулоплазміну та міді в сироватці крові наведені в табл. 3.
Дослідження показників парної кореляції рівня церулоплазміну та міді у сироватці крові дозволило встановити, що для недоношених дітей властивим є значний позитивний зв’язок.
Таким чином, гіпоксичне ураження ЦНС призводить до значного виснаження як сироваткового, так і еритроцитарного пулів міді. Активне засвоєння міді організмом новонароджених відбувається за рахунок білків та амінокислот. Абсорбована мідь зв’язується з альбуміном та транскупреїном і транспортується до печінки, де відбувається її включення до складу церулоплазміну. У недоношених новонароджених у разі гіпоксії відбувається ураження гепатоцитів із порушенням білковосинтетичної функції печінки та зниження синтезу альбуміну та транскупреїну. Це призводить до зниження засвоєння міді та метаболізму її у печінці, що проявляється зменшенням синтезу церулоплазміну [5, 6].
Крім того, у випадку гіпоксичного ураження в організмі дитини відбувається активація анаеробного гліколізу зі зниженням продукції АТФ. Порушення синтезу макроергів викликає деполяризацію пресинаптичних мембран та накопичення кальцію всередині клітин. Підвищення рівня іонів кальцію спричиняє утворення вільних радикалів, що активують перекисне окислення ліпідів мембран, викликають тяжкий ацидоз та подальший апоптоз клітин. У здорових малюків церулоплазмін активно зв’язує супероксидні радикали, що вивільняються при фагоцитозі. Крім того, він інгібує лізосомальні ферменти, що виходять із клітин під час їх деструкції. Недостатність синтезу церулоплазміну через незрілість білковосинтетичної функції печінки у недоношених призводить до зниження антирадикальної здатності білків інгібувати активні кисневі метаболіти, попереджувати окислення ліпідів у мембранах. Вільні радикали та продукти ПОЛ, у свою чергу, справляють токсичний вплив на гепатоцити печінки та ще більшою мірою порушують синтетичну функцію печінки, зокрема її можливість щодо синтезу ферментів антиоксидантної системи. Таким чином, формується порочне патогенетичне коло: недостатня білковосинтетична функція печінки у недоношених ® зниження білків антиоксидантної системи ® порушення дезактивації продуктів ПОЛ ® активація протеаз, ліпаз, вільних радикалів ® токсичний вплив на гепатоцити ® ще більше пригнічення синтезу антиоксидантних білків.
Отже, у недоношених новонароджених на фоні гіпоксичного ураження ЦНС відбувається порушення антиоксидантних механізмів захисту, що потребує подальшої розробки корекції цього патологічного стану. Крім того, дискутабельним залишається питання потреби замісної терапії препаратами міді та церулоплазміну у новонароджених у разі гіпоксії.
Висновки
1. Перебіг перинатальної гіпоксії, особливо гіпоксії тяжкого ступеня, призводить до виникнення дефіциту сироваткового і тканинного вмісту міді та пригнічення активності одного з важливих плазмових факторів антиоксидантної системи крові — церулоплазміну.
2. Актуальним є питання розробки методів корекції дефіциту міді та активації синтезу церулоплазміну у недоношених новонароджених у разі гіпоксично-ішемічного ураження ЦНС.
1. Муравская Е.А. Содержание микроэлементов в сыворотке крови у недоношенных новорожденных с поражением ЦНС // Материалы Международной 64-й научной студенческой конференции им. Н.И. Пирогова. — 2005. — С. 5.
2. Никонов В.В., Павленко А.Ю. Метаболическая терапия гипоксических состояний // Медицина неотложных состояний. — № 3–4. — 2009. — С. 22-23.
3. Matthew V. Covey, Steven W. Levison. Pathophysiology of Perinatal Hypoxia — Ishemia and the Prospects for Repair from Endogenous and Exogenous Stem Cells // Neo Reviews. — Vol. 7, № 7. — 2006. — P. 353-362.
4. Ізюмець О.І., Дудник В.М., Іщук І.В., Добіжа М.В., Паненко С.О., Сафонюк Л.В., Лайко Л.І. Терапія новонароджених з гіпоксично-ішемічним пошкодженням ЦНС при застосуванні комплексної терапії з використанням цитиколіну // Перинатологія і педіатрія. — № 1(41). — 2010. — С. 97-99.
5. Sedlak Eric, Gabriel Zoldak, Pernilla Wittung-Stafshede Role of Copper in Thermal Stability of Human Ceruloplasmin // Biophysical Journal. — Vol. 94, Issue 4. — 2008. — P. 1384-1391.
6. Failla M. Trace Elements and Host Defense: Recent Advances and Continuing Challenges // Nutr. — 2003. — Vol. 133. — P. 1443-1447.
7. Нетребенко О.К. Роль меди и селена в питании недоношенных детей // Педиатрия. — 2005. — № 2. — С. 59-64.