Журнал «Здоровье ребенка» 2 (29) 2011
Вернуться к номеру
Опсонирующая сеть протеинов системы неспецифической защиты респираторного тракта 3. Коллектины: белки сурфактанта (часть 2)
Авторы: Абатуров А.Е. Днепропетровская государственная медицинская академия
Рубрики: Педиатрия/Неонатология
Версия для печати
Белки сурфактанта играют определяющую роль в поддержании структурной организации сурфактанта, процессе ремоделирования легких и защите макроорганизма от интервенции инфекционными агентами. Особое значение в ранней противоинфекционной защите респираторного тракта имеют гидрофильные белки сурфактанта SP-A и SP-D. В процессе ответа макроорганизма на внедрение инфекционных агентов SP-А и SP-D играют иммуномодулирующую роль, оказывая как про-, так и противовоспалительное действие.
Противоинфекционное действие белков сурфактанта SP-A и SP-D
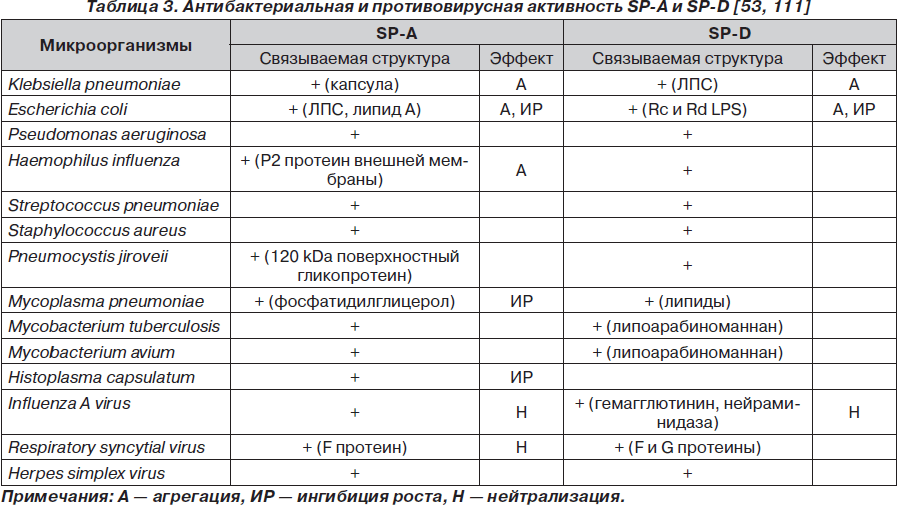
Белки сурфактанта SP-A и SP-D способны связываться с PAMP, которые присутствуют на внешних мембранах бактерий, грибов и капсулах вируса (табл. 3). Основными целевыми молекулярными субстратами SP-A и SP-D являются олиго- и полисахариды, пептидогликан (PepG), липотейхоевая кислота (LTA), содержащие маннозу, глюкозу, гептозу, инозитол или остаткиN-ацетилманнозамина [7, 33, 118]. SP-A преимущественно связывается с L-фукозой, N-ацетилманнозамином, а SP-D — с глюкозой, мальтозой, инозитолом [49].
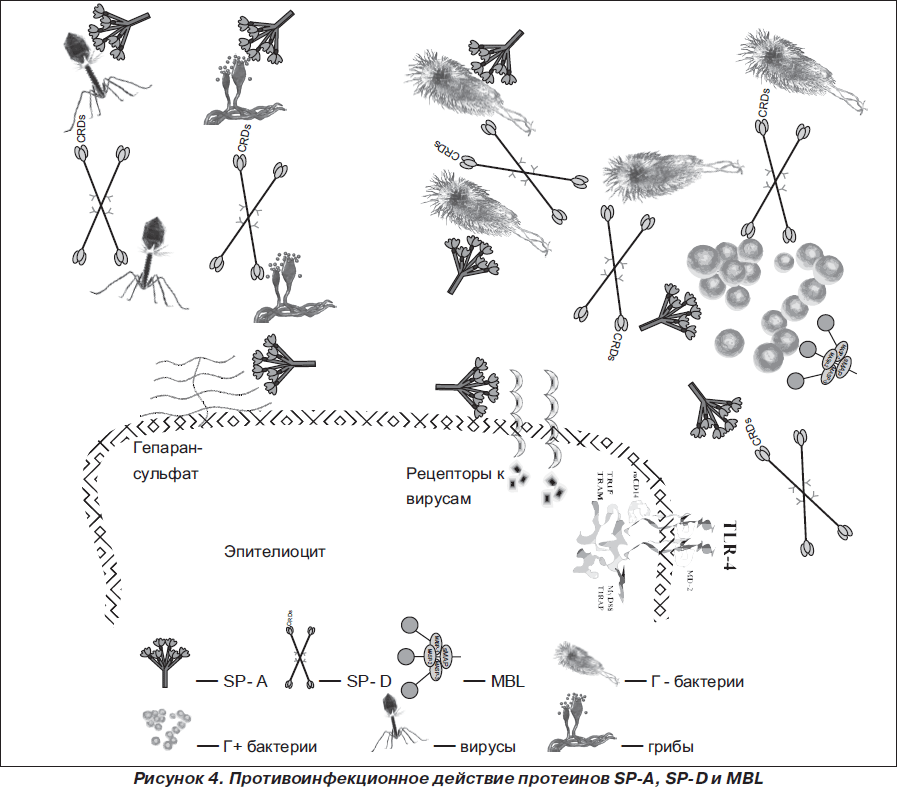
SP-А и SP-D, прикрепляясь к поверхностно расположенному липополисахриду (ЛПС) грамотрицательных (Pseudomonasaeruginosa, Klebsiellapneumoniae, Escherichiacoli, Haemophilusinfluenzae и др.), пептидогликану, липотейхоевой кислоте грамположительных бактерий (Streptococcuspneumoniae, Staphylococcusaureus), липоарабиноманнану Mycobacteriumtuberculosis, РАМР Pneumocystis carinii, вирусов гриппа, респираторно-синцитиального вируса, грибов, обусловливают их агрегацию. Антибактериальная активность SP-А и SP-D в большей мере проявляется в начальном периоде инфекционного заболевания (рис. 4) [30, 43, 46, 66, 69, 78, 86, 104, 114, 126]. В основе процесса агрегации инфекционных агентов лежит формирование протеиновых мостиков из белков сурфактанта между лигандами отдельных микроорганизмов [125].
Агрегация инфекционных агентов ингибигует рост бактериальных колоний и способствует увеличению эффективности мукоцилиарного клиренса, повышению эффективности фагоцитоза [89, 107]. Кальцийзависимая агрегация свободных солютабных РАМР снижает уровень их неблагоприятного действия на микроорганизм [44].
ЛПС грамотрицательных бактерий в связи с его липофильностью легко инкорпорируется компонентами сурфактанта, которые пространственно отстраняют ЛПС от эпителиоцитарных и макрофагальных TLR4, активирующих внутриклеточные сигнальные пути, которые ассоциированы с развитием воспалительного процесса. В настоящее время в зависимости от формы экспрессированного ЛПС различают две группы грамотрицательных бактерий. Выделяют грамотрицательные бактерии, экспрессирующие R-форму (rough — грубый, шершавый) ЛПС и S-форму ЛПС (smooth — гладкий, wild — дикий). R-форма ЛПС отличается от S-формы ЛПС присутствием липида-А4 и дефицитностью О-антигена — или полным отсутствием О-антигена, или наличием коротких детерминант О-антигена [2]. Считают, что О-антиген защищает ЛПС от действия антимикробных пептидов [16, 63]. Респираторный тракт чаще инфицируют грамотрицательные бактерии с R-формой (Ra, Rb, Rc, Rd и Re) ЛПС [2]. SP-D и SP-А взаимодействуют CR доменами (CRD — carbohydrate recognition domain) с R-формами и не взаимодействует с S-формами ЛПС грамотрицательных бактерий. Основным местом прикрепления данных белков сурфактанта к ЛПС является липид-А4. Белки сурфактанта SP-D и SP-А, прикрепляясь к ЛПС мембраны микроорганизмов, вызывают не только их агглютинацию, но и увеличение проницаемости бактериальной мембраны, в связи с чем оказывают непосредственно бактерицидное действие [18, 94, 115]. Нарушение проницаемости бактериальной мембраны, индуцируемое SP-A и SP-D, происходит в течение 15–30 минут и приводит к быстрому истечению содержимого бактериальной клетки [115]. Диапазон уровня бактерицидной концентрации в альвеолярной жидкости составляет для SP-A 300– 1800 мкг/мл, для SP-D 36 — 216 мкг/мл [130].
E. Kostina и соавт. [69] и I. Ofek и соавт. [104] считают, что SP-D играет особую роль в элиминации некапсулированных бактерий, а капсулированные формы преимущественно элиминируют альвеолярные макрофаги без участия белков сурфактанта.
В развитии инфекционного процесса, вызванного Mycoplasma pneumoniae, SP-А проявляет биполярное действие. SP-А, взаимодействуя с поверхностным 65-kDa белком MPN372 Mycoplasma pneumoniae, молекула которого содержит S1-подобную коклюшному токсину аминокислотную последовательность, вызывает как агглютинацию, так и усиление интернализации возбудителя в клетку, способствуя его колонизации [48].
Считают, что белки сурфактанта SP-A и SP-D проявляют непосредственное бактерицидное действие противграмотрицательных бактерий и бактериостатическое действие против Mycoplasma pneumoniae [60, 115].
SP-D и SP-A оказывают противовирусное действие [43, 51, 79, 83]. Показано, что в течение короткого времени после инфицирования вирусом гриппа и респираторно-синцитиальным (RS) вирусом происходит повышение концентрации SP-D в содержимом бронхоальвеолярного лаважа [104, 111]. Однако у детей, у которых RS-инфекция протекала с развитием острого бронхиолита, наблюдались низкие уровни концентрации SP-D и SP-A в бронхоальвеолярной жидкости [111].
Белки сурфактанта SP-D, SP-A блокируют активность вируса гриппа. Считают, что они, взаимодействуя непосредственно с гемагглютинином и нейроаминидазой вируса гриппа, обусловливают агрегацию вирусных агентов и предупреждают его взаимодействие с рецепторами эпителиоцитов [43, 104]. Однако в основе противовирусного действия SP-D и SP-A лежат разные механизмы. SP-D является классическим ингибитором вируса гриппа [65], в основе противовирусного действия которого лежит его способность гидролизировать гемагглютинин в 165-м положении [79]. SP-D увеличивает адгезию и поглощение нейтрофилами вирусов [19]. SP-A, в отличие от SP-D, присоединяясь к гемагглютинину, блокирует возможность его взаимодействия с клеточными рецепторами [100].
SP-D своим CRD взаимодействует с гликопротеинами F и G PS-вируса. Учитывая, что гликопротеин G непосредственно вступает во взаимодействие с мембраной клеток макроорганизма, а гликопротеин F ответственен за проникновение вируса в клетку и дальнейшее распространение из клетки в клетку, их блокада SP-D препятствует инфицированию макроорганизма [111].
Противоинфекционное действие белков сурфактанта SP-D, SP-A также связано и с их способностью фиксировать инфекционные агенты на мембранной поверхности макрофагов и нейтрофилов. Так, у молекулы SP-А в присутствие ионов Са2+ происходит изменение конформации глобулярного домена, которое обусловливает его связывание с ЛПС, а свободные коллагеновые хвосты N-терминального домена взаимодействуют с рецепторами макрофагов и нейтрофилов, индуцируя процесс фагоцитоза [35, 44, 50, 73, 125].
SP-А также непосредственно индуцирует процесс фагоцитоза, регулируя активность маннозосвязывающего рецептора макрофагов, который первично взаимодействует с маннозосодержащими участками поверхностных РАМР микроорганизмов. Белок сурфактанта SP-А, индуцируя неизвестные внутриклеточные механизмы макрофагов, может увеличивать активность фагоцитоза, опосредованного рецепторами FcR, CR1, CR3 [28, 39, 49, 129].
В отличие от SP-А протеин SP-D способствует только фиксации патогена на поверхности макрофага [125]. На примере Escherichia coli было показано, что SP-D не индуцирует интернализацию микроорганизма альвеолярными макрофагами. Повышение ассоциации бактериально-коллектинового комплекса с нейтрофилами происходит в течение первого часа после взаимодействия SP с РАМР [35, 50].
При дефиците SP-А, SP-D наблюдается замедление процесса эрадикации инфекционных бактериальных агентов. В условиях дефицита SP-А снижение уровня эрадикации Haemophilus influenzae, Pseudomonas aeruginosa, Staphylococcus aureus и Streptococcus pneumoniae происходило на фоне низкой продукции активированных кислородсодержащих метаболитов (АКМ). В то время как в условиях дефицита SP-D продукция АКМ сохранялась на достаточно высоком уровне, а также не отмечалось снижения активности нейтрофильного киллинга стрептококков [21, 34, 110]. По мнению R. Jounblat и соавт. [7], отсутствие индуцирующего действия SP-D на процесс нейтрофильного киллинга стрептококков не умаляет его роли в антистрептококковой защите, так как агглютинация пневмококков SP-D задерживает распространение инфекции и увеличивает эффективность мукоцилиарного клиренса.
Белок сурфактанта SP-D обладает выраженным противогрибковым действием на колонии Cryptococcus neoformans, Aspergillus fumigatus, Candida albicans, Histoplasma capsulatum и Blastomyces dermatitidis [20, 125]. По всей вероятности, SP-D реализует свое противогрибковое действие, взаимодействуя с гликоконъюгатами мембран грибов [18].
Иммуномодулирующее действие белков сурфактанта SP-А и SP-D
В процессе ответа макроорганизма на внедрение инфекционных агентов SP-А и SP-D выполняют иммуномодулирующую роль [51, 128], оказывая как про-, так и противовоспалительное действие [19, 33, 117, 130]. Учитывая, что у SP-A- и SP-D-дефицитных мышей ответ на инфицирование бактериальными агентами характеризуется значительно более высокой продукцией провоспалительных цитокинов, чем у бездефицитных мышей [21, 32, 111], по всей вероятности, данные белки обладают более выраженным противовоспалительным, чем провоспалительным потенциалом действия.
Провоспалительное действие белков сурфактанта реализуется через взаимодействие SP-A, SP-D с рецептором SP-R210 макрофагов, гликопротеином gp-340, CD91, C1qR.
Взаимодействие SP-A и комплекса SP-A/РАМР с рецептором SP-R210 макрофагов, которое приводит к повышению внутриклеточной концентрации Са2+, обусловливая индукцию: 1) интернализации патогена; 2) перемещения p47phox к мембране клетки, что инициализирует продукцию супероксидного анион-радикала (O2·); 3) фосфорилирования митоген-активируемых протеинкиназ (MAPK) экстрацеллюлярных сигнал-регулирующих киназ 1 и 2 (ERK1/2), определяющих активность синтеза оксида азота (NO), хемокинов и провоспалительных цитокинов [1, 26, 58, 68, 98]. Действие SP-A на продукцию NO зависит от наличия его взаимодействия с РАМР микробных агентов. Так, в чистом виде SP-A подавляет синтез NO, но в присутствии РАМР, в частности Mycoplasma pneumonia увеличивает его продукцию [36, 47, 85].
Возбуждение рецептора SP-R210 белком сурфактанта SP-A индуцирует процесс фагоцитоза макрофагов, но подавляет пролиферацию Т-лимфоцитов, изменяет метаболическую активность эпителиоцитов, альвеолоцитов II типа.
Вне зависимости от лектиновой активности SP-D и SP-А взаимодействуют с мембранным гликопротеином gp-340, который является представителем суперсемейства цистеинобогащенных макрофагальных скавенджеров (SRCR — scavenger receptor cysteine-rich), обусловливая агрегацию некоторых бактерий, в частности Streptococcus mutans, и, что особенно важно, миграцию макрофагов [20, 88, 122].
Взаимодействие коллагеновых хвостов белков сурфактанта с комплексом калретикулин/CD91 (LRP1 — lipoprotein receptor-related protein 1) индуцирует развитие каскада воспалительной реакции и макропиноцитоз апоптотических клеток [44, 118, 120].
Одним из составляющих компонентов провоспалительного действия белков сурфактанта является усиление под влиянием SP-A продукции провоспалительных цитокинов макрофагами, активированными IFN-g [36]. Также SP-D и SP-А являются хемотаксическим фактором для нейтрофилов и моноцитарных клеток [20, 52, 81]. В основе механизма стимуляции хемотаксиса альвеолярных макрофагов и нейтрофилов SP-A и SP-D лежит их способность индуцировать направленную полимеризацию актина [52, 123].
Основные противовоспалительные эффекты SP-А и SP-D связаны с их аффинностью к SIRP-a и способностью изменять активность TLR2, TLR4.
Белки SP-А и SP-D, взаимодействуя лектиновым доменом с SIRP-a альвеолярных макрофагов и дендритных клеток, обусловливают ингибицию провоспалительного ответа, индуцированного РАМР инфекционных агентов [10, 61]. Цитоплазматический домен SIRP-a содержит два иммунорецепторных тирозиновых ингибирующих мотива, фосфорилирование которых приводит к рекрутированию тирозиновых фосфатаз SHP-1, SHP-2. Данные фосфатазы могут прерывать внутриклеточную передачу сигналов с рецепторов, ассоциированных с тирозинкиназами [57]. S.J. Gardai и соавт. [10] показали, что возбуждение тирозиновой фосфатазы SHP-1 блокирует передачу внутриклеточного сигнала, ингибируя p38 MAPK, что снижает уровень активации фактора транскрипции NF-kB и, как следствие, продукцию провоспалительных цитокинов [116]. В частности, показано, что SP-A ингибирует синтез ТНФ-a [119]. Влияя на активность фактора транскрипции NF-kB, SP-D играет центральную роль в регуляции продукции альвеолярными макрофагами матриксных металлопротеиназ [41, 132]. SP-A, ингибируя активность NF-kB, подавляет синтез секреторной фосфолипазы A2 альвеолярными макрофагами [109].
Активация SHP-2 приводит к подавлению ЛПС-индуцированного TLR4-опосредованного воспалительного ответа. X.-N. Kong и соавт. [57] считают, что в начале заболевания, когда макрофаги представляют SIRP-a на поверхности мембраны в достаточном количестве, рекрутированные молекулы тирозиновой фосфатазы SHP-2 удерживаются интрацеллюлярным доменом рецептора, а с течением заболевания представительство SIRP-a снижается, предопределяя увеличение свободных активированных молекул SHP-2, подавляющих TLR сигнальную активность.
SP-D и SP-А, взаимодействуя с ЛПС грамотрицательных бактерий и с CD14, ингибируют ассоциацию как R-форм, так и S-форм ЛПС с CD14, что приводит к снижению уровня TLR4-зависимого ответа, которое проявляется снижением продукции ТНФ-a, других провоспалительных цитокинов и оксида азота [22, 44, 89, 113, 129]. В исследованиях было показано, что SP-А непосредственно вступает в Ca2+-зависимое взаимодействие с внеклеточным доменом TLR4 и с MD-2, снижая уровень возбуждения TLR4 S-формами ЛПС [97, 132]. Белки сурфактанта SP-D и, возможно, SP-А, связываясь с такими РАМР грамположительных бактерий, как LTA и PepG, предупреждают взаимодействие данных РАМР с TLR2 [11, 84, 121]. SP-A физически взаимодействует с TLR2, ингибируя пептидогликан-индуцированную активацию генов [99]. Показано, что SP-D связывается с эктодоменом TLR4 и TLR2 через CRD механизм [39]. Белки сурфактанта SP-D и SP-А также взаимодействуют с декорином [81].
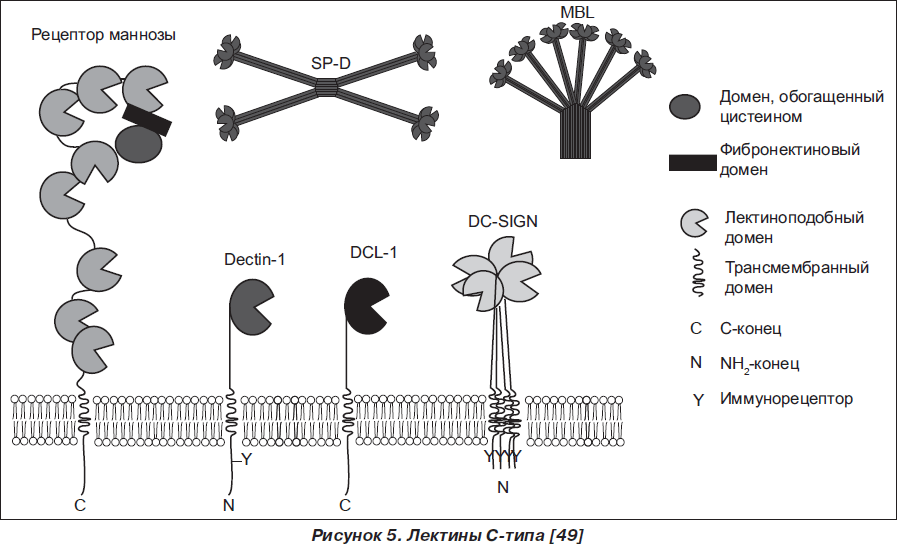
Белки сурфактанта SP-D, SP-A, а также пентраксины, фиколины, комплемент представляют собой солютабные паттерн-распознающие рецепторы (PRR). Они связывают РАМР, опсонируя инфекционные агенты, что способствует фагоцитозу. В то же время PRR препятствуют взаимодействию РАМР с мембранными лектинами (рис. 5) эпителиоцитов, фагоцитирующих и других клеток — рецептором маннозы, трансмембранным белком I типа DCL-1 (CD302), трансмембранными белками II типа дектином-1 и DC-SIGN (CD209), что снижает активность индукции фагоцитоза [49].
SP-D ингибирует IL-2 зависимую пролиферацию Т-лимфоцитов, проявляя противовоспалительную активность [59, 80], и подавляет продукцию провоспалительных цитокинов IL-1, IL-6, и ТНФ-a [32]. SP-A, взаимодействуя с C1q, угнетает активацию комплемента [129].
Предполагают, что SP-D и SP-А являются важным связующим звеном между неспецифической защитой и специфическим иммунитетом, так как SP-D усиливает антигенпрезентирующую функцию дендритных клеток и модулирует функцию Т-лимфоцитов, а SP-А ингибирует матурацию дендритных клеток [8, 14, 103].
SP-D связывает различные классы иммуноглобулинов — IgG, IgM, IgE и секреторный IgA, но не взаимодействует с сывороточным IgA. SP-D и SP-А ингибируют синтез IgE [42]. Показано, что полиморфизм гена SP-D (SFTPD) ассоциирован с низким риском развития атопии [101].
SP-A и SP-D принимают активное участие в идентификации и элиминации апоптотических и некротических клеток организма [24, 82, 90]. L.M. Stuart и соавт. [96] и H. Clark и соавт. [106] показали, что одним из факторов, обусловливающих противовоспалительное действие SP-D, является его способность увеличивать клиренс погибших нейтрофилов и снижать активность апоптоза альвеолярных макрофагов.
Выводы
Белки сурфактанта, составляющие около 10 % его массы, играют определяющую роль в поддержании структурной организации сурфактанта, процессе ремоделирования легких и защите макроорганизма от интервенции инфекционными агентами. Особое значение в ранней противоинфекционной защите респираторного тракта играют гидрофильные белки сурфактанта SP-A и SP-D. В процессе ответа макроорганизма на внедрение инфекционных агентов SP-А и SP-D выполняют иммуномодулирующую роль, оказывая как про-, так и противовоспалительное действие. Свое влияние на клетки макроорганизма SP-A и SP-D реализуют через взаимодействие с рецепторами — C1qR, SP-R210, гликопротеином gp 340, CD91, коингибиторным рецептором SIRP-a. Взаимодействие белков сурфактанта SP-A, SP-D с рецептором SP-R210 макрофагов, гликопротеином gp-340, CD91, C1qR сопровождается провоспалительным, а с SIRP-a — противовоспалительным эффектом. Белки сурфактанта SP-D и SP-А являются важным связующим звеном между неспецифической защитой и системой специфического иммунитета.
Список литературы находится в редакции