Журнал «Травма» Том 12, №2, 2011
Вернуться к номеру
Патогенез иммунных нарушений при посттравматическом гонартрозе
Авторы: Золотухин С.Е., Шпаченко Н.Н., Коробов В.П., Попов С.В. НИИ травматологии и ортопедии Донецкого национального медицинского университета им. М. Горького
Рубрики: Травматология и ортопедия
Версия для печати
Изучены нарушения иммунной системы в динамике гонартроза у 146 больных. У 66 (45,3 %) человек имел место гонартроз I степени, у 60 (41,0 %) — гонартроз II степени, у 20 (13,7 %) — гонартроз III степени.
На начальном этапе гонартроза клинико-рентгенологические изменения в коленных суставах и иммунологическом статусе больных незначительны. Иммунологические параметры указывают на неспецифическую микробную активацию Т-системы иммунитета и фагоцитоза. В динамике гонартроза активация фагоцитоза становится все значительней, она оказывается преобладающей над активацией Т- и В-лимфоцитов. Это приводит к дисбалансу в функционировании иммунной системы и влечет за собой снижение количества Т-супрессоров. Нарушения иммуносупрессии, в свою очередь, ведут к потере иммунологической толерантности и выработке аутоантител на аллоантигены кости, хряща и синовии, а также к усилению выработки ЦИК, ИЛ-8 и ФНО-α. Иммунные комплексы и провоспалительные интерлейкины запускают синдром системного воспалительного ответа. Во второй стадии гонартроза заканчивается трансформация дегенеративно-дистрофического процесса в воспалительный. Воспаление в суставе развивается с участием аутоиммунного механизма. В отличие от аутоиммунных заболеваний при гонартрозе эффекторные реакции иммунной системы представлены не клеточным, а гуморальным типом. Нарушения в звеньях иммунологической реактивности и неспецифической резистентности, выявляемые у больных в третьей стадии болезни, свидетельствовали об интенсивном воспалительном процессе в тканях организма. Костно-суставную деструкцию подтверждали данные рентгенологического исследования.
Гонартроз, патогенез, иммунные нарушения.
Гонартроз, или деформирующий артроз коленного сустава, по частоте поражения суставов занимает второе место после деформирующего артроза тазобедренного сустава (коксартроза) [5, 11]. Особую тревогу ввиду высокой инвалидизации вызывает травма нижних конечностей у шахтеров [4, 8]. Травматический синовит является наиболее частым осложнением поражения коленных суставов [5, 8]. В дальнейшем у 60–80 % пострадавших он дает развитие воспалительно-дистрофического процесса, который приводит к гонартрозу [2, 7, 11].
Цель исследования: изучение механизмов иммунологических нарушений при посттравматическом гонартрозе.
Материал и методы
При изучении нарушений иммунной системы в динамике гонартроза обследовано 146 больных. У 66 (45,3 %) человек имел место гонартроз I степени, у 60 (41,0 %) — гонартроз II степени, у 20 (13,7 %) — гонартроз III степени. Основная часть пациентов этой группы была представлена людьми зрелого и пожилого возраста (59,6 %). В этой группе работали на различных производствах 40 (27,4 %) человек, 79 (54,1 %) были пенсионерами, 27 (18,4 %) имели «нерабочие» группы инвалидности. Контрольную группу составили практически здоровые доноры крови (n = 10) 35,6 ± 3,7 года.
Всем больным проведены клинико-лабораторные исследования, в том числе рентгенологические, биомеханические и лабораторные.
Клеточные факторы иммунитета изучали в цитотоксическом тесте с помощью моноклональных антител фирмы «Ortho Diagnostic Systems» (USA). Использовали коммерческие моноклональные антитела классов СD3+ (к тотальной популяции Т-лимфоцитов), СD22+ (к В-клеткам), СD4+ (к субпопуляции Т-хелперов/индукторов), СD8+ (к Т-супрессорам/киллерам).
Для оценки функциональной активности лимфоцитов с помощью реакции бластной трансформации (РБТЛ) использовали различные митогены: фитогемагглютинин (ФГА) для определения функциональной активности Т-лимфоцитов, конканавалин А (КонА) для определения супрессорной активности, митоген лаконоса (МЛ) для выявления хелперной активности и митоген липополисахарида (ЛП), активирующий В-клетки [9].
В гуморальном звене иммунной системы определяли уровень циркулирующих иммунных комплексов (ЦИК) и концентрацию иммуноглобулинов классов G, A и М [3].
Для определения фагоцитарной активности моно- и полинуклеаров использовали метод, основанный на поглощении этими клетками микробов (Staphilococcus aureus, штамм 209) [9]. Бактерицидную активность нейтрофилов оценивали в тесте восстановления нитросинего тетразолия свободным внутриклеточным кислородом (НСТ-тест) по методу Б.С. Нагоева и соавт. [6].
Для оценки выраженности воспалительного ответа организма изучали в сыворотке крови концентрацию провоспалительных цитокинов: интерлейкина-8 (ИЛ-8) и фактора некроза опухоли альфа (ФНО-альфа). Указанные цитокины выявляли методом твердофазного иммуноферментного анализа (ИФА) с применением в качестве индикаторного фермента пероксидазы хрена. В методике использованы реактивы производства ООО «Протеиновый контур» (Россия, С.-Петербург).
Все полученные результаты статистически обрабатывали на персональном компьютере Pentium-IV с использованием лицензированного пакета прикладной статистики Statistica for Windows производства фирмы StatSoft Inc. (1999).
Результаты и обсуждение
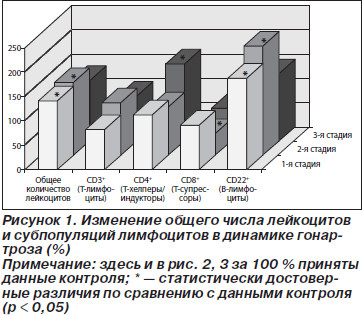
В первой стадии болезни у больных гонартрозом имел место незначительный лейкоцитоз с увеличением общего числа лейкоцитов в среднем на 40,6 % (рис. 1). Лейкоцитарная формула крови существенно не изменялась. Между отдельными фракциями Т- и В-лимфоцитов имело место нарушение соотношений: количество Т-супрессоров (CD8+) не изменялось, но увеличивалось число В-лимфоцитов (CD22+) на 87,5 %. По сути, уровень В-лимфоцитов возрастал за счет увеличения иммунорегуляторного индекса (отношения между хелперной и супрессорной популяциями Т-лимфоцитов) с 1,4 до 1,7.
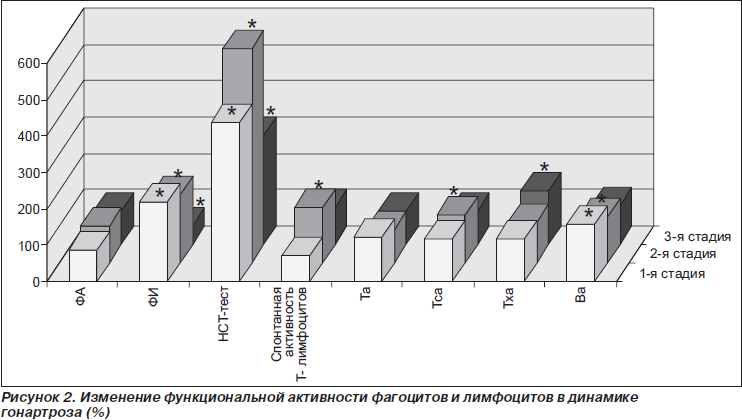
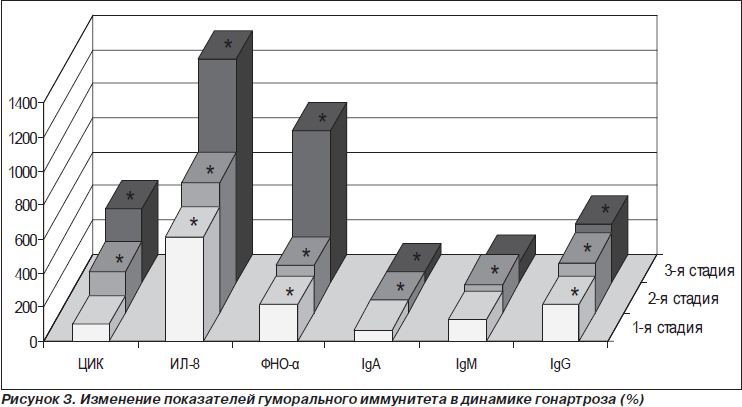
Число клеток, которые в РБТЛ были стимулированы ФГА (общий пул Т-лимфоцитов), повышалось на 23 % (рис. 2). Число клеток, которые в РБТЛ были стимулированы ЛП (пул В-лимфоцитов), также повышалось на 54,9 %. У больных в первой стадии гонартроза наблюдалось повышение фагоцитарного числа на 117,6 % и на 340,2 % величины НСТ-теста. В крови больных на 516 % возрастала концентрация интерлейкина-8 (ИЛ-8) и на 113,9 % ФНО-a (рис. 3). Увеличивалась также концентрация IgG на 118 %. Другие изученные иммунологические показатели не изменялись.
Характер изменения иммунологических показателей у больных указывал на наличие серьезных нарушений, свойственных начальному этапу патогенеза болезни. Напряжение иммунитета, проявляющееся в лейкоцитозе, в изменении соотношения субпопуляций лимфоцитов (изменении числа активных Т- и В-лимфоцитов), повышении фагоцитарной активности макрофагов и росте концентрации интерлейкинов, особенно ИЛ-8, следует рассматривать как результат стимуляции иммунной системы различными антигенами. Природу этих антигенов объясняют высокие результаты оценки спонтанного НСТ-теста, неспецифического маркера бактериальной инфекции, и данные повышения поглотительной способности фагоцитов [6]. Повышение концентрации ИЛ-8 и ФНО-a в крови указывало на усиление производства этих цитокинов моноцитами и тканевыми макрофагами для стимуляции хемотаксиса и фагоцитарной активности нейтрофилов [1, 10].
На рентгенограммах коленных суставов у обследованных нами больных, которые испытывали локальную болезненность, явных разрушений элементов суставов однако не было, признаки воспаления на фоне дистрофических изменений там присутствовали.
У пациентов во второй стадии болезни, по сравнению с контролем, имели место изменения, обусловленные увеличением общего числа лейкоцитов, уменьшением количества Т-супрессоров и В-лимфоцитов на 50, 55 и 125 % соответственно, повышением значений НСТ-теста на 490 %, фагоцитарного числа на 87 %, уровня ЦИК на 138 %, а также увеличением концентрации цитокинов ИЛ-8 на 664 % и ФНО-a на 175 % (рис. 1–3).
При изучении активности лимфоцитов в РБТЛ было установлено повышение спонтанной активности лимфоцитов на 46 %, повышение активности Т-супрессоров (стимулированной КонА) на 28,8 %, и В-лимфоцитов (стимулированной ЛП) на 24,3 %.
Изменения в иммунной системе, которые наблюдались у больных во второй стадии гонартроза, были обусловлены нарушением характера иммунологического реагирования на увеличивающееся количество антигенного материала. О возрастании уровня антигенов свидетельствовал высокий уровень ЦИК. О начальном этапе сенсибилизации организма этими антигенами говорило снижение количества Т-супрессоров, в норме справляющихся с факторами гиперергического воспаления. На наметившуюся блокаду функциональной активности лимфоцитов иммунными комплексами указывало снижение величины функциональной активности Т-лимфоцитов в РБТЛ. Активность фагоцитирующих клеток оставалась, как и в контроле, высокой, примерно такой, какой она была в первой стадии болезни.
Прогрессирующий рост концентрации ИЛ-8 и ФНО-a был обусловлен увеличением территории воспаленных тканей и отражал реакции не локального, а уже системного воспалительного ответа. Источником новых антигенов могли быть ткани пораженного воспалением коленного сустава [1, 10]. При этом увеличивалась концентрация IgM на 69 %, а IgG на 193 % при незначительном снижении концентрации IgA.
Деструкцию костей коленного сустава подтверждали данные рентгенологических исследований. Во второй стадии болезни некротизированные костные балки, теряя упругость под влиянием статической и динамической нагрузки, надламывались и компрессировались. Рентгенологически это мы наблюдали в различии плотности отдельных сегментов, снижением высоты и нарушении формы костей сустава.
У пациентов в третьей стадии болезни выявлялось уменьшение числа лейкоцитов до уровня нормы (рис. 1). Состав лейкоцитарной формулы не изменялся. Общее число Т-лимфоцитов оставалось в пределах нормы. Между отдельными фракциями Т-лимфоцитов происходило изменение соотношений, в частности увеличивалось на 60 % количество Т-хелперов/индукторов (CD4+). Число клеток, которые в РБТЛ были стимулированы МЛ (пул Т-хелперов), повышалось на 44 % (рис. 2). У больных в третьей стадии гонартроза наблюдалось снижение на 49 % величины фагоцитарного числа при сохраняющемся высоком уровне показателя НСТ-теста (рис. 2). Величина этого показателя была на 201 % выше, чем у людей контрольной группы. В крови больных по-прежнему отмечалась очень высокая концентрация ЦИК и цитокинов. Уровень ЦИК на 337 %, ИЛ-8 на 1215, а ФНО-a на 792 % превышали значение нормы, концентрация IgG на 244 % также была выше, чем в контроле (рис. 3).
Нарушения в звеньях иммунологической реактивности и неспецифической резистентности, выявляемые у больных в третьей стадии болезни, свидетельствовали об интенсивном воспалительном процессе в тканях организма. Костно-суставную деструкцию подтверждали данные рентгенологического исследования.
Таким образом, при гонартрозе показатели иммунологической реактивности и неспецифической резистентности отражают изменения, обусловленные повреждением коленных суставов в динамике болезни. На начальном этапе гонартроза клинико-рентгенологические изменения в коленных суставах и иммунологическом статусе больных незначительны. Иммунологические параметры указывают на неспецифическую микробную активацию Т-системы иммунитета и фагоцитоза. В динамике гонартроза активация фагоцитоза становится все значительней, она оказывается преобладающей над активацией Т- и В-лимфоцитов. Это приводит к дисбалансу в функционировании иммунной системы и влечет за собой снижение количества Т-супрессоров. Нарушения иммуносупрессии, в свою очередь, ведут к потере иммунологической толерантности и выработке аутоантител на аллоантигены кости, хряща и синовии, а также к усилению выработки ЦИК, ИЛ-8 и ФНО-a. Иммунные комплексы и провоспалительные интерлейкины запускают синдром системного воспалительного ответа. Во второй стадии гонартроза заканчивается трансформация дегенеративно-дистрофического процесса в воспалительный. Воспаление в суставе развивается с участием аутоиммунного механизма. В отличие от аутоиммунных заболеваний при гонартрозе эффекторные реакции иммунной системы представлены не клеточным, а гуморальным типом.
Возианов А.Ф., Бутенко А.К., Зак К.П. Цитокины. Биологические и противовоспалительные свойства. — К.: Наукова думка, 1998. — 317 с.
Корж А.А., Черных В.П., Филиппенко В.А. и др. Диагностика и консервативное лечение заболеваний и повреждений опорно-двигательной системы: Справ.: В 8 кн. — Харьков: Основа, 1997. —Кн. 2: Остеоартроз. — 88 с.
Земсков А.М., Земсков В.М. Дополнительные методы оценки иммунного статуса // Клиническая лабораторная диагностика. — 1994. — № 3. — С. 34-35.
Золотухін С.Є. Травматична хвороба у шахтарів глибоких вугільних шахт Донбасу (особливості патогенезу і обґрунтування ефективної терапії): Автореф. дис. док-ра мед. наук. — Одеса, 2000. — 36 с.
Коваленко В.И., Борткевич О.П. Остеопороз: Практическое руководство. — К.: Морион, 2003. — 448 с.
Нагоев Б.С., Шубич М.Г. Значение теста восстановления нитросинего теразолия. — Нальчик, 1985. — 23 с.
Насонова В.А., Бунчук Н.В. Руководство по внутренним болезням. Ревматические болезни. — М.: Медицина, 1997. — 385 с.
Синяченко О.В., Баринов Э.Ф., Руднев Г.А. и др. Эпидемиологические аспекты болезней суставов у шахтеров // Медицина труда и промышленная экология. — 1997. — № 11. — С. 41-44.
Фришель Я.Б. Иммунологические методы. — М.: Медицина, 1987. — 427 с.
Vicolo N.A. Guidebook to Cytokines ant their Receptors. — Oxford, 1994. — 300 p.
Scott J.C. Leightbridge-Cejku M., Hochberg M.C. Epidemiology and economic consequences of osteoarthritis. The American Viewpoint // Osteoarthritis. Clinical and experimental aspects. — Springer, 1999. — P. 20-38.