Журнал «Здоровье ребенка» 3 (30) 2011
Вернуться к номеру
Особливості екскреції мікроелементів із сечею у дітей, хворих на цукровий діабет 1-го типу
Авторы: Маркевич В.Е., Глущенко Н.В., Медичний інститут Сумського державного університету, Радченко І.П., Сумська обласна дитяча клінічна лікарня
Рубрики: Педиатрия/Неонатология
Версия для печати
Стаття присвячена дослідженню екскреції мікроелементів із сечею у дітей, хворих на цукровий діабет 1-го типу, залежно від рівня глікемічного контролю. Для визначення концентрації мікроелементів у сечі (заліза, цинку, міді, хрому, кобальту, нікелю, свинцю) використовували метод атомно-абсорбційної спектрофотометрії. Встановлено, що екскреція есенційних та токсичних мікроелементів у дітей суттєво зростає в міру погіршення рівня глікемічного контролю.
Мікроелементи, цукровий діабет 1-го типу, діти, сеча.
Вступ
Дезорганізація метаболічних процесів, що виникає при цукровому діабеті 1-го типу (ЦД-1), значно ускладнює роботу систем гомеостазу, особливо нирок. Одним із ускладнень, що лімітує якість життя дітей із ЦД-1, є діабетична нефропатія, котра досить швидко призводить до розвитку хронічної ниркової недостатності [1]. Анатомо-фізіологічні особливості нирки роблять її особливо чутливою до дії несприятливих екологічних факторів. Існують літературні дані про негативний вплив токсичних металів на будову та функцію нирок в експерименті на тваринах [2]. Відсутня інформація про особливості ниркової регуляції мікроелементного забезпечення та впливу токсичних мікроелементів (МЕ) у разі цукрового діабету в дітей. Саме тому вивчення цих питань дозволить визначити роль нирок у підтриманні мікроелементного гомеостазу у даної категорії хворих та розробити рекомендації щодо корекції у випадку дефіциту та дисбалансу МЕ.
Мета роботи: за показниками концентрації у сечі та добової екскреції дослідити стан ниркової регуляції мікроелементного забезпечення дітей, хворих на ЦД-1, залежно від рівня глікемічного контролю та розробити рекомендації щодо корекції мікроелементного балансу у них.
Матеріали та методи
Концентрацію есенційних МЕ (заліза, цинку, міді, хрому, кобальту, нікелю) та токсичного МЕ (свинцю) визначали у сечі 64 хворих на ЦД-1 дітей залежно від рівня глікемічного контролю (ГК). Стан компенсації ЦД-1 оцінювався згідно з ISPAD (Consensus for the Management of Type 1 Diabetes Mellitus in Children end Adolescens, 2000). Оптимальний рівень ГК мали 10 дітей (група I), субоптимальний — 30 (група II), рівень ГК із високим ризиком для життя (ГКВР) — 24 хворі (група III). Групу порівняння становили 30 практично здорових дітей.
Для визначення МЕ використовували метод атомно-абсорбційної мас-спектрофотометрії на спектрофотометрі С-115М1 виробництва НВО Selmi (Україна), оснащеному комп’ютерною приставкою для автоматичного обчислювання вмісту МЕ. Визначали загальну концентрацію ME (мкмоль/л) у ранковій порції сечі та добову екскрецію (мкмоль/л/добу).
Статистичну обробку одержаних результатів проводили за допомогою програми Exсel. Використовували методи варіаційної статистики, придатні для медико-біологічних досліджень. Для всіх показників визначали середньоарифметичне (М), похибку середньоарифметичного (m). За допомогою критерію Стьюдента (t) визначали показник вірогідності (Р), різницю вважали вірогідною при р < 0,05.
Результати та їх обговорення
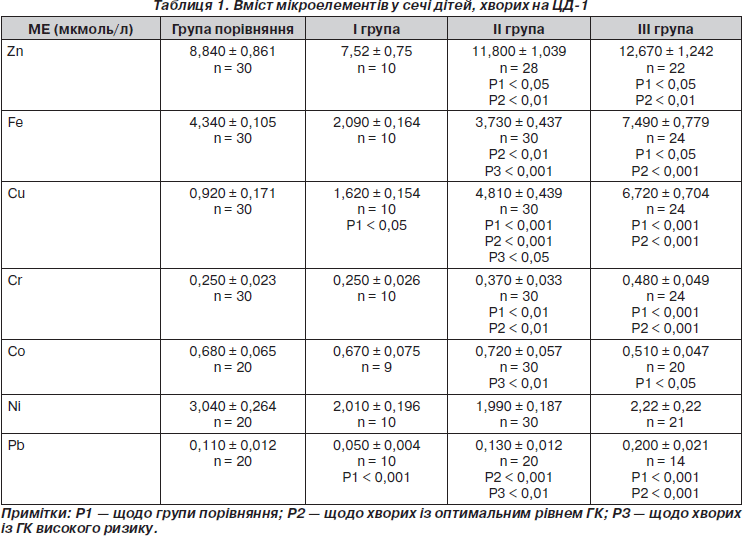
Встановлено, що зміни вмісту МЕ у сечі дітей, хворих на ЦД-1, у переважній більшості були однонаправленими. У випадках погіршення рівня контролю глікемії збільшувалась втрата МЕ із сечею (табл. 1).
Зокрема, вміст цинку (Zn) у дітей I групи практично не відрізнявся, у пацієнтів групи II був на 25 %,
а у дітей III групи — на 42 % більшим порівняно зі здоровими дітьми. За літературними даними, в експерименті на тваринах встановлено, що реабсорбція цинку здійснюється у всіх відділах нефрону за допомогою білка — траспортера двовалентного металу [3]. Таким чином, підвищена концентрація Zn у сечі може бути однією з ознак ураження ниркових канальців, зумовленого глюкозурією та гіперглікемією у разі цукрового діабету.
Звертає увагу той факт, що екскреція заліза (Fe), навпаки, виявилась зниженою. У разі оптимального рівня ГК вона була на 51,8 %, а у випадку субоптимального рівня ГК — на 14 % меншою щодо групи порівняння. Посилена втрата заліза із сечею спостерігалась лише у дітей із ГКВР. Виділення заліза у даної категорії було на 42 % більшим, ніж у здорових.
Вміст кобальту (Co) в сечі дітей з оптимальним рівнем ГК не відрізнявся від показників групи порівняння. У пацієнтів із субоптимальним рівнем ГК він був на 6 % більшим порівняно зі здоровими дітьми. В обстежених дітей III групи, навпаки, мало місце зниження вмісту Со на 25 % щодо групи порівняння. Одночасна втрата заліза та кобальту із сечею може сприяти порушенню процесів кровотворення та розвитку залізодефіцитної анемії [4].
Вміст нікелю (Ni) у сечі виявився низьким у всіх обстежених дітей. Причому він не мав чіткої залежності від рівня глікемічного контролю та був на 27–34,6 % меншим порівняно зі здоровими дітьми.
Концентрація хрому (Cr) в сечі у дітей I групи не відрізнялася від показників здорових. У дітей II групи вона була на 32,5 %, у III групи — на 48 % більшою щодо групи порівняння. Хром стимулює формування дисульфідних зв’язків між дисульфідними містками інсуліну і сульфідними групами мітохондріальної мембрани шляхом утворення потрійного комплексу. Завдяки цьому інсулін збільшує потік глюкози, що проходить через мембрани. Тому дефіцит Cr в організмі може негативно впливати на трансмембранний транспорт глюкози [5].
Слід зауважити, що вміст міді (Cu) в сечі всіх дітей з ЦД-1 значно перевищував показники здорових дітей. Найбільш виражену купрумурію знаходили у пацієнтів III групи. Вміст Cu у них був на 86,3 % більшим, ніж у дітей групи порівняння. У хворих I та II групи вміст міді у сечі на 43 та 80,9 % відповідно перевищував показники здорових дітей.
Для дітей, хворих на ЦД-1, характерною була підвищена концентрація свинцю (Pb) в сечі. У дітей III групи вона була на 55 % більшою, ніж у групі порівняння. Лише на 15,4 % більшою порівняно зі здоровими дітьми була концентрація Pb у дітей групи II. Слід зазначити, що у дітей I групи вміст свинцю був, навпаки, на 54,5 % нижчим порівняно зі здоровими.
Таким чином, найбільша концентрація в сечі Cu, Zn, Fe, Cr та Pb властива для дітей із субоптимальним рівнем ГК та ГКВР. Знайдені особливості вмісту мікроелементів у сечі сприяють виникненню дефіциту та дисбалансу МЕ у цієї категорії хворих.
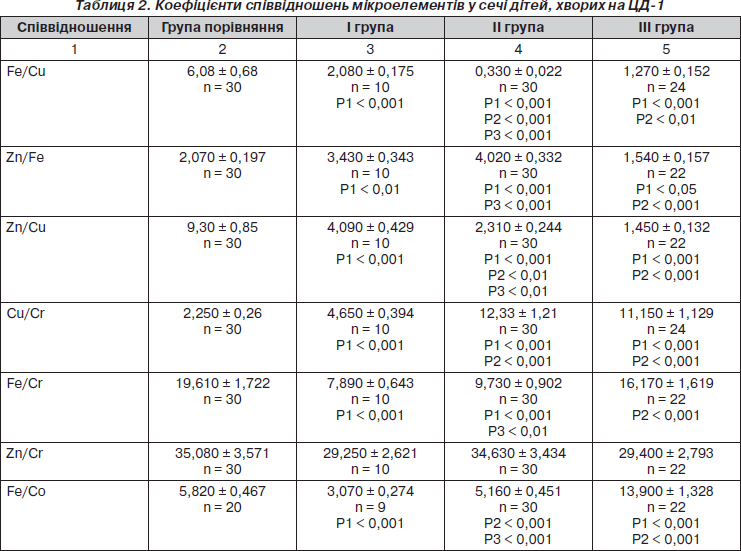
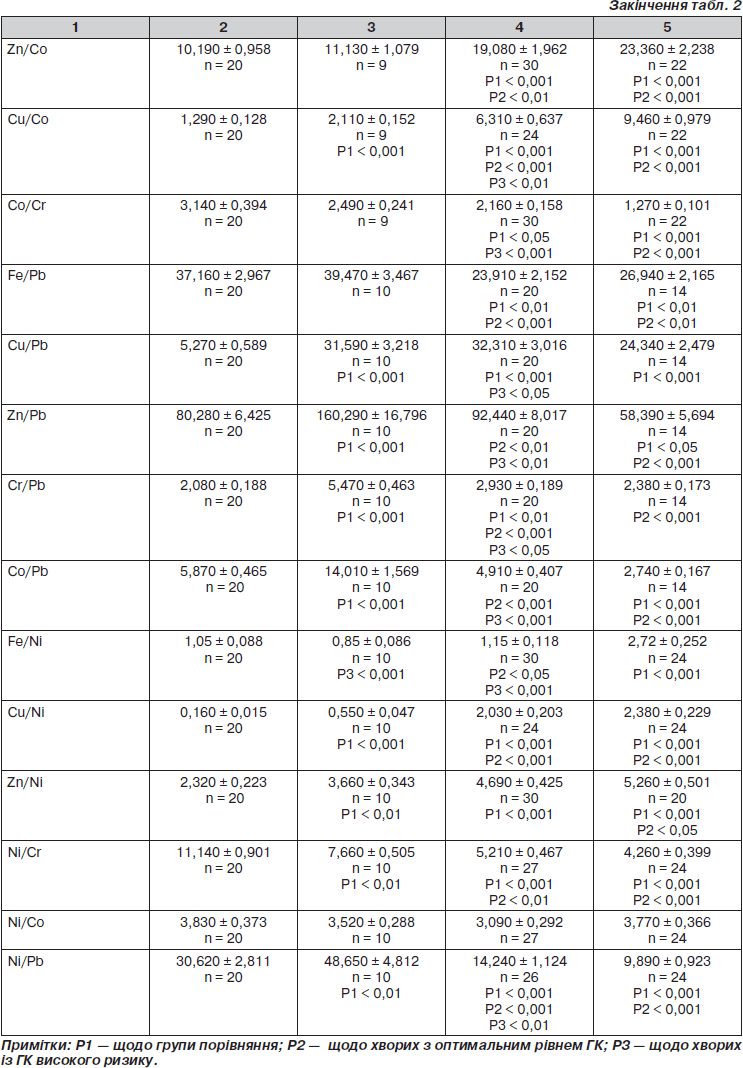
З метою поглибленого аналізу порушень мікроелементного складу досліджувались коефіцієнти співвідношень окремих МЕ у сечі (табл. 2).
Встановлено, що у разі ЦД-1 рано виникає дисбаланс МЕ у сечі. У дітей із оптимальним рівнем ГК більшими, ніж у групі порівняння, виявились коефіцієнти співвідношення Cu/Pb — у 6 разів, у 3 рази — Cu/Ni, Cr/Pb і Co/Pb, у 2 рази — Zn/Pb і Zn/Ni, у 1,7 раза — Zn/Fe. Зменшувались у 3 рази співвідношення Fe/Cu, удвічі — показники Zn/Cu, Fe/Cr та
Fe/Co, у 1,5 раза — Fe/Ni, Ni/Cr та Co/Cr порівняно зі здоровими дітьми.
Ще більший мікроелементний дисбаланс виникав у разі субоптимального рівня ГК. Так, в обстежених дітей II групи збільшувались показники співвідношень Cu/Ni — у 13 разів, Cu/Pb — у 6 разів, Cu/Co
і Cu/Cr — у 5 разів, Zn/Ni, Zn/Fe та Zn/Co — у 2 рази, Cr/Pb — у 1,5 раза порівняно зі здоровими дітьми. Меншими були коефіцієнти співвідношень Fe/Cu — у 18 разів, Zn/Cu — у 4 рази, вдвічі — Ni/Cr, Ni/Pb та Fe/Cr, у 1,5 раза — Fe/Pb та Co/Cr відносно групи порівняння.
У хворих з показниками глікемічного контролю високого ризику встановлений значний дисбаланс МЕ. Зокрема, більшими, ніж у групі порівняння, виявились показники Cu/Ni — у 15 разів, у 7 разів — Cu/Co, у 5 разів — Cu/Pb та Cu/Cr, у 3 рази — Fe/Ni, у 2 рази — Zn/Ni, Fe/Co та Zn/Co. Меншими, навпаки, виявились показники Zn/Cu — у 6,4 раза, Fe/Cu — у 5 разів, Ni/Cr і Ni/Pb — у 3 рази, Co/Pb та Co/Cr — у 2 рази, у 1,4 раза — Fe/Pb, Zn/Pb, Zn/Fe та Fe/Cr.
Таким чином, результати дослідження показників співвідношення МЕ у сечі свідчать про наявність суттєвого дисбалансу їх вмісту. Особливо значущим дисбаланс у всіх хворих на ЦД-1 спостерігався у парах Cu/Ni, Cu/Pb, Fe/Cu, Zn/Cu, Fe/Co та Zn/Co, що може впливати на розвиток хронічних діабетичних ускладнень.
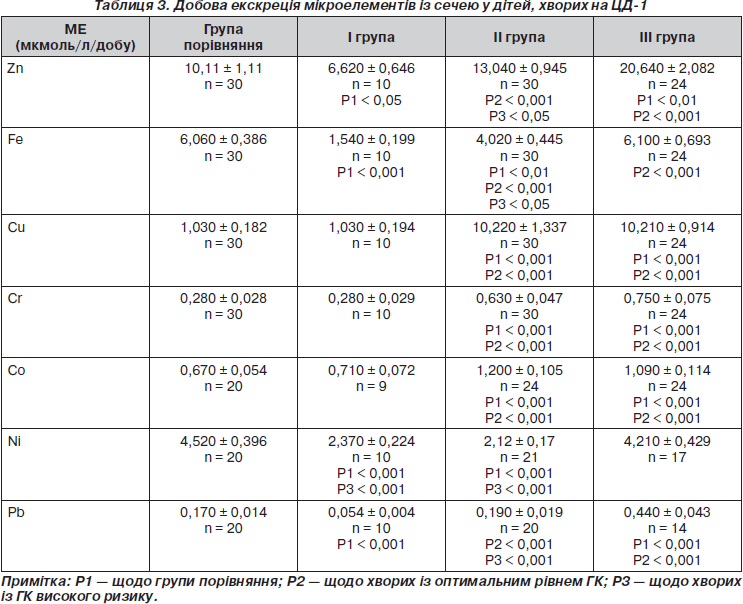
У результаті дослідження добової екскреції МЕ встановлено, що діти I групи за добу втрачають заліза на 75 %, кобальту — на 47,6 % та цинку — на 34,5 % менше, а кобальту — на 6 % більше порівняно зі здоровими (табл. 3). Виділення міді та хрому не відрізнялось від показників групи порівняння. Добова екскреція свинцю у дітей I групи була на 68,2 % меншою щодо групи порівняння та на 87,7 % нижчою, ніж у дітей із ГКВР.
У хворих із субоптимальним рівнем ГК добова екскреція МЕ збільшувалася. Зокрема, Cu — на 90 %, Cr — на 66 %, кобальту — на 44 %, Zn — на 23 % та Pb — на 7 % порівняно зі здоровими дітьми. Виділення Ni та Fe за добу, навпаки, було зниженим. Так, у дітей II групи добова екскреція нікелю була меншою на 53 %, а заліза — на 34 %, ніж у групі порівняння (табл. 3), що підтверджує літературні дані про їх синергізм [4].
У дітей III групи стабільно високою була втрата МЕ. Так, для міді вона була у 10 разів, хрому — на 63 %, цинку — на 52 % та кобальту — на 39 % більшою відносно групи порівняння (табл. 3). Добова екскреція нікелю та заліза практично не відрізнялась від показників здорових дітей. Слід зауважити, що виділення свинцю у даної категорії обстежених було найвищим, причому на 61,4 % більшим, ніж у групі порівняння, та на 87,7 % вищим відносно I групи.
Таким чином, виявлена значна добова втрата есенційних МЕ з сечею в обстежених дітей II та III групи, що може бути однією з причин сироваткового та клітинного дефіциту. З іншого боку, існує гіпотеза щодо нефротоксичності металів із перемінною валентністю (Co, Cu, Fe, Сr, Ni) у великих концентраціях. Внутрішньоклітинна токсичність зазначених МЕ зумовлена активацією процесів перекисного окислення ліпідів у реакціях Фентона і Вейса — Габера та виснаженням глутатіону [6, 7]. Причому найбільш чутливим до оксидативного стресу є нефротелій проксимальних канальців, оскільки тут інтенсивно відбуваються процеси реабсорбції та секреції.
Найвищий рівень екскреції свинцю встановлений у дітей із субоптимальним рівнем ГК та ГКВР. Через властивість поглинати та накопичувати двовалентні метали нирки є першим органом — мішенню токсичної дії важких металів. Причому ступінь ураження нирок залежить від дози та тривалості дії токсичного МЕ [2]. Під дією хронічної свинцевої інтоксикації в структурах нирок відбувається морфологічна перебудова. В експериментах на тваринах встановлено, що високі концентрації свинцю в сечі викликають втрату мікроворсинок нефротелію проксимальних ниркових канальців, що призводить до зменшення загальної реабсорбційної поверхні [8].
Існують літературні дані, що гіпертрофія та гіперфункція клубочків при діабетичній нефропатій можуть бути вторинними, викликаними підвищеним осмолярним навантаженням на тубулярні клітини при гіперглікемії за механізмом тубулогломерулярного зворотного зв’язку [9]. Таким чином, підвищена концентрація МЕ у сечі в поєднанні з неферментативним глікозилюванням білків ниркових мембран може бути одним із факторів ураження канальців, сприяти розвитку та прогресуванню діабетичної нефропатії. У свою чергу, посилене виведення МЕ із сечею може призводити до мікроелементозу.
Висновки
1. У разі ЦД-1 у дітей дуже рано, навіть у випадку оптимального рівня глікемічного контролю, виникає підвищена втрата мікроелементів із сечею.
2. Екскреція мікроелементів та їх дисбаланс суттєво зростають у дітей у міру погіршення рівня глікемічного контролю.
1. Диагностика диабетической нефропатии у детей и подростков / М.В. Пермитина, В.А.Воробьева, Г.В. Бабаш [и др.] // Российский педиатрический журнал. — 2005. — № 6. — С. 44-47.
2. Effect of heavy metals on, and handling by, the kidney / O. Barbier, G. Jacquillet, M. Tauc [et al.] // Nephron. Physiol. — 2005. — Vol. 99(4). — P. 105-110.
3. Acute study of interaction among cadmium, calcium, and zinc transport along the rat nephron in vivo / O. Barbier, G. Jacquillet, M. Tauc [et al.] // Am. J. Physiol. Renal. Physiol. — 2004. — Vol. 287(5). — P. 1067-1075.
4. Лобода А.М. Мікроелементні порушення у дітей / А.М. Лобода // Современная педиатрия. — 2009. — № 1(23). —
С. 89-92.
5. Смоляр В.І. Аліментарні гіпо- та гіпермікроелементози / В.І. Смоляр, Г.І. Петрашенко // Проблеми харчування. — 2005. — № 4. — С. 40-42.
6. Sabolic I. Common mechanisms in nephropathy induced by toxic metals / I. Sabolic // Nephron. Physiol. — 2006. —
Vol. 104(3). — P. 107-114.
7. Valko M. Metals, toxicity and oxidative s tress / M. Valko,
H. Morris, M.T. Cronin // Cur. Med. Chem. — 2005. — Vol. 12(10). — P. 1161-1208.
8. Herak-Kramberger C.M. The integrity of renal cortical brush-border and basolateral membrane vesicles is damaged in vitro by nephrotoxic heavy metals / C.M. Herak-Kramberger, I. Sabolic // Toxicology. — 2001. — Vol. 2. — P. 139-47.
9. Красовська К.О. Канальцеві дисфункції при діабетичній нефропатії: Автореф. дис... канд. мед. наук: спец. 14.01.02 «Внутрішні хвороби» / К.О. Красовська. — Харків, 2005. — 19 с.