Журнал «Здоровье ребенка» 3 (30) 2011
Вернуться к номеру
Новые подходы к лечению детей с ацетонемическим синдромом
Авторы: Дука Е.Д., Ярошевская Т.В., Недава О.А., Сапа Н.Б. Днепропетровская государственная медицинская академия Детская городская клиническая больница № 2, г. Днепропетровск
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье изложены результаты собственного опыта проведения метаболической коррекции у детей с ацетонемическим синдромом. Показана эффективность препарата Стимол®. На основании результатов оценки клинической эффективности даны рекомендации по использованию препарата Стимол® в комплексном лечении детей с ацетонемическим синдромом.
Ацетонемический синдром, лечение, дети, Стимол®.
В детском возрасте особого внимания требуют функциональные расстройства органов пищеварения, связанные с нарушением нейроэндокринной регуляции, как возможная основа для формирования органической патологии в дальнейшем. К таким заболеваниям можно отнести ацетонемический синдром, широко обсуждаемый в последние годы в литературе. В зарубежной литературе, а также в МКБ-10 данный синдром как отдельная нозологическая единица не выделяется, но в XVIII разделе МКБ-10 под рубрикой R11 представлен синдром циклической рвоты (CVS). Патогенетически и клинически эти два синдрома весьма близки, что, по-видимому, в последующем будет способствовать их конвергенции [3, 5, 6].
Под ацетонемическим синдромом понимают совокупность симптомов, обусловленных повышенным содержанием в крови продуктов неполного окисления жирных кислот, образующихся при распаде кетогенных аминокислот: ацетона, ацетоуксусной кислоты и g-оксимасляной кислоты [2, 3]. Различают первичный и вторичный ацетонемический синдромы. У детей целый ряд заболеваний сопровождается гиперкетонемией. К ним, в частности, относятся сахарный диабет, ренальная глюкозурия, гликогенозы, тиреотоксикоз, инфекционный токсикоз, токсические поражения печени, гиперинсулинизм, черепно-мозговые травмы, болезнь Иценко — Кушинга, лейкемия, гемолитическая анемия. Клиническая картина ацетонемического синдрома в таких случаях определяется основным заболеванием, а кетонемию и проявления типичной или атипичной подагры следует рассматривать как вторичный ацетонемический синдром.
Первичный ацетонемический синдром у детей считается манифестной формой мочекислого диатеза или нервно-артритической аномалии конституции (НААК) и относится к дисметаболическим генетически детерминированным патологическим состояниям. Заболевание характеризуется перманентной гиперурикемией, повышенной возбудимостью нервной системы и периодическими метаболическими кризами с гипогликемическим кетоацидозом, гиперкетонемией, кетонурией, дисэлектролитемией. В генезе заболевания определенную роль играет ферментопатия, результатом которой является недостаточная утилизация углеводов и жиров из пищи. Первичный ацетонемический синдром встречается у 4–6 % детей в популяции и у 50 % детей с НААК, обычно в возрасте от 1 года до 12 лет. Очень часто (почти в 90 % случаев) в структуре кризов наблюдается многократная рвота, которая определяется как ацетонемическая [2–4].
Дети с НААК характеризуются следующими особенностями:
— повышенной возбудимостью и быстрой истощаемостью нервной системы на всех уровнях рецепции с наличием доминантного очага застойного возбуждения в гипоталамо-диэнцефальной области;
— недостаточностью ферментов печени (глюкозо-6-фосфатазы, гипоксантин-гуанин-фосфорибозилпирофосфатсинтетазы);
— низкой ацетилирующей способностью ацетилкоэнзима А вследствие дефицита щавелевой кислоты;
— нарушением механизма повторного использования мочевой и молочной кислот;
— нарушением жирового и углеводного обмена;
— нарушением эндокринной регуляции метаболизма.
Согласно классическим представлениям, такие дети отличаются повышенной возбудимостью, эмоциональной лабильностью, нарушением сна. К концу первого года жизни они обычно заметно отстают в массе тела от сверстников. Нервно-психическое развитие, напротив, опережает возрастные нормы. Начиная с 2–3-летнего возраста отмечаются эквиваленты подагрических приступов и кризов в виде преходящих ночных болей в суставах, абдоминальных болей спастического характера, дискинезий желчевыводящих путей и желудка, мигрени, ацетонемических кризов. Одним из типичных проявлений НААК является салурия с преимущественной уратурией. Ацетонемические кризы у большинства детей прекращаются после 10–12 лет. Однако сохраняется высокая вероятность развития таких патологических состояний, как подагрические кризы, дисметаболическая нефропатия, холепатия, вегетососудистая дистония по гипертоническому типу, артериальная гипертензия [2].
Как во время ацетонемического криза, так и при приступе циклической рвоты наблюдается многократная неукротимая рвота. Патогенез этих состояний во многом сходен.
Как правило, при синдроме циклической рвоты отмечаются тошнота, рвота с примесью желчи, боль в животе, головная боль, неприятные ощущения во время движения, повышенная чувствительность к свету и шуму, однако это характерно не для всех больных. Кроме того, у некоторых больных имеются лихорадка, бледность, повышенная потливость, диарея, дегидратация, гиперсаливация, повышенное артериальное давление [5, 6].
В настоящее время синдром циклической рвоты рассматривается как полиэтиологическое заболевание, в основе которого лежат нарушения гипоталамо-гипофизарно-надпочечниковой системы (повышение секреции кортикотропин-рилизинг-фактора) и вегетативная дисфункция (симпатикотония). Многочисленные исследования показали, что инфекционные, психологические, физические стрессы могут вызывать приступы рвоты. Перед началом рвоты наблюдается значительное увеличение уровня АКТГ и кортикотропина.
Перспективными являются представления о синдроме циклической рвоты как о митохондриальной патологии [5, 6, 8]. Поскольку митохондрии являются, образно выражаясь, энергетическими станциями клетки, при данном заболевании нарушается энергетический обмен. В условиях стресса и гипоксии энергетический обмен нарушается с преобладанием более быстрого анаэробного гликолиза, но при этом образуется только 2 молекулы АТФ, тогда как при аэробном — 38. Возникает дефицит энергии.
Такие нарушения тесно связаны с нарушениями пуринового обмена, поскольку энергия в организме хранится в виде нуклеотидов, среди которых аденин и гуанин являются пуриновыми, и они метаболизируются до мочевой кислоты, а тимин, цитозин и урацил являются пиримидиновыми и метаболизируются с образованием кетоновых тел — аммиака и бета-изомасляной кислоты [2, 5]. Данные представления патогенетически сближают синдром циклической рвоты и ацетонемический синдром, а также объясняют необходимость и возможные пути метаболической коррекции.
За рвотный акт отвечают две функционально различные структуры продолговатого мозга — рвотный центр в латеральной ретикулярной формации и хеморецепторная триггерная зона в ромбовидной ямке на дне четвертого желудочка. Поэтому механизмов тошноты и рвоты два. Первый связан с афферентной импульсацией от органов пищеварения непосредственно рвотного центра. Второй обусловлен стимуляцией триггерной зоны такими медиаторами, как серотонин, ангиотензин ІІ, вазоактивный интестинальный полипептид, дофамин, антидиуретический гормон и др., а также рядом лекарственных препаратов, эндотоксинами грамположительных бактерий.
Через вегетативные гипоталамические центры под воздействием стресса происходит активация жиромобилизующих гормонов (соматотропин, липотропин), что приводит к избыточному липолизу и кетогенезу, при этом образуется большое количество кетоновых тел.
Обоснование диагноза синдрома циклической ацетонемической рвоты требует тщательного изучения анамнеза, данных физикального и лабораторного исследования, чтобы исключить другие болезни, которые могут вызвать рвоту, сходную с CVS.
Лечение
Программы купирования ацетонемического криза хорошо известны. При начальных симптомах целесообразно очистить и промыть кишечник 1–2% раствором гидрокарбоната натрия и поить ребенка каждые 10–15 минут сладким чаем с лимоном, негазированной щелочной минеральной водой (лужанская, боржоми и др.), 1–2% раствором гидрокарбоната натрия, комбинированными растворами для оральной регидратации. Пища должна содержать легко усваиваемые углеводы и минимальное количество жира (жидкая манная или овсяная каша, картофельное пюре, молоко, печеные яблоки). Медикаментозная терапия включает спазмолитики, энтеросорбенты. В связи с задержкой стула применение диосмектита нецелесообразно.
В случае развития ацетонемического криза, сопровождающегося многократной или неукротимой рвотой, лечение направлено на коррекцию ацидоза, кетоза, дегидратации и дисэлектролитемии. При нарастающем эксикозе показана инфузионная терапия. В качестве инфузионных растворов используются 5–10% раствор глюкозы с инсулином и кристаллоидные натрийсодержащие растворы (0,9% раствор натрия хлорида, раствор Рингера) в соотношении 1 : 1 или 2 : 1 с учетом показателей водно-электролитного обмена. Общий объем вводимой жидкости составляет 50–60 мл/кг в сутки. Если ребенок пьет охотно, парентеральное введение инфузионных растворов может быть полностью или частично заменено оральной регидратацией, которая проводится комбинированными препаратами.
Лечение ацетонемического синдрома в межприступный период направлено на профилактику рецидивов ацетонемических кризов и проводится курсами, не менее 2 раз в год, как правило, весной и осенью. Могут назначаться гепатопротекторы, при частых и тяжело протекающих ацетонемических кризах с целью профилактики назначают производные урсодезоксихолевой кислоты.
Режимные ограничения у детей с НААК должны соблюдаться постоянно: достаточное пребывание на свежем воздухе, регулярные, строго дозированные физические нагрузки, водные процедуры (плавание, контрастный душ, обливание), достаточный по продолжительности сон (не менее 8 часов). Следует избегать инсоляции. Целесообразно сократить время просмотра телевизора и работы с компьютером. В диете должны преобладать молочнокислые продукты, каши, свежие овощи, фрукты, отварное мясо нежирных сортов.
Необходимо ограничить употребление продуктов, богатых пуринами и кетогенными аминокислотами. Из рациона исключаются мясо молодых животных, жирные сорта мяса, субпродукты, копчености, концентрированные бульоны. Противопоказаны щавель, цветная капуста, томаты, цитрусовые, напитки, содержащие кофеин [3, 4].
Несмотря на успешное применение патогенетически обоснованных дифференцированных схем в лечении ацетонемического синдрома у детей, эта проблема в настоящее время не теряет актуальности. Наряду с регидратационной терапией важным звеном в лечении синдрома является коррекция метаболических нарушений. С нашей точки зрения, с этой целью оправданно использование препарата Стимол® (Biocodex, Франция).
В последнее время накоплен положительный клинический опыт применения Стимола® для лечения первичного ацетонемического синдрома как в период приступа, так и в межприступный период [1–3].
Целью настоящего исследования стало изучение эффективности Стимола® в комплексной терапии ацетонемического синдрома у детей в кризовый период.
Материалы и методы
В состав препарата метаболического действия Стимол® входят две аминокислоты — малат и цитруллин, которые активизируют механизм образования энергии на клеточном уровне. В норме они всегда присутствуют в организме человека и являются катализаторами жизненно важных метаболических процессов. Малат — яблочная кислота, которая стимулирует цикл Кребса, принимает участие в процессе глюконеогенеза, уменьшает уровень лактата в крови и тканях, предупреждает лактат-ацидоз, способствует синтезу АТФ и является основным поставщиком энергии для метаболических процессов. Цитруллин — одна из аминокислот, которая входит в цикл мочевины. Цитруллин активирует образование и выведение аммиачных соединений из организма. Таким образом, Стимол® обеспечивает утилизацию лактата, аммиака и способствует образованию энергии, переводя клетку на другой энергетический уровень.
Исследования с целью оценки эффективности препарата Стимол® при первичном ацетонемическом синдроме у детей проводили на базе гастроэнтерологического отделения детской клинической больницы № 2 г. Днепропетровска. Нами были обследованы 37 детей с синдромом ацетонемической рвоты: 18 девочек и 19 мальчиков в возрасте от 3 до 12 лет (средний возраст 5,5 года), 10 из которых составили группу сравнения.
В основной группе на фоне базисной терапии назначали Стимол®, по 1/2 пакетика детям от 3 до 6 лет и по 1 пакетику детям старше 6 лет, 3 раза в день, растворяя содержимое в 100 мл теплой воды. Вводили препарат с первых часов после госпитализации дробно, маленькими порциями во избежание провоцирования рвотного рефлекса. Дети из группы сравнения получали только базисную терапию — диету, парентеральную и пероральную регидратацию, дезинтоксикационную терапию, энтеросорбцию, по показаниям — антибактериальные средства, спазмолитики, ферментные препараты.
Динамику клинических проявлений у детей в обеих группах оценивали по специально разработанной балльной шкале в зависимости от степени выраженности основных симптомов. Оценивали следующие показатели: признаки интоксикации, частоту рвоты, выраженность болевого абдоминального синдрома, диспептических проявлений, а также степень кетонурии в баллах от 0 до 4. Выраженность клинических проявлений по сумме баллов была прослежена в течение первых 7 дней лечения. Динамика выраженности кетонурии под влиянием назначенной терапии на протяжении первых суток прослеживалась каждые три часа. С этой целью использовали тест-полоски для быстрого выявления кетонов в моче. Принцип определения основан на реакции ацетоуксусной кислоты с нитропруссидом натрия, при этом цвет полоски изменяется с бежевого на красно-фиолетовый. Оценка результатов проводилась визуально путем сравнения реагентной полоски с цветовой шкалой, нанесенной на контейнер. Степень ацетонурии определяли от + до ++++ (или в баллах от 1 до 4).
Результаты и их обсуждение
Установлено, что чаще всего приступы ацетонемической рвоты провоцировались нарушением диеты (16,2 %), инфекционным заболеванием (29,7 %), обострением хронической патологии желудочно-кишечного тракта (21,6 %), психологическим, чаще позитивным, стрессом (32,4 %). Фоновыми патологиями были функциональная диспепсия (8,1 %), синдром раздраженного кишечника (5,4 %), дискинезия желчевыводящих путей (83,8 %), хронический холецистохолангит (5,4 %), панкреатопатии (29,6 %), пищевая аллергия (18,9 %), вегетативные дисфункции (54 %). В большинстве случаев выявлена отягощенность перинатального анамнеза (патология течения беременности и родов, травматическое и гипоксическое поражение ЦНС). Семейный анамнез был отягощен наличием хронических заболеваний ЖКТ, желчнокаменной и мочекаменной болезнью, гипертонической болезнью у близких родственников.
При поступлении в стационар общее состояние у всех больных было тяжелым за счет дегидратации и симптомов интоксикации.
В клинике преобладали боли в животе, анорексия, вялость, тошнота, повторная рвота, повышение температуры тела, тахикардия. У 100 % детей реакция мочи на ацетон была позитивной. Уратурия была выявлена у 29,6 % детей, оксалурия у 21,6 %, уровень диастазы мочи и амилазы крови у обследованных детей оставался нормальным. Гипогликемия выявлена у 3 больных, гипохромная анемия — у 16,2 %, лейкоцитоз и нейтрофилез — у 13,5 %, лимфоцитоз — у 40,5 %. Уровни мочевины, креатинина, холестерина у всех детей были в пределах нормы. По данным копрограммы у 100 % детей выявлена функциональная недостаточность поджелудочной железы (стеаторея, амилорея от ++ до +++), по данным ультразвукового исследования — увеличение, зернистость, повышение эхогенности поджелудочной железы у 29,6 %, обращал на себя внимание выраженный метеоризм кишечника у 48,6 % пациентов.
С учетом роли нарушений энергетического обмена в развитии ацетонемического синдрома в комплексы терапии был обоснованно включен цитруллина малат. Это обусловлено его дезинтоксикационными (улучшение работы цитохромоксидазной системы, инактивация аммония, лактата), антигипоксическими (стимуляция работы цикла Кребса, переключение утилизации глюкозы на аэробный путь), антиацидотическими (ускорение утилизации лактата) свойствами.
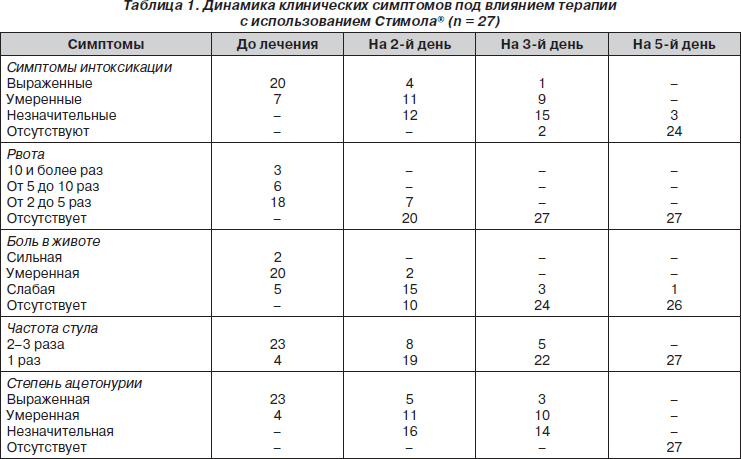
Под влиянием терапии происходило быстрое улучшение состояния детей за счет регресса основных клинических проявлений (табл. 1). Следует подчеркнуть, что с самого начала терапии скорость их редукции оказалась достоверно выше в основной группе.
Оценка состояния ребенка в баллах при поступлении в основной и в контрольной группе была приблизительно одинаковой и составила в среднем 9,18. Однако уже на второй день терапии с использованием Стимола® выраженность клинических проявлений составляла 5,64 балла, тогда как в контрольной группе — 6,08. На третий день в основной группе — 4,09 балла, в группе сравнения — 4,86 балла (P < 0,05). Темпы редукции основных симптомов заболевания свидетельствуют о высокой чувствительности пациентов к проводимой патогенетической терапии (рис. 1). Включение в терапию ацетонемического синдрома в приступном периоде Стимола® позволяло добиться более быстрого регресса основных симптомов к 3–4-му дню заболевания в зависимости от выраженности симптомов заболевания при поступлении. К седьмому дню состояние больных в обеих группах достоверно не отличалось в связи с полным регрессом основных патологических проявлений заболевания практически у всех больных.
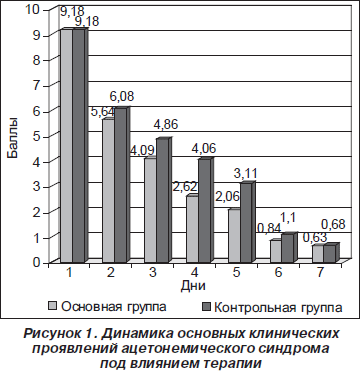
Учитывая, что наибольшие отличия в динамике патологических симптомов наблюдались именно в первые сутки заболевания, мы изучали выраженность кетонурии у детей основной и контрольной групп каждые 3 часа. Была продемонстрирована быстрая положительная динамика в основной группе. Так, уже через 3 часа от начала терапии с использованием Стимола® выраженность кетонурии уменьшилась у 75 % больных, а через 12 часов этот симптом был полностью купирован у 50 % больных. В контрольной группе динамика была значительно меньше. Через 3 часа — практически без изменений, через 12 часов снижение, но не купирование данного показателя достигнуто только у 20 % больных. Динамика выраженности ацетонурии в основной и контрольной группах на протяжении первых суток от начала терапии приведена на рис. 2.
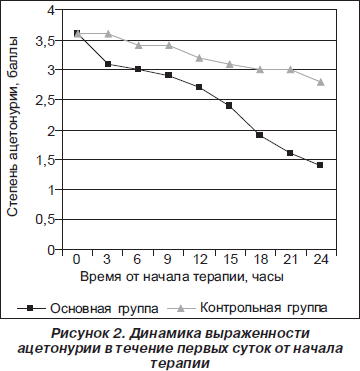
Таким образом, преимуществом включения цитруллина малата в комплексы терапии при ацетонемическом синдроме у детей являлась быстрота купирования основных симптомов заболевания, прежде всего быстрое купирование ацетонурии. Так, через 24 часа от начала терапии у половины больных ацетон в моче уже не выявлялся, у остальных детей удалось добиться снижения выраженности данного симптома. Нами были отмечены хорошая переносимость препарата у всех пациентов и отсутствие побочных эффектов.
Полученные результаты свидетельствуют об эффективности препарата Стимол® в комплексной терапии первичного ацетонемического синдрома в приступный период. Кроме того, с учетом особенностей метаболизма у детей с данным заболеванием и механизмов действия препарата, лечение Стимолом® показано также и в межприступный период весной и осенью по 1/2–1 пакетику в зависимости от возраста 2 раза в день на протяжении 2–3 недель для профилактики рецидива. Все дети контрольной группы выписаны с рекомендациями продлить лечение Стимолом® до 14 дней и в межприступном периоде провести повторный профилактичекий курс лечения Стимолом® на протяжении 14 дней в возрастных дозировках. Дизайн данного исследования не включал наблюдение в катамнезе, что в дальнейшем представляется актуальным. Предварительные результаты совпадают с данными литературы [1, 2], свидетельствующими, что продолжение лечения Стимолом® до 14 дней и повторный курс в межприступном периоде позволяет провести профилактику наступления рецидива. Максимальный срок наблюдения составил 6 месяцев, за это время по поводу повторных ацетонемических кризов дети, получавшие Стимол®, не обращались, в группе контроля — 1 случай рецидива из 10.
Выводы
1. При ацетонемическом синдроме у детей патогенетически обоснованным является включение в комплексы терапии препарата метаболического действия Стимол®.
2. Кетонурия, как один из важных маркеров метаболических нарушений при ацетонемическом синдроме, может быть купирована у половины больных детей в течение первых суток от начала терапии Стимолом®.
3. Об эффективности Стимола® свидетельствует более быстрый регресс основных клинических проявлений заболевания — тошноты, рвоты, анорексии, абдоминального болевого синдрома.
4. Отмечаются хорошая переносимость препарата, отсутствие побочных явлений.
5. Показатели эффективности терапии с использованием Стимола®, скорость наступления терапевтического эффекта и безопасность препарата позволяют рекомендовать Стимол® в комплексной терапии ацетонемического синдрома у детей в кризовый период, а также профилактическое его назначение в межприступном периоде.
1. Бережной В.В., Курило Л.В. Метаболическая коррекция у детей с ацетонемическим синдромом: Информационное письмо № 12. Выпуск 2 по проблеме «Педиатрия». — 2008.
2. Бережной В.В., Курило Л.В., Марушко Т.В., Капичена М.А. Эффективность метаболической коррекции ацетонемического синдрома у детей // Современная педиатрия. — 2009. — № 5(27). — С. 89-92.
3. Волосовец А.П., Кривопустов С.П., Кожина А.Н., Щербинская Е.Н. Ацетонемический синдром у детей: современный взгляд на проблему // Здоровье ребенка. — 2009. — № 6(21). — С. 76-81.
4. Казак С., Бекетова Г. Діагностика та дієтотерапія ацетонемічного синдрому у дітей // Ліки України. — 2005. — № 2. — С. 83-86.
5. Майданник В.Г. Синдром циклічної блювоти у дітей // Педіатрія, акушерство і гінекологія. — 2009. — № 3. — С. 5-13.
6. Сапа Ю.С. Синдром циклической рвоты у детей: «terra incognita» или Золушка отечественной педиатрии // Medicus amicus. — 2006. — № 2.
7. Stickler G.B. Relationship between cyclic vomiting syndrome and migraine // Clin. Pediatr. — 2005. — 44. — 505-8.
8. Salpietro C.D., Briuglia S., Merlino M.V. et al. A mitochondrial DNA mutation (A3243G mtDNA) in a family with cyclic vomiting // Am. J. Pediatr. — 2003. — 162. — 727-8.