Журнал «» 6(20) 2011
Вернуться к номеру
Інформаційний лист Європейського товариства артеріальної гіпертензії № 44, 2010. Первинний альдостеронізм
Авторы: Franco Mantero, Gian Paolo Rossi, Enrico Agabiti Rosei, Endocrine unit, Department of Medical and Surgical Sciences, University of Padua, Italy, Internal Medicine 4, Department of Clinical and Experimental Medicine, University of Padua, Italy, Clinica Medica, Department of Medical and Surgical Sciences, University of Brescia, Italy
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
Первинний альдостеронізм (ПА) — це поширена форма ендокринної гіпертензії, при якій продукція альдостерону є надлишковою і, крім того, частково автономною від ренін-ангіотензинової системи. Ця невідповідність продукції альдостерону призводить до затримки натрію в організмі та супресії реніну. Найбільш частими причинами ПА були аденома надниркових залоз, або білатеральна гіперплазія клубочкової зони кори надниркових залоз, або, в дуже рідкісних випадках, спадкове захворювання — глюкокортикоїдпригнічувальний альдостеронізм (ГПА), відоме також як сімейний гіперальдостеронізм типу 1 (СГ1).
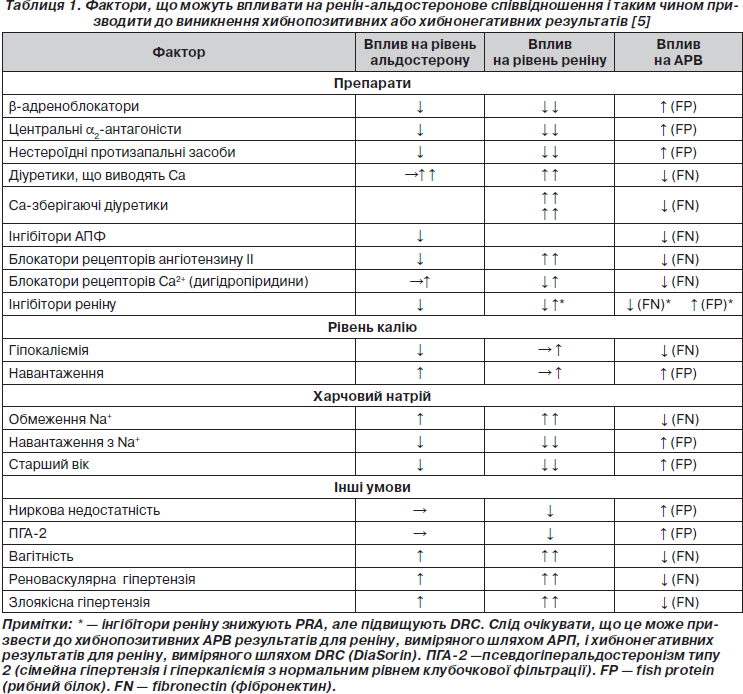
Існують помилки в уявленні про ПА. Раніше вважали, що ПА є причиною артеріальної гіпертензії менше ніж в 1 % пацієнтів, та, крім того, гіпокаліємію розцінювали як передумову для проведення діагностики з метою виявлення ПА [1]. Хоча в останніх дослідженнях, які проводились із застосуванням визначення відношення активності альдостерону плазми до активності реніну плазми (АРП/АРВ) як скринінг-тест у хворих із гіпертензією незалежно від наявності або відсутності гіпокаліємії, було виявлено набагато більшу поширеність даного захворювання серед населення, а саме: ПА зустрічається приблизно в 12 % всіх пацієнтів із гіпертензією. Також у нещодавно проведених дослідженнях було показано, що лише незначна частка пацієнтів із ПА (від 9 до 37 %) мала гіпокаліємію [2]. Таким чином, найбільш поширеною формою даного патологічного стану є артеріальна гіпертензія при збереженому нормальному рівні калію, а гіпокаліємія, можливо, виникає вже у більш тяжких випадках [3]. Кардинально важливо поставити ранній діагноз ПА не тільки через те, що ПА є досить поширеним, а й тому, що у разі ігнорування даного стану виникає необхідність у тривалому, довічному лікуванні пацієнтів і без адекватної діагностики та лікування у цих пацієнтів існує навіть більший ризик кардіоваскулярної захворюваності й смертності, ніж у хворих на есенціальну гіпертензію в поєднанні з такими факторами ризику, як вік, стать, група крові та рівень артеріального тиску, навіть враховуючи досить часто наявні в них гіпертрофію лівого шлуночка, фіброз, фібриляцію передсердь, інфаркт міокарда або гострі порушення мозкового кровообігу [4]. Насправді було доведено, що альдостерон потенціює розвиток ендотеліальної дисфункції, вивільнення норадреналіну, прогресування кардіоваскулярного фіброзу та протеїнурії незалежно від наявності підвищеного артеріального тиску. Більше того, існують специфічні препарати, які зменшують вплив даного патологічного стану та поліпшують прогноз для пацієнтів (табл. 1).
Діагноз
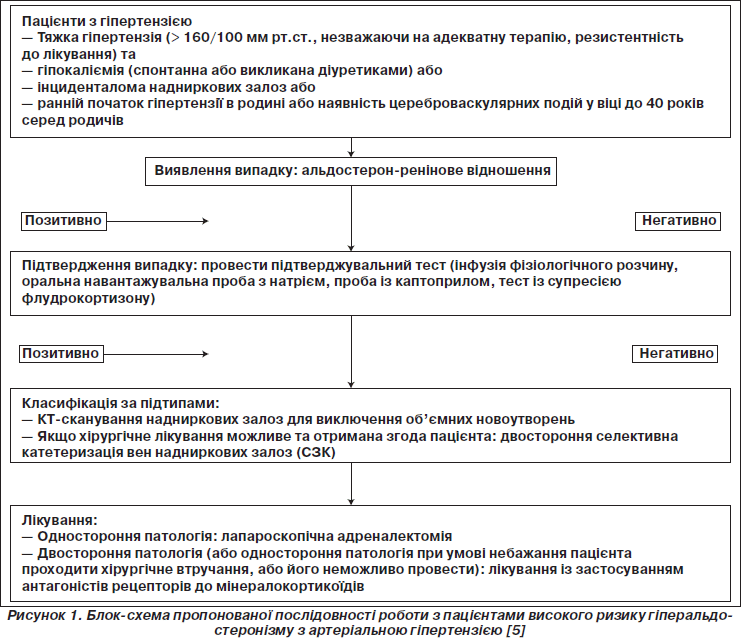
Зростання кількості випадків верифікації ПА як поширеного та важливого чинника розвитку артеріальної гіпертензії та причини виникнення кардіоваскулярних захворювань призвело до ренесансу поглядів на постановку діагнозу даної патології з боку клініцистів, що займаються лікуванням пацієнтів з артеріальною гіпертензією. Комітет клінічних рекомендацій Товариства ендокринологів [5] розробив практичні рекомендації з діагностики та лікування пацієнтів із ПА. Діагностику ПА було поділено на два різних напрямки, що включають виявлення, підтвердження випадку ПА та класифікацію його підтипів.
Виявлення випадку
Слід запідозрювати ПА у пацієнтів групи відносно високого ризику виникнення даної патології. Цю групу становлять пацієнти з артеріальною гіпертензією 2-го ступеня (> 160–179/100–109 мм рт.ст.), 3-го ступеня (> 180/110 мм рт.ст.) або з гіпертензією, що резистентна до лікування; гіпертензією на фоні спонтанної або спричиненої діуретиками гіпокаліємії; гіпертензією в поєднанні з інциденталомою надниркових залоз; а також із гіпертензією з раннім початком у сімейному анамнезі або наявністю цереброваскулярних подій у родичів у ранньому віці (< 40 років).
Альдостерон-ренінове відношення (АРВ) на даний момент є одним із найбільш вірогідних засобів для скринінгу ПА. Рекомендується відкорегувати гіпокаліємію, а також відмінити препарати, які можуть призвести до хибнопозитивних і хибнонегативних результатів, принаймні за 2–3 тижні до вимірювання АРВ. Так само, як і у випадках проведення інших біохімічних діагностичних тестів, у даній ситуації також можливо отримати хибнопозитивні і хибнонегативні результати, оскільки на рівень АРВ можуть впливати багато чинників (табл. 1) [3, 6]. Тому слід розглядати визначення АРВ лише як метод первинної діагностики, який слід повторити у випадку, коли попередні результати не є остаточними або їх важко інтерпретувати через недотримання оптимальних умов забору матеріалу. Слід також врахувати ще й те, що АРВ відображає кількісну інформацію, інакше кажучи, виявлення значного підвищення показників АРВ розглядається як важлива ознака ймовірності ПА, а отже, можливо, що і немає необхідності в подальшому проведенні селективної катетеризації вен надниркових залоз для підтвердження діагнозу, у той час як при пограничному підвищенні значень слід повторити дослідження або навіть провести додаткові уточнюючі.
За останні роки з метою оцінки діяльності ренін-альдостеронової системи більшого поширення набуло використання аналізу активності прямого реніну замість визначення активності реніну плазми (АРП). Але значною проблемою все ж залишається те, що існують важливі та різноманітні відмінності в одиницях вимірювання значень реніну та альдостерону в кожній окремій лабораторії, що доповнюється відсутністю однорідності в діагностичних протоколах та викликає істотні розбіжності у граничних значеннях, починаючи від 20 до 100 нг/дл для альдостерону та реніну, що вимірюється у нг/дл/год (або 68 на 338 пмоль/л для альдостерону та реніну в мОд/л) [7]. Проте більшість груп дослідників використовують межі 20–40 (для ALDO в нг/дл понад АРП в нг/мл/год) (68–135) матеріалу, зібраного амбулаторно вранці в положенні хворого сидячи. У найбільшому з усіх відомих досліджень використовували визначення АРВ лише як метод верифікації підтипу ПА, оскільки постановка остаточного діагнозу базувалась на вивченні критеріїв «чотирьох кутів»; з цієї позиції оптимальними граничними значеннями для АРВ (концентрація альдостерону плазми (КАП) в нг/дл, АРП в нг/мл/год) було обрано 25,86 [3].
Підтвердження випадку
При виявленні підвищення рівня АРВ слід провести додаткові тести для того, щоб остаточно підтвердити або виключити діагноз ПА [5]. У наш час для чіткої постановки діагнозу використовують чотири підтверджувальні тести: оральний тест навантаження з натрієм, інфузію фізіологічного розчину, тест із супресією флудрокортизону, а також пробу з каптоприлом. Ці чотири тести введено в рутинну практику, незважаючи навіть на те, що їх репрезентативність у кращому випадку відповідає рівню доказовості С за критеріями AHA, а отже, рекомендації щодо їх проведення є вкрай обмеженими. Більше того, на даний момент недостатньо прямих даних, щоб віддавати перевагу одному методу перед іншим. Ці тести, можливо, і відрізняються за рівнем чутливості, специфічності та надійності, але питання про вибір додаткового тесту, як правило, вирішується з урахуванням вартості, прихильності пацієнта, можливостей лабораторій та місцевих фахівців. Тому найбільш часто проводять пробу з інфузією фізіологічного розчину (2 л на 4 год) із найбільш відповідним для нього граничним значенням рівня альдостерону плазми крові понад 7 нг/дл [8]. Слід відмітити, що ті додаткові тести, які потребують орального чи внутрішньовенного навантаження із натрієм, необхідно дуже обережно призначати пацієнтам із неконтрольованою гіпертензією або застійною серцевою недостатністю. Оскільки всі ці тести виконуються із розрахунку на те, що продукція альдостерону напевне є автономною від ангіотензину ІІ, який при цьому не є причиною усіх альдостеронпродукуючих аденом (АПА), існує велика ймовірність отримання хибнонегативних або хибнопозитивних результатів при їх проведенні, і тому деякі експерти підтримують думку про недоцільність їх використання, адже в такому випадку багатьом пацієнтам не буде призначено необхідну для них адреналектомію із лікувальною метою.
Класифікація за підтипами
Усі пацієнти із первинним альдостеронізмом повинні проходити комп’ютерну томографію (КТ) надниркових залоз з метою первинної діагностики підтипу ПА, виключення наявності інших об’ємних утворень, таких як адренокортикоїдна карцинома, та з метою визначення правильного анатомічного положення вен надниркових залоз, що буде корисним для проведення надалі селективної катетеризації вен. Тому з цих міркувань КТ надниркових залоз не відіграє провідної ролі для остаточного диференціювання підтипу ПА. Насправді при КТ легко пропустити маленькі альдостеронпродукуючі аденоми, з іншого боку, можна розцінити нефункціонуючі аденоми (інциденталоми) як «винуватців» ПА, у той час як замість останніх істинною причиною може бути КТ-недиференційована АПА або однобічна гіперплазія надниркової залози з протилежного боку. Більше того, мікроаденоми надниркових залоз, що візуалізуються, насправді можуть являти собою ділянки гіперплазії надниркових залоз, а тому одностороння адреналектомія в даному випадку буде малоефективною. Крім того, нефункціонуючі односторонні макроаденоми надниркових залоз не є рідкісним явищем, особливо у старших осіб (> 40 років), і на КТ-знімках не відрізняються від АПА. Односторонню гіперплазію надниркової залози (ОГН) також неможливо візуалізувати при КТ. Магнітно-резонансна томографія (МРТ) не має переваг перед КТ у визначенні підтипу ПА, але є більш дорогою та спричинює більше артефактів унаслідок рухів пацієнта, ніж КТ.
Вирішальним при виборі тактики ведення хворих із ПА є визначення того, з якого боку локалізується джерело надмірної секреції альдостерону. Методи візуалізації не придатні для побудови точного зображення мікроаденом або для того, щоб вірогідно відрізнити АПА від інциденталом, що робить селективний забір крові (СЗК) із вен надниркових залознайбільш вдалим методом диференціації односторонньої форми ПА від двосторонньої.
Слід розуміти, що СЗК пропонують пацієнту лише в тих випадках, коли планується хірургічне втручання і є згода пацієнта на нього. Чутливість та специфічність СЗК (95 і 100 % відповідно) для визначення односторонньої надлишкової продукції альдостерону значно перевищує чутливість і специфічність КТ надниркових залоз (78 та 75 % відповідно) [10].
Однак СЗК може бути важкою процедурою, особливо при катетеризації правої вени надниркових залоз (яка є меншою за ліву та частіше впадає в нижню порожнисту, а не в ниркову вену). Скоротити час втручання та покращити успіх процедури можна при відповідному досвіді ангіографіста [9]. У наш час використовують три протоколи СЗК: 1) послідовна нестимульована або одночасна двостороння СЗК; 2) нестимульована послідовна чи одночасна двостороння СЗК, а потім послідовна або одночасна двостороння СЗК, стимульована шляхом болюсного введення косинтропіну, та 3) тривала інфузія косинтропіну з послідовною двосторонньою СЗК. На даний момент немає чітких рекомендацій що переваги якогось окремого протоколу, а також недостатньо даних про вплив СЗК на подальший перебіг захворювання [11]. Необхідно визначити деякі форми стратифікації пацієнтів, за допомогою яких було б можливо первинно розподілити пацієнтів на тих, кому показані хірургічні методи лікування, і тих, які можуть отримувати ефективну медикаментозну терапію із використанням антагоністів рецепторів до мінералокортикоїдів. У повсякденній практиці слід оцінювати користь СЗК окремо в кожному випадку, питаючи себе, як це покращить піклування про пацієнта, а власне дослідження необхідно проводити в центрах передового досвіду для досягнення найбільшої чутливості методу [12].
Інші скринінг-тести
— Тест із поступальним навантаженням. Деякі експерти використовують тест із поступальним навантаженням у пацієнтів після невдалого СЗК або у пацієнтів, у яких КТ-сканування виявило одностороннє об’ємне утворення надниркової залози. Цей тест, розроблений ще в 70-х рр., базувався на тій знахідці, що у пацієнтів з АПА КАП мала мінливий добовий характер і була відносно стійкою до впливу зміни рівнів ангіотензину ІІ, у той час як при ідіопатичному гіперальдостеронізмі (ІГА) посилюється чутливість КАП до найменших змін у концентрації ангіотензину ІІ, що виникають у положенні стоячи. В останніх повідомленнях було показано, що точність даного методу близько 85 %. Недостатню точність тесту можна пояснити тим, що деякі АПА є чутливими до ангіотензину ІІ, а в деяких пацієнтів з ІГА секреція альдостерону змінюється протягом доби. Таким чином, тест із поступальним навантаженням може бути допоміжним засобом, наприклад, у пацієнтів після невдалої СЗК, а також в осіб, у яких КТ виявила одностороннє об’ємне утворення надниркових залоз [13].
— Сцинтиграфія з йодохолестеролом. Сцинтиграфія з I131-19-йодохолестеролом вперше була проведена в ранніх 70-х рр., а в 1977 р. було запропоновано покращений агент — 6b-I131-йодометил-19-норхолестерол (NP-59). Сканування з NP-59, виконане на фоні супресії дексаметазоном, має очевидні переваги у виявленні зв’язку порушення функції з анатомічними аномаліями. Але чутливість даного тесту значно залежить від розміру аденоми, що робить цей метод непридатним для інтерпретації мікронодулярних знахідок, виявлених під час КТ із високим ступенем роздільності, а отже, на думку більшості центрів, і не відіграє провідної ролі у визначенні підтипу ПА [14]. Більше того, брак радіоактивного індикатора в наш час робить цей тест неможливим для більшості центрів.
— Визначення рівнів 18-гідроксикортикостерону. 18-гідроксикортикостерон утворюється шляхом 18-гідроксилювання кортикостерону. Рівень 18-гідроксикортикостерону плазми крові у пацієнтів з АПА в стані спокою, як правило, понад 100 нг/дл на 8:00 год, у той час як у пацієнтів з ІГА зазвичай менший за 100 нг/дл. Але для введення даного тесту в клінічну оцінку підтипів ПА йому не вистачає точності [5].
— Тестування на сімейні форми ПА (СГ 1-го типу — глюкокортикоїдзалежний гіперальдостеронізм (ГЗГ)). Серед усіх випадків ПА питома вага СГ1 становить менше ніж 1 % від усіх випадків. Це захворювання передається за автосомно-домінантним типом. Часто його діагностують у пацієнтів із початком ПА раніше ніж у 20 років і у тих, хто має сімейний анамнез ПА або випадків гострих порушень мозкового кровообігу у родичів у молодому віці. Методи Southern blot [15] або полімеразної ланцюгової реакції для генетичного аналізу є чутливими та специфічними методами діагностики для ГЗГ. СГ-2 синдром клінічно не відрізняється від несімейного ПА. Це автосомно-домінантне порушення. При цьому тест на мутацію ГЗГ буде негативний. Крім того, поширеність даного захворювання не була встановлена. Але був показаний зв’язок із локусом хромосоми 7р22 [16].
— Ще один метод, який в даний момент ще випробовується з метою визначення ділянки підвищеної продукції альдостерону, передбачає використання позитронно-емісійної томографії з С11-метомідатом. Але все ще залишається недоведеним, чи буде даний метод чутливим у виявленні більшості дрібних АПА, як уже зазначалось вище.
Лікування
Тактика вибору при підтвердженій однобічній ПА (альдостеронпродукуюча аденома або однобічна гіперплазія надниркової залози) — одностороння лапароскопічна адреналектомія, тоді як лікування антагоністами мінералокортикоїдних рецепторів більше показане пацієнтам із двостороннім захворювання надниркових залоз (ідіопатична гіперплазія надниркових залоз, двосторонні АПА, ГЗГ).
Хірургічне лікування пацієнтів з одностороннім ПА призводить до нормалізації концентрації калію в сироватці крові майже в 100 % випадків після операції [5] за умови, що діагноз був виставлений і рішення про оперативне лікування було прийняте на основі даних, отриманих при СЗК. Зниження артеріального тиску (< 140/90 мм рт.ст. без допомоги гіпотензивних препаратів) реєструється приблизно в 50 % (від 35 до 60 %) пацієнтів з АПА після односторонньої адреналектомії, з ефективністю лікування понад 56–77 %, коли порогом лікування був тиск, менший 160/95 мм рт.ст. [5].
Фактори, що поліпшують прогноз регресії гіпертензії в післяопераційному періоді, включають наявність не більше одного родича з артеріальною гіпертензією першого ступеня, передопераційну терапію одним або двома антигіпертензивними препаратами [17], знання про тривалість артеріальної гіпертензії, а також наявність ознак ремоделювання судин [18]. Якщо порівнювати із порожнинною адреналектомією, лапароскопічна адреналектомія має менше ускладнень і потребує менш тривалого перебування хворого у стаціонарі [19].
У пацієнтів, у яких неможливо з певних причин виконати оперативне втручання, і у пацієнтів із двостороннім ураженням надниркових залоз показана така медикаментозна терапія:
— антагоністи мінералокортикоїдних рецепторів ефективно контролюють артеріальний тиск і забезпечують захист органів-мішеней;
— спіронолактон був препаратом вибору в лікуванні ПА понад чотирьох десятиліть. Є декілька досліджень у пацієнтів з МГА, що повідомили про середнє зниження систолічного артеріального тиску на 25 % і діастолічного артеріального тиску на 22 % на фоні спіронолактону 50–400 мг/добу протягом 1–96 місяців [5]. Частота гінекомастії внаслідок прийому спіронолактону є дозозалежною, у той час як залишається невідомою частота виникнення менструальних порушень у жінок в пременопаузі на фоні терапії спіронолактоном. По можливості слід розглядати перспективи використання канренону (активний метаболіт спіронолактону) або канреноату калію, оскільки вони, можливо, мають менше побічних ефектів, пов’язаних із діяльністю стероїдних статевих гормонів. Крім того, можливо додавати тіазидні діуретики в невеликих дозах, такі як тріамтерен, амлопірид, для того, щоб уникнути використання високих доз спіронолактону, які викликають побічні ефекти. Початкова доза спіронолактону має бути 12,5–25 мг на добу разово. Мінімальну ефективну дозу необхідно підбирати шляхом повільного титрування до максимальної дози 100 мг/добу;
— еплеренон — новий селективний антагоніст мінералокортикоїдних рецепторів без антиандрогенних ефектів та антагонізму до прогестерону, що дозволяє знизити рівень побічних ендокринних ефектів. Еплеренон має 60 % від потужності антагонізму спіронолактону до мінералокортикоїдних рецепторів; слід віднайти баланс між найкращим профілем його переносимості та значною вартістю, оскільки менша тривалість дії вимагає багаторазового щоденного дозування, крім того, немає поточних клінічних досліджень стосовно досвіду його застосування при ПА [20]. Початкова доза для еплеренону становить 25 мг один або два рази на день.
Інші препарати
Вплив на діяльність натрієвих каналів епітелію в дистальних трубчастих канальцях — основний механізм, за допомогою якого альдостерон виконує регуляцію рівнів калію та натрію в організмі. Амлопірид має найбільшу доказову базу в лікуванні ПА з усіх доступних антагоністів епітеліальної резорбції натрію. Хоча амлопірид і не настільки ефективний, як спіронолактон, у даному випадку він стає в нагоді. Навіть при тому, що амлопірид не має вираженої функцієї покращення стану ендотелію, це калійзберігаючий діуретик, а тому позитивно впливає на рівень артеріального тиску і концентрацію калію сироватки крові в пацієнтів із ПА і, як правило, добре переноситься хворими, адже не викликає подібних до спіронолактону побічних ефектів, пов’язаних із статевими стероїдними гормонами [21]. Блокатори кальцієвих каналів, інгібітори ангіотензинперетворюючого ферменту та блокатори рецепторів ангіотензину були ефективними у дуже рідкісних випадках, а в цілому можна сказати, що це антигіпертензивні препарати без вираженого впливу на підвищену продукцію альдостерону. Дослідження, що проводились із застосуванням даної терапії, малі й методологічно недосконалі; крім того, у них не оцінювали важливі для пацієнта наслідки. Перспективним залишається застосування інгібіторів синтезу альдостерону.
Переклад О.О. Торбас