Журнал «Здоровье ребенка» 8 (35) 2011
Вернуться к номеру
Стан мікробіоценозу кишечника та оцінка ефективності застосування Лактовіту форте при гострих обструктивних бронхітах у дітей раннього віку
Авторы: Сміян О.І., Слива В.В., Мощич О.П., Козлова К.Г., Белай Л.В., Потапова О.О.
Рубрики: Педиатрия/Неонатология
Версия для печати
У статті розглянуті питання порушення біоценозу кишечника в дітей раннього віку при гострому обструктивному бронхіті. Авторами встановлено, що в більшості пацієнтів спостерігалися порушення мікробіоценозу товстої кишки у вигляді диспепсії й больового синдрому. Під час дослідження вивчено ефективність застосування в комплексній терапії гострого обструктивного бронхіту препарату Лактовіт форте. Доведено, що застосування препарату сприяє поліпшенню динаміки клінічних симптомів бронхіту й дисбактеріозу кишечника. Під час дослідження відзначена добра переносимість препарату й відсутність побічних ефектів.
Summary. The paper considers the items on intestinal microbiocenose disorders in infants with acute obstructive bronchitis. The authors found the majority patients to have large intestine microbiocenose disorders manifested as dyspepsia and pain syndrome. The study aimed to study the effectiveness of Laktovit Forte added into a complex therapy of acute obstructive bronchitis. The medication use was proved to improve the dynamics of bronchitis clinical symptoms and intestinal dysbacteriosis. The study demonstrated a good tolerance of a medication and absence of side effects.
Резюме. В статье рассмотрены вопросы нарушения биоценоза кишечника у детей раннего возраста при остром обструктивном бронхите. Авторами установлено, что у большинства пациентов наблюдались нарушения микробиоценоза толстой кишки в виде диспепсии и болевого синдрома. В ходе исследования изучена эффективность применения в комплексной терапии острого обструктивного бронхита препарата Лактовит форте. Доказано, что применение препарата способствует улучшению динамики клинических симптомов бронхита и дисбактериоза кишечника. В ходе исследования отмечена хорошая переносимость препарата и отсутствие побочных эффектов.
Гострий обструктивний бронхіт, мікробіоценоз, Лактовіт форте.
Key words: acute obstructive bronchitis, microbiocenose, Laktovit Forte.
Ключевые слова: острый обструктивный бронхит, микробиоценоз, Лактовит форте.
Хвороби органів дихання у дітей знаходяться в центрі уваги педіатрів не тільки в Україні, але й у всьому світі. Вони займають більше 60 % у структурі дитячої захворюваності. Проблема гострих запальних захворювань органiв дихання, зокрема гострого обструктивного бронхiту у дiтей раннього вiку, залишається актуальною у педiатричній практиці в зв’язку зi значною поширеністю (250 випадкiв на 1000 дiтей) і стабільним ростом кількості хворих за останні роки (за 10 років захворюваність зросла в 3,6 раза) [1, 2].
Захворювання органів дихання залишаються провідною причиною смерті дітей першого року життя (21,8 на 10 000 народжених) і дітей віком від 1 до 4 років (55,6 на 100 тис. дітей цього віку порівняно з 2,6 на 100 тис. дітей віком від 5 до 9 років). За даними ВООЗ, у світі щороку від респіраторної патології помирає 2,2 млн дітей. Найбільш поширеними причинами смерті є пневмонія — основне ускладнення бронхіту в ранньому дитячому віці, а також пізня діагностика і несвоєчасно призначена терапія.
Бронхіт є найбільш частою патологією серед гострих і рецидивуючих захворювань нижніх дихальних шляхів у дітей. При цьому пік захворюваності реєструється у віці до 3 років. На першому році життя захворюваність становить 75, а до 3 років — 200 на 1000 дітей [3, 4].
За даними різних авторів, приблизно в 20–25 % випадків бронхіт у дітей перебігає як гострий обструктивний бронхіт, що істотно вище, ніж у дорослих [3, 5]. Найбільш часто гострі обструктивні бронхіти зустрічаються у дітей раннього віку.
Високі показники захворюваності й смертності дітей від респіраторної патології виявляють необхідність активного пошуку нових науково обґрунтованих заходів з оптимізації діагностики, лікування та профілактики обструктивних бронхітів у дітей раннього віку з урахуванням сучасних відомостей про складні патогенетичні й біохімічні процеси, що відбуваються в організмі дитини.
Однією з унікальних систем, що забезпечують постійність внутрішнього середовища макроорганізму, є кишкова мікрофлора. Наявність у кишечнику збалансованого співвідношення й оптимальної кількості аеробних і анаеробних мікроорганізмів забезпечує ряд найважливіших функцій: стримує ріст і розмноження умовно-патогенних мікробів, бере участь у синтетичній, травній та дезінтоксикаційній функції кишечника; стимулює синтез біологічно активних речовин, що впливають на функцію травного тракту, печінки, серцево-судинної системи, органів кровотворення та ін.; підтримує високий рівень лізоциму, імуноглобулінів, інтерферону та інших компонентів імунної системи (Н.В. Харченко, В.В. Черненко, 2007).
Процес становлення нормальної мікрофлори кишечника в дітей від народження до 3 років перебігає повільно і залежить від безлічі факторів, що можуть негативно позначитися на складі нормальної мікрофлори і спричинити надмірний ріст умовно-патогенних мікроорганізмів — дисбіоз — першопричину численних захворювань і патологічних станів.
На жаль, сучасна медицина не завжди враховує необхідність підтримання симбіозу дитини з його мікрофлорою. Більшість методів лікування гострих обструктивних бронхітів у дітей раннього віку, що включають використання противірусних, відхаркувальних, антигістамінних препаратів, мають негативний вплив на біоплівки, зокрема, за рахунок руйнування муцинового шару, пригнічення росту найбільш цінних лакто- і біфідокомпонентів і збільшення кількості умовно-патогенної флори.
Провідна роль у розвитку порушень біоценозу кишечника, за даними фахівців, належить антибіотикотерапії, яка, враховуючи переважно вірусну етіологію захворювання, на сьогоднішній день застосовується необґрунтовано широко [3, 4]. Відомо, що антибіотики, навіть при парентеральному введенні, призводять до мікроекологічних порушень внаслідок екскреції їх із жовчю, слиною, секретом бронхів та кишечника. Широке застосування її призводить до виникнення цілого ряду проблем, перш за все таких, як порушення якісного та кількісного складу мікрофлори кишечника.
Найбільш надійним і безпечним способом вирішення цієї проблеми є підтримання високого популяційного рівня нормальної мікрофлори за допомогою препаратів і біологічно активних добавок до їжі, що містять пробіотичні мікроорганізми у високій концентрації, що мають яскраво виражені антагоністичні властивості проти умовно-патогенних мікроорганізмів.
Мета роботи — дослідити якісні та кількісні зміни мікробіоценозу кишечника та вивчити ефективність застосування комбінованого препарату Лактовіт форте фірми «Мілі Хелскере Лтд.» (Великобританія) у дітей раннього віку, хворих на гострий обструктивний бронхіт.
Аналіз доступних на фармацевтичному ринку України лікарських засобів свідчить, що препарати, які містять представників лише основної мікрофлори (лакто- і біфідобактерії), представлені в невеликій кількості. Ряд препаратів містять мікроорганізми, які при певних несприятливих умовах (а дисбіоз сам по собі належить до несприятливих факторів) можуть призвести до серйозних ускладнень, наприклад до розвитку генералізованої кишкової інфекції (В.В. Бережний, С.А. Крамарєв та ін., 2002). Тому, використовуючи препарат, слід враховувати, яка мікрофлора входить до його складу, і віддавати перевагу тому, що містить мікроорганізми основної мікрофлори.
Лактовіт форте фармацевтичної компанії «Мілі Хелскере Лтд.» — комбінація лактобактерій Lactic Acid Bacillus (Bacillus coagulans (Lb. sporogenes)), фолієвої кислоти (вітамін В9) та ціанокобаламіну (вітамін В12). Препарат стійкий до дії високих температур, антибіотиків та кислого середовища шлунка, запобігає росту патогенних бактерій та сприяє стимуляції росту власної мікрофлори. Відомо, що при дисбіозі виникає дефіцит вітамінів унаслідок блокування ферментативних систем клітин, що призводить до зниження ендогенного синтезу вітамінів К і групи В, а також порушень їх всмоктування. Фолієва кислота та ціанокобаламін, що містяться в препараті, справляють синергічний відновлюючий вплив на слизову оболонку кишечника. Лактовіт форте здатний підвищувати рівень секреторного IgA і титри специфічних секреторних антитіл, підсилювати фагоцитоз, що обумовлює його репаративні та імуномодулюючі властивості.
Слід відмітити, що препарат використовується з лікувальною та профілактичною метою з перших днів життя, а зручна форма випуску у вигляді порошку дозволяє застосовувати його безпосередньо перед годуванням, розчинивши в молоці.
Матеріали й методи дослідження
Під спостереженням знаходилось 60 дітей віком від 1 місяця до 3 років, які перебували на стаціонарному лікуванні в КУ «Сумська міська дитяча клінічна лікарня» з приводу гострого обструктивного бронхіту. Дослідження проводилося в першу добу, при надходженні до стаціонару, і на 10–14-ту добу після відміни лікування.
Обстежених дітей було розподілено на шість груп. До І групи входили 20 дітей з гострим обструктивним бронхітом віком від 1 місяця до 1 року, серед них групу Іа становили 10 хворих, які отримували стандартну терапію (антибактеріальні, муколітичні, бронхолітичні, антигістамінні та інші симптоматичні засоби), а до групи Іб було зараховано 10 хворих, до лікування яких поряд з традиційними засобами був включений препарат Лактовіт форте у дозуванні 1/2 пакетика 2 рази на день.
До ІІ групи входило 20 дітей, хворих на гострий обструктивний бронхіт, віком від 1 року 1 місяця до 2 років. Серед них 10 пацієнтів, у яких використовували стандартне лікування, віднесено до ІІа групи та 10 хворих, що отримували терапію з додаванням пробіотика (1 пакетик 2 рази на день), становили ІІб групу.
ІІІ групу складали 20 пацієнтів віком від 2 років 1 місяця до 3 років, серед яких до ІІІа групи входило 10 дітей, які отримували лише традиційне лікування, а до ІІІб групи було зараховано 10 пацієнтів, які приймали, поряд із традиційними засобами, Лактовіт форте у добовій дозі 2 пакетики (1 пакетик 2 рази на день).
Контрольну групу становили 15 здорових дітей.
Ефективність застосування препарату Лактовіт форте оцінювали на підставі динаміки клінічних і лабораторних даних. Для вивчення дисбіотичних процесів кишечника проводили мікробіологічні дослідження випорожнень з визначенням видового та популяційного складу мікрофлори.
Результати дослідження
При надходженні до стаціонару в 100 % дітей з гострим обструктивним бронхітом визначався сухий нав’язливий кашель, який зберігався в середньому 4,63 ± 0,20 доби та переходив у вологий. Синдром інтоксикації проявлявся підвищенням температури тіла в 39 дітей (86,7 ± 5,12 %), загальною слабкістю, капризністю у 42 хворих (93,3 ± 3,67 %), втратою або зниженням апетиту в 35 (77,8 ± 6,27 %) пацієнтів. Катаральні явища у вигляді затрудненого носового дихання та нежитю спостерігались у 40 (88,9 ± 4,74 %) дітей. Явища дихальної недостатності (ДН) І ступеня були в 20 (44,4 ± 7,49 %) обстежених хворих. Серед фізикальних даних спостерігались такі: жорстке дихання у 45 (100 %), коробковий відтінок перкуторного звуку в 27 (60,00 ± 7,39 %), сухі свистячі та вологі різнокаліберні хрипи у 45 (100 %) хворих дітей.
У більшості пацієнтів (85,71 %) спостерігались клінічні прояви порушення мікробіоценозу товстої кишки у вигляді диспептичного та больового синдромів. Зригування відмічалось у 20 (44,40 ± 7,49 %) дітей, здуття живота та метеоризм — у 30 (66,70 ± 7,11 %), блювота — у 8 (17,80 ± 5,76 %), пронос — у 19 (42,20 ± 7,45 %), періодичний біль у животі — у 32 (71,10 ± 6,83 %) та нашарування на язиці — у 38 дітей (84,40 ± 5,46 %), хворих на гострий обструктивний бронхіт (табл. 1).
Отримані нами дані досліджень указують на ефективність застосування препарату Лактовіт форте у дітей раннього віку порівняно з традиційною терапією. Так, при його включенні до стандартної терапії кашель тривав на 1,16 дня менше (р < 0,05), прояви інтоксикації, такі як гарячка та загальна слабкість, зникали раніше на 1,18 (р < 0,05) та 1,14 (р < 0,05) дня відповідно. Катаральні явища в дітей, які не приймали пробіотик, зберігалися на 1,1 дня (р < 0,01) довше, ніж у дітей, що його застосовували. Використання пацієнтами Лактовіту форте також скорочувало тривалість фізикальних симптомів: жорсткого дихання — на 1,15 дня (р < 0,01), коробкового відтінку перкуторного звуку та хрипів — на 1,18 (р < 0,05) і 1,12 (р < 0,01) дня відповідно. Позитивна динаміка спостерігалась і щодо диспептичного та больового синдрому в дітей, яким, поряд з традиційними засобами, призначили пробіотик, дані дослідження вказують на зменшення їх тривалості в середньому на 1,33 доби порівняно з дітьми, які отримували лише стандартну терапію.
Вивчення мікрофлори кишечника при гострих обструктивних бронхітах у дітей всіх вікових груп виявило порушення якісного та/чи кількісного складу як анаеробних, так і аеробних представників. Спостерігалися різкі кількісні зміни анаеробної флори, які характеризувалися зниженням вмісту біфідо- та лактобактерій порівняно з показниками здорових дітей (табл. 2).
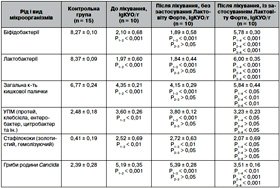
Так, у дітей першої вікової групи (від 1 міс. до 1 року) кількість біфідобактерій у гострому періоді хвороби була вірогідно нижчою — 2,40 ± 0,57 lgКУО/г, ніж у здорових осіб (8,27 ± 0,10 lgКУО/г) (р < 0,001). Вміст лактобактерій дорівнював 2,28 ± 0,64 lgКУО/г проти 8,37 ± 0,09 lgКУО/г в осіб контрольної групи (р < 0,001). Відзначалися також якісні й кількісні зміни в популяції ешерихій, які характеризувалися вірогідним зменшенням загальної кількості E.coli (5,43 ± 0,32 lgКУО/г) порівняно з групою контролю — 6,77 ± 0,24 lgКУО/г (р < 0,01). Видовий пейзаж умовно-патогенної мікрофлори у хворих на гострий обструктивний бронхіт відрізнявся від такого у здорових осіб. Найчастіше виявлялися гриби роду Candida, мікробна кількість яких становила 3,43 ± 0,19 lgКУО/г, а у здорових осіб — 2,39 ± 0,28 lgКУО/г (р < 0,01). Уміст стафілококів у дітей І вікової групи (золотистого та гемолізуючого) становив 0,99 ± 0,51 lgКУО/г, тоді як у здорових дітей він дорівнював 0,41 ± 0,51 lgКУО/г (р < 0,01). Крім того, в гострому періоді в дітей даної групи спостерігалось вірогідне збільшення (р < 0,01) кількості умовно-патогенних бактерій (Enterococcus faecalis, Enterobacter cloacae, Citrobacter, Klebsiella рneumoniae та ін.) до 3,08 ± 0,12 lgКУО/г порівняно з показниками здорових дітей — 2,48 ± 0,18 lgКУО/г.
Залежно від проведеної терапії в дітей І вікової групи з гострим обструктивним бронхітом у динаміці захворювання спостерігались такі зміни. У пацієнтів, які не отримували Лактовіт форте, відмічалось подальше зниження кількості біфідобактерій до 2,28 ± 0,42 lgКУО/г (р < 0,001), а серед хворих, що отримували пробіотик, нормальна кількість біфідобактерій (108) виділялась у 70 % хворих і цей показник (7,09 ± 0,38 lgКУО/г) був значно вищим, ніж у гострий період (2,40 ± 0,57 lgКУО/г; р < 0,001), та наближався до даних групи контролю. Схожі зміни відбувались і з показниками лактобактерій у дітей раннього віку з гострим обструктивним бронхітом. У пацієнтів Іа групи даний показник залишався низьким — 2,21 ± 0,38 lgКУО/г порівняно з дітьми при госпіталізації (р < 0,01), тоді як у хворих групи Іб спостерігалось вірогідне (р < 0,001) підвищення кількості лактобактерій у товстій кишці, яка досягала 6,84 ± 0,38 lgКУО/г.
Після проведення традиційного лікування у дітей першої вікової групи спостерігалась тенденція до зниження загальної кількості кишкової палички до 4,83 ± 0,44 lgКУО/г порівняно з даними до лікування — 5,43 ± 0,32 lgКУО/г (р > 0,05). У пацієнтів, які отримували пробіотик перед випискою зі стаціонару, загальний титр кишкової палички вірогідно нормалізувався і дорівнював 6,38 ± 0,40 lgКУО/г (р < 0,05). У динаміці стандартного лікування спостерігалось подальше збільшення кількості УПМ (р < 0,05). У групі дітей, які отримували Лактовіт форте, даний показник, навпаки, знижувався та наближувався до даних групи контролю (р > 0,05). У хворих після проведеної традиційної терапії зберігався високий титр грибів роду Сandida — до 4,80 ± 0,40 lgКУО/г та стафілокококів — 1,80 ± 0,67 lgКУО/г порівняно з даними в гострому періоді (р > 0,05), тоді як у дітей, до лікування яких було включено пробіотик, ці титри знижувалися і становили 3,43 ± 0,67 lgКУО/г (р < 0,001) та 0,99 ± 0,67 lgКУО/г (р > 0,05) відповідно.
Аналіз отриманих даних серед пацієнтів другої вікової групи (1 рік 1 міс. — 2 роки) вказує на виражені дисбіотичні процеси в товстому кишечнику в дітей з гострим обструктивним бронхітом, що проявлялися якісними та кількісними змінами його мікрофлори (табл. 3).
Так, у гострому періоді захворювання серед обстежених дітей ІІ групи нормальний уміст біфідобактерій (108) не відмічався в жодного пацієнта і був вірогідно нижчим — 2,32 ± 0,61 lgКУО/г, ніж у здорових — 8,27 ± 0,10 lgКУО/г (р < 0,001). Схожі зміни відбувались і з показниками лактобактерій, вміст яких дорівнював 2,24 ± 0,54 lgКУО/г порівняно з 8,37 ± 0,09 lgКУО/г в осіб контрольної групи (р < 0,001). У всіх хворих виявлено значне вірогідне (р < 0,001) зниження популяції кишкової палички — до 4,53 ± 0,54 lgКУО/г порівняно з її кількістю у здорових дітей. Гриби роду кандида виявлялися в значній кількості, що в 2 рази перевищувала показники у групі порівняння (р < 0,01). Титри УПМ також зростали і на відміну від здорових дітей (2,48 ± 0,18 lgКУО/г) становили 3,04 ± 0,18 lgКУО/г (р < 0,01). Стафілококи (золотистий та гемолізуючий) виявлені в 40 % обстежених, що вірогідно більше, ніж в осіб без патології (р < 0,01).
Оцінка динаміки складу мікрофлори кишечника в дітей з гострим обструктивним бронхітом залежно від лікування у дітей ІІ групи вказувала на відсутність позитивної динаміки у хворих, які отримували стандартну терапію, та значне покращення чи нормалізацію показників у пацієнтів, які додатково приймали Лактовіт форте.
Cеред обстежених дітей ІІа групи кількість біфідобактерій залишалась низькою порівняно з даними при госпіталізації (2,41 ± 0,52 lgКУО/г) та вірогідно (р < 0,001) підвищувалась (до 6,7 ± 0,3 lgКУО/г) у пацієнтів, які отримували пробіотик. Уміст лактобактерій у дітей ІІа групи характеризувався тенденцією до зниження, а у пацієнтів, які входили до групи ІІб, — вірогідно підвищувався — до 6,27 ± 0,30 lgКУО/г (р < 0,001). Слід зазначити, що при лікуванні пробіотичним препаратом у хворих на гострий обструктивний бронхіт дітей спостерігалось вірогідне (р < 0,001) підвищення кількості кишкової палички в товстій кишці, яка досягала 6,54 ± 0,21 lgКУО/г, тоді як при стандартному лікуванні даний показник залишався низьким — 4,14 ± 0,88 lgКУО/г порівняно з даними при надходженні (р > 0,05). Після проведення традиційного лікування в дітей другої вікової групи спостерігалась тенденція до зростання загальної кількості УПМ до 3,44 ± 0,12 lgКУО/г порівняно з даними до лікування — 3,04 ± 0,15 lgКУО/г (р > 0,05). У пацієнтів, які отримували пробіотик, перед випискою зі стаціонару загальний титр УМП вірогідно нормалізувався і дорівнював 2,43 ± 0,30 lgКУО/г (р < 0,05). На фоні лікування Лактовітом форте в 1,2 раза порівняно з гострим періодом знижувався вміст грибів роду Сandida (р > 0,05), тоді як у хворих зі стандартним лікуванням їх кількість продовжувала зростати до 5,10 ± 0,44 lgКУО/г (р > 0,05). У динаміці лікування гострого обструктивного бронхіту без пробіотика спостерігалась тенденція до збільшення кількості стафілококів (р > 0,05). У той же час у групі дітей, які отримували Лактовіт форте, даний показник, навпаки, знижувався та наближався до даних групи контролю (р > 0,05).
Вивчення стану мікробіоценозу кишечника при гострих обструктивних бронхітах у дітей ІІІ вікової групи (2 роки 1 міс. — 3 роки) виявило значні порушення якісного та/чи кількісного складу як анаеробних, так і аеробних представників. Спостерігалися різкі кількісні зміни анаеробної флори та видового пейзажу умовно-патогенної мікрофлори (табл. 4).
Так, у дітей даної групи в гострому періоді захворювання кількість біфідобактерій була майже в 4 рази нижчою (2,40 ± 0,57 lgКУО/г), ніж у здорових осіб, у яких вона становила 8,27 ± 0,10 lgКУО/г (р < 0,001). Це стосувалося також і вмісту лактобактерій, нормальна кількість яких не відмічалась у жодної дитини і дорівнювала 2,28 ± 0,64 lgКУО/г проти 8,37 ± 0,09 lgКУО/г в осіб контрольної групи (р < 0,001). Крім того, у дітей з гострим обструктивним бронхітом відзначалися якісні й кількісні зміни в популяції ешерихій, які характеризувалися вірогідним зменшенням загальної кількості E.coli (4,35 ± 0,21 lgКУО/г) порівняно з групою контролю — 6,77 ± 0,24 lgКУО/г (р < 0,05). Видовий пейзаж умовно-патогенної мікрофлори при цьому захворюванні відрізнявся від такого у здорових осіб. Найвищі титри виявлялися у грибів роду Candida, мікробна кількість яких дорівнювала 5,19 ± 0,35 lgКУО/г, тоді як у здорових осіб лише 2,39 ± 0,28 lgКУО/г (р < 0,01). Уміст стафілококів (золотистого та гемолізуючого) становив 2,52 ± 0,69 lgКУО/г, тоді як у здорових дітей він дорівнював 0,41 ± 0,51 lgКУО/г (р < 0,01). Крім того, в гострому періоді в дітей даної групи спостерігалось вірогідне збільшення (р < 0,01) кількості умовно-патогенних бактерій (Enterococcus faecalis, Enterobacter cloacae, Citrobacter, Klebsiella рneumoniae та ін.) до 3,6 ± 0,26 lgКУО/г порівняно з показниками здорових дітей — 2,48 ± 0,18 lgКУО/г.
Аналізуючи вміст мікробіоти кишечника залежно від призначеної терапії гострого обструктивного бронхіту, слід відмітити, що серед обстежених дітей ІІІ вікової групи, які не отримували Лактовіт форте, відзначалася тенденція до зниження кількості біфідобактерій до 1,89 ± 0,42 lgКУО/г. У пацієнтів, які приймали пробіотик, нормальна кількість біфідобактерій (108) виділялась у 50 % хворих і цей показник досягав 5,78 ± 0,30 lgКУО/г, що майже в 3 рази вище, ніж у гострому періоді (р < 0,001).
Схожі зміни відбувались і з показниками лактобактерій. Слід зазначити, що після стандартного лікування дітей з гострим обструктивним бронхітом цей показник залишався низьким — 1,84 ± 0,38 lgКУО/г, тоді як при лікуванні пробіотичним препаратом спостерігалось вірогідне (р < 0,001) підвищення кількості лактобактерій в товстій кишці, яка досягала 6,00 ± 0,35 lgКУО/г.
Проведення традиційного лікування в дітей ІІІ вікової групи супроводжувалося тенденцією до подальшого зниження загальної кількості кишкової палички до 4,15 ± 0,29 lgКУО/г порівняно з даними до лікування — 4,35 ± 0,32 lgКУО/г (р > 0,05). У пацієнтів, які отримували пробіотик перед випискою зі стаціонару, загальний титр кишкової палички вірогідно підвищувався і дорівнював 5,84 ± 0,44 lgКУО/г (р < 0,01). У динаміці стандартного лікування гострого обструктивного бронхіту спостерігалась тенденція до збільшення кількості УПМ (р > 0,05). У дітей, які отримували Лактовіт форте, даний показник, навпаки, вірогідно знижувався (р > 0,05). У хворих ІІІа групи порівняно з даними в гострому періоді зберігався високий титр грибів роду Сandida (5,19 ± 0,35 lgКУО/г) та стафілококів (2,72 ± 0,63 lgКУО/г) (р > 0,05), тоді як у дітей ІІІб групи ці титри зменшувалися і становили 3,51 ± 0,16 lgКУО/г (р < 0,001) та 2,07 ± 0,69 lgКУО/г (р > 0,05) відповідно.
Таким чином, отримані нами дані досліджень доводять наявність якісних та кількісних порушень мікробіоценозу кишечника у дітей всіх вікових груп із гострим бронхітом, які характеризувалися зниженням кількості біфідо- та лактобактерій, ешерихій з нормальною ферментативною активністю та збільшенням числа гемолітичних ешерихій, дріжджеподібних грибів, стафілококів та інших представників умовно-патогенної флори.
Застосування лише стандартної терапії в лікуванні гострого обструктивного бронхіту, що включала противірусні, антибактеріальні препарати, відхаркувальні, муколітичні та симптоматичні засоби, не приводить до повної нормалізації мікробіоти в товстій кишці.
Поряд із цим включення в лікування пробіотика Лактовіт форте сприяє покращенню, а в деяких випадках повному відновленню кишкової мікрофлори.
Слід відмітити, що позитивної динаміки чи повної вірогідної нормалізації при прийомі пробіотичного засобу вдалося досягнути лише в дітей І та ІІ вікових груп. У той же час у пацієнтів ІІІ групи показники мікрофлори характеризувалися тільки покращенням, проте не досягали величин здорових дітей. Це, можливо, спричинене більш стійкими змінами мікробіоценозу кишечника в цій віковій групі, що розвинулись внаслідок тривалого чи рецидивуючого перебігу гострого обструктивного бронхіту, частішого використання лікарських засобів, які негативно впливали на якісний та кількісний склад мікрофлори, припинення грудного вигодовування. Можливо, ще однією з причин розвитку стійкого дисбіозу в цій групі дітей є супутній дисбаланс в імунній системі, адже характер кишкової мікробіоти опосередковано відображає імунний статус макроорганізму. Ця ситуація, на нашу думку, потребує подальшого поглибленого вивчення порушень імунітету при гострих обструктивних бронхітах у дітей раннього віку та їх взаємозв’язку з дисбіозом кишечника.
Висновки
1. У гострому періоді обструктивного бронхіту в усіх досліджених дітей раннього віку спостерігали порушення мікробіоценозу товстої кишки, які характеризувалися зниженням кількості біфідо- та лактобактерій, ешерихій з нормальною ферментативною активністю та збільшенням числа гемолітичних ешерихій, дріжджеподібних грибів, стафілококів та інших представників умовно-патогенної флори.
2. Після проведеного комплексного лікування в групі хворих без включення Лактовіту форте позитивної динаміки якісного та кількісного складу мікрофлори кишечника не спостерігалось. Бактеріологічні дослідження калу в дітей з гострим обструктивним бронхітом у динаміці захворювання показали, що включення в лікування пробіотика Лактовіт форте приводило до покращення, а в деяких випадках — до повного відновлення кишкової мікробіоти.
3. Лактовіт форте сприяє покращенню динаміки клінічних симптомів обструктивного бронхіту (зменшує тривалість синдрому інтоксикації, катаральних явищ, фізикальних змін) та дисбактеріозу кишечника (ефективно усуває метеоризм, порушення перистальтики, больовий синдром, дратівливість, покращує апетит).
4. При гострих обструктивних бронхітах у дітей раннього віку, асоційованих з мікроекологічними порушеннями, в комплекс лікувальних заходів доцільно включати пробіотик Лактовіт форте.
5. Лактовіт форте не має побічних ефектів та добре переноситься хворими.
1. Смирнова М.О., Сорокина Е.В. Бронхиты у детей: принципы современной терапии // Трудный пациент. — 2009. — № 8–9. — С. 19-23.
2. Бронхит (механизмы хронизации, лечение, профилактика) / Под ред. А.Н. Кокосова. — СПб.: ЭЛБИ-СПб. — 2007. — 178 с.
3. Самсыгина Г.А. Острый бронхит у детей и его лечение // Педиатрия. — 2008. — № 2. — С. 25-32.
4. Новиков Ю.К. Инфекционное поражение дыхательных путей // Рус. мед. журнал. — 2006. — № 6. — 36 с.
5. Протокол лікування дітей з гострими бронхітами. Додаток № 2 та Протокол лікування дітей з хронічними бронхітами. Додаток № 5 до Наказу МОЗ України № 18 «Про затвердження Протоколів надання медичної допомоги дітям за спеціальністю «Дитяча пульмонологія» від 13.03.2005 р. — К., 2005 — С. 58.

/039/039.jpg)
/040/040.jpg)
/041/041.jpg)
/042/042.jpg)