Журнал «Травма» Том 13, №1, 2012
Вернуться к номеру
Наш досвід лікування кісткових кіст у дітей
Авторы: Гузенко С.О., Куций М.М., Хмельницька міська дитяча лікарня
Рубрики: Травматология и ортопедия
Версия для печати
Проаналізувавши практику ведення 35 хворих із кістковими кістами, ми встановили, що відношення до тактики лікування має бути диференційоване у кожному випадку. Відмічено клінічну ефективність принципу диференційованого підходу до вибору пластичного матеріалу залежно від ступеня навантаження ушкодженої ділянки скелета, механічних властивостей та швидкостей біодеградації кераміки, що дозволяє забезпечити необхідну міцність ушкодженої ділянки кістки та оптимізувати перебіг регенерації кісткової тканини в зоні імплантації, сприяє ранньому навантаженню оперованої кінцівки та прискоренню функціонального відновлення.
Summary. Analysing practice of management of 35 patients with bone cysts we had established that attitude towards treatment mode must be differentiated in every case. There was noted clinical efficiency of principle of the differentiated approach to the choice of plastic material depending on the degree of loading of the injured area of skeleton, mechanical properties and speed of ceramics biodegradation, that allows providing necessary strength of injured part of a bone and optimizing the course of bone tissue regeneration in implantation area, furthering early weight bearing of the operated extremity and acceleration of functional recovery.
Резюме. Проанализировав практику ведения 35 больных с костными кистами, мы установили, что отношение к тактике лечения должно быть дифференцировано в каждом случае. Отмечена клиническая эффективность принципа дифференцированного подхода к выбору пластического материала в зависимости от степени нагрузки поврежденного участка скелета, механических свойств и скоростей биодеградации керамики, что позволяет обеспечить необходимую прочность поврежденного участка кости и оптимизировать ход регенерации костной ткани в зоне имплантации, способствует ранней нагрузке оперированной конечности и ускорению функционального восстановления.
Вступ
Необхідність створення біологічно активних імплантатів для пластики кісткової тканини обумовлена значним поширенням дегенеративно-дистрофічних захворювань хребта та великих суглобів, що потребують хірургічного лікування, а також збільшенням кількості хворих із кістковими дефектами після травм, пухлин, кіст та інших захворювань опорно-рухового апарату.
Нормальному розвитку вітчизняної трансплантології заважає насамперед брак державного фінансування та ухвалений Верховною Радою у 1999 році закон «Про трансплантацію органів та інших анатомічних матеріалів людини». Пересадка кістки згідно з законом є трансплантацією органа та потребує наявності відповідної ліцензії лікаря.
У сучасній оперативній ортопедії для заміщення дефектів кісток використовують різні пластичні матеріали як біологічного (автотрансплантати, алотрансплантати), так і синтетичного походження (корундова, кальцій-фосфатна і склокераміка). Синтетичні матеріали мають різні властивості, й залежно від цього їх класифікують на біотолерантні, біоінертнi та біоактивні. Біологічно активні матеріали (гідроксіапатит, b-трикальційфосфат; склокераміка, ситали) зростаються при імплантації з навколишньою кісткою без формування фіброзної тканини, і має місце формування реактивної зв’язувальної зони [7].
У теперішній час у світі існує велика кількість різноманітних остеопластичних імплантатів (кісткових замінників) для остеосинтезу та остеопластики, які використовують в травматології та ортопедії. До найбільш відомих зараховують колагени, гідроксіапатити, біокераміку, декальцинований кістковий матрикс тощо.
Визнано, що імплантати повинні мати задовільні біологічні, хімічні та механічні характеристики [7].
Біологічні характеристики
1. Остеогенність — наявність клітинних джерел остеогенезу.
2. Остеоіндукція — здатність запускати остеогенез.
3. Остеокондукція — здатність виконувати роль матриці для утворення нової кістки і направляти її ріст.
4. Відсутність імунних реакцій із боку організму.
5. Зрощування з кістковою тканиною.
Хімічні характеристики
1. Відсутність корозії і небажаних хімічних реакцій із тканинами організму.
2. Пролонгований термін біодеградації (щоб клітини не вимивалися разом із транссудатом).
3. Наявність пор (для прискореного проростання тканини в імплантат).
Механічні характеристики
1. Міцність.
2. Тріщиностійкість.
3. Опір сповільненому руйнуванню (втомі).
4. Зносостійкість.
Цей напрям почав активно розвиватися з 1960-х років, після того як з’ясувалося, що металічні біоімплантати мають суттєві недоліки. У сучасній технології вважають, що кераміка — це оксиди силіцію та деяких металів (алюмінію, титану, цирконію, ітрію й низки інших металів), карбіди (SiC), нітриди (Si3N4), а також бориди. Кераміка — перспективний біоматеріал: вона міцна, не піддається корозії, не вступає в хімічні реакції. Крім того, кераміка не стирається, а також є біосумісною і навіть деякою мірою біоактивною (поверхня керамічних імплантатів може адсорбувати біологічні молекули). Але є й мінуси: всі керамічні матеріали крихкі і легко ламаються, особливо при згинанні, до того ж тяжко зробити керамічний виріб складної форми. Впровадження до кісткової тканини корундованої кераміки обумовлене якостями міцності та біологічною інертністю.
Нові матеріали відрізняють наявність модифікацій із різними механічними властивостями та ступенем біодеградації; відсутність ризику вірусного забруднення, імунологічної реакції чи запалення, етичних та релігійних проблем (матеріали мають небіологічне походження); теоретично необмежена кількість та тривалий термін зберігання; відносно низька вартість; простота використання і висока ефективність [3].
Застосування кераміки в травматології та ортопедії пояснюється якостями, обумовленими хімічним складом і структурою кераміки, властивістю стабільності і нерозчинності, здатністю витримувати значні механічні навантаження. Експериментальні дослідження показали, що матеріали з кераміки нетоксичні, навколо них не спостерігаються некротичні зміни навколишніх тканин, у тому числі кісткової тканини і кісткового мозку. При використанні кераміки було відзначено і деякі недоліки, до яких можна зарахувати її високу біоінертність, імплантати з неї не резорбуються, а заміщаються в зоні імплантації на весь період функціонування, що звужує рамки їх використання, хоча біологічну сумісність цих імплантатів з кісткою оцінюють як адекватну [8].
Останнім часом для пластики дефектів кісток ортопеди надають перевагу біологічно активним матеріалам на основі гідроксіапатиту. Цей вид пластичного матеріалу одержав значне поширення при заповненні порожнин, дефектів у кістковій тканині. Гідроксіапатит залежно від технології отримання має різну кінетику розсмоктування при замінені кістковою тканиною, що не властиво для корундової кераміки, і деякі матеріали з гідроксіапатиту не поступаються за міцністю корундовій кераміці [8].
При імплантації в кісткову тканину керамічних матеріалів на основі ГАП відбуваються процеси, що можуть бути подані в такому вигляді:
а) розчинення поверхневих шарів та іонний обмін між імплантатом і навколишніми тканинами;
б) адгезія на поверхні імплантата тканинних біологічно активних речовин;
в) хемотаксис і активація макрофагів і остеокластів;
г) проростання імплантата грануляційною і судинною тканиною;
д) адгезія остеогенних клітин (остеобластів і преостеобластів);
е) формування позаклітинного кісткового матриксу [5].
В Україні були розроблені нові композиційні матеріали біологічного походження з різним умістом біологічного гідроксіапатиту (БГАП), які мають фізико-механічні параметри, складом і мікроструктурою композитів. Вмістом БГАП можна керувати, змінюючи співвідношення між складовими. Таким чином, можна наблизитись до структури і властивостей тих чи інших видів кісткової тканини, навіть врахувати індивідуальні особливості пацієнтів. Це дуже важливо, особливо при хірургічному лікуванні дітей, які знаходяться у віці інтенсивного росту, оскільки потрібно обирати оптимальні варіанти складу, що має необхідну швидкість резорбції матеріалу i міцність, порівнянну з міцністю кістки пацієнта [6].
Матеріали і методи
За період з 2005–2009 рр. в ортопедо-травматологічному відділенні ХМДЛ лікувалось 35 дітей із кістковими кістами, із них дівчаток — 7, хлопчиків — 28.
Віковий розподіл хворих показано в табл. 1.

Розподіл за локалізацією та спектром нозологій показано в табл. 2.
Найчастіше зустрічалась остеобластокластома — 15 випадків (43 %), на другому місці фіброзна дисплазія — 10 випадків (28 %), на третьому місці — енхондрома та аневризмальна кіста — по 3 випадки (по 9 %).
Ці нозологічні форми мають свої клінічні та рентгенологічні особливості [2, 4].
Гігантоклітинна пухлина
Активно-кістозна форма
Рентгенологічна картина. Рентгенологічна картина гігантоклітинної пухлини складається з багатьох характерних окремих мілких та дуже мілких камер, відокремлених один від одного повними та неповними перетинками, розташована ексцентрично.
Коркова речовина на початку захворювання завдяки експансивному росту патологічного утворення розходиться та ніби набухає зсередини. Вона значно потоншується.
Реактивні зміни зі сторони сусідньої кісткової тканини відсутні, рисунок нормальний, надкісткових нашарувань немає.
Літична форма
Рентгенологічна картина. Основною особливістю дифузно-остеокластичного типу гігантоклітинної пухлини служить повна відсутність трабекулярного рисунку, дефект кістки цілком гомогенний. Найчастіше на рентгенограмах вимальовується крайовий глибокий дефект. Коркове нашаровування на уражену ділянку цілком розсмоктується, а на межі з дефектом впирається в нього, корка лише загострена, не покрита і немає жодних періостальних нашарувань.
Клінічна картина. Клінічна діагностика остеобластокластом у ранні стадії захворювання викликає ряд труднощів, оскільки пухлина спочатку зовні не проявляється. У першому випадку пухлина росте швидко, початковим симптомом її є біль при пухлині, що ще не прощупується. При збільшенні пухлини з’являється припухлість, підвищується температура шкіри в місці ураження, розширюються підшкірні вени та проявляється почервоніння шкіри. Все це можливо спостерігати через 3–4 місяці після появи болю. При потоншанні кортикального шару поряд із мимовільними болями в спокої з’являються болі при пальпації. Пізніше приєднується болюча контрактура в прилеглому суглобі.
Фіброзна дисплазія кісток
Рентгенологічна картина. Рентгенологічно визначається обмежена ділянка просвітлення кісткової тканини неправильної округлої або овальної форми найрізноманітніших розмірів. Дефект кістки або ряд дефектів розташовуються зазвичай ексцентрично, у корковій речовині, під окістям. У навколишній кістковій тканині визначається частіше за все лише незначний, неглибоко проникаючий склероз. У рідких випадках у місцях глибокої перебудови кісткової структури склеротичні зони іноді переважають над прозорими зонами фіброзу, що замінили кісткову тканину, яка розсмокталася. Остеопорозу або атрофії при фіброзній дисплазії кісток не буває.
Клінічна картина. Фіброзна дисплазія незалежно від форми захворювання розпочинається поступово. Зазвичай хворі скаржаться на легкі та минущі болі. Лише в рідкісних випадках спочатку звертають увагу на припухлість (зазвичай при наявності великих джерел або особливої локалізації, наприклад у верхній щелепі). Інтенсивність болю залежить від ступеня ураження кістки.
Хондрома
Рентгенологічна картина. Рентгенограма при багатьох хондромах периферичних кісток кінцівок має патогномонічне діагностичне значення. Окремі пухлини представляються шароподібними або трішки овальними: вони лежать або більш центрально і надувають кістку зсередини, або частіше ексцентрично більш поверхнево і пов’язані тільки з корковою речовиною кістки. Коркове нашарування кістки витончене й часто відсунуте пухлиною в сторону; якщо пухлина лежить центрально, корка відтіснена далі від осі кістки, якщо ж хондрома виходить із поверхневих шарів, то протилежні відділи корки присунуті один до одного.
Клінічна картина. У більшості хворих першим симптомом у результаті розпирання пухлиною й веретеноподібного здуття коркового шару кістки є болі або почуття незручності в ураженій кістці. Рідше енхондроми перебігають болісно, і вперше увагу звертають на потовщення всієї фаланги. Першим симптомом може бути патологічний перелом, у цих випадках енхондрома імітує остеобластокластому.
Остеоїд-остеома
Рентгенологічна картина. У губчастій або корковій речовині під надкісницею виділяється округле або овальне ґудзикове кісткове затемнення близько 1 см у поперечнику (в окремих випадках від 0,5 до 2 см) із відмінними контурами. Навколо цього центрального ураження є прозорий вал. Іноді це світлий контур, що перетинається декількома тонкими, ніжними променевими смужками. Кісткова тканина навкруги поясу просвітлення має ущільнення, більш-менш різко склерозоване. При дуже різкому прогресуючому остеосклерозі та періоститі центральне «яйце», що сидить у дуплі, може залишатися на звичайних рентгенограмах непоміченим. Центральне кісткове джерело — це безперечно некротичне джерело, що за якоїсь причини надалі не відторгається, не секвеструється, а, навпаки, розсмоктується і асимілюється живою тканиною. Весь процес супроводжується реактивним склерозом і живим запальним хворобливим періоститом.
Клінічна картина. Скарги хворих із остеоїд-остеомою майже однотипні. При відсутності деформацій хворі страждають від різкого болю ниючого характеру, які не стихають у спокої та посилюються уночі. Спочатку слабкі, вони з розвитком хвороби посилюються і не дають хворому спати. При ураженні кісток, які округлені найбільшим шаром м’яких тканин, можливо побачити незначну припухлість. Можливе місцеве почервоніння і підвищення температури шкіри в області, яка знаходиться недалеко від джерела при відсутності підвищення температури тіла. Як виняток описані остеоїд-остеоми, що супроводжуються не тільки місцевими запальними явищами, але й підвищенням температури тіла. Постійний біль та припухлість призводять до порушення функцій кінцівок. У хворих, які давно страждають від болю, настає помітна атрофія м’яких тканин усієї кінцівки як результат нейротрофічних порушень у ній. Цьому симптому в літературі не надають великого значення, хоча він зустрічається в 1/3 хворих при довгостроковому (близько одного року) захворюванні. Наслідком болю є тяжкі больові контрактури, що викликають кульгавість. Описані контрактури, що розвиваються внаслідок випоту в суглоб та вторинного артриту при навколосуглобових ураженнях, та сколіоз при ураженні хребта
Тубостит
Рентгенологічна картина. При гранулюючій фазі джерело невеликих розмірів із чіткими контурами, обумовлене нерізко вираженим реактивним склерозом. Казеозне джерело має нечіткі контури й у своєму складі має секвестри. При уражені як епіфізу, так і метафізу процес, як правило, розташовується в сторону суглоба, при цьому руйнуючи суглобову поверхню, — синдром цукру, що тане.
Клінічна картина. При туберкульозі частіше зустрічаються іррадіювальні болі. Характерні болі при навантаженні, що швидко зникають при іммобілізації. Атрофія м’язів ураженої кінцівки майже обов’язкова, вона є раннім симптомом і буває вираженою. Місцеве підвищення температури, випіт у прилеглому суглобі, обмеження рухів у ньому типові для туберкульозу. Крайове розташування туберкульозного вогнища, як правило, супроводжується проривом кортикального шару із залученням у процес сумки суглоба, але періостальна реакція відзначається вкрай рідко.
Аневризмальна кіста
Рентгенологічна картина. Рентгенологічно визначається ділянка остеолізу з нечіткими контурами, розташованими ексцентрично. Корковий шар на цьому рівні на більшому або меншому протязі зруйнований, м’які тканини збільшені в об’ємі. Можуть бути локальні здуття кістки й періостальні нашарування. При пункції кісти кров витікає під тиском, що є суттєвим диференційно-діагностичним виявом захворювання.
Клінічна картина. Клінічна картина солітарних і аневризмальних кіст багато в чому залежить від локалізації процесу. При аневризмальних кістах, що часто вражають хребет, відзначаються специфічні клінічні ознаки: почуття скутості, раніше поява припухлості в паравертебральній ділянці, нахил хребта в бік ураження, болі й неврологічні розлади, пов’язані зі здавленням корінців або спинного мозку. При аневризмальних кистах в анамнезі у всіх випадках були дані про травму, але першим симптомом захворювання були болі, пізніше розвивалися контрактури в тазостегновому або колінному суглобі, патологічних переломів не спостерігалося.
Ксантоматоз
Рентгенологічна картина. Рентгенологічно проявляється у вигляді вогнища з розрідженою, овальною, округлою формою з багатофестончастими краями у вигляді мережива, навколо вогнища циркулярно багатошарові склерозовані ділянки. Періостальна реакція виражена слабо.
Клінічна картина. Тріада симптомів, дуже характерна для кісткового ксантоматозу (нецукровий діабет, витрішкуватість та кісткові зміни), дуже непостійна, нерідко відсутні перші дві ознаки. Непостійні ознаки тріади потрібно розглядати не як обов’язкові симптоми, а як наслідок розвитку специфічних джерел поблизу гіпофіза та черепних нервів. При відсутності внутрішньочерепних симптомів особливу увагу при ксантоматозній формі може привернути загальний стан хворого (підвищена температура тіла, в’ялість, пасивність, зниження апетиту і сну) та дані гістологічних досліджень, при яких виявляють аналогічні для всіх форм кісткового еозинофільозу зміни в джерелі, але з різними за інтенсивністю клітинними порушеннями в ретикулоендотелії.
Результати та обговорення
Більшість цих нозологічних форм, особливо на ранніх етапах розвитку кісткових кіст або при невеликих їх розмірах, мають клінічно-мовчазний характер і виявляються випадково при рентгенологічному обстеженні або при утворенні патологічного перелому.
Лікування кісткових кіст винятково хірургічне. Ми відмовились від пункційної біопсії, тому що вважаємо, що ризик анестезіологічного забезпечення, особливо у дітей раннього віку перевищує інформативність цього методу обстеження. В 3 випадках проведено екскохлеацію порожнини (фіброзна дисплазія — 2, енхондрома — 1), у 32 випадках проведено внутрішньокісткову резекцію вогнища (остеобластокластома — 15, фіброзна дисплазія — 2, енхондрома — 1, аневризмальна кіста — 3, ксантоматозна кіста — 1, тубостит — 1, остеоїд-остеома — 2). Як імплантат у більшості випадків застосовували КЕРГАП у вигляді гранул 1,5–2,5 мм, якими щільно пломбували порожнину. У післяопераційному періоді обов’язково застосовували зовнішню іммобілізацію протягом 1,5–2 місяців.
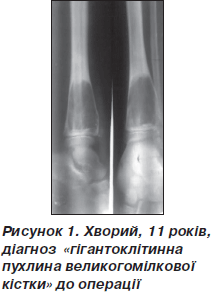
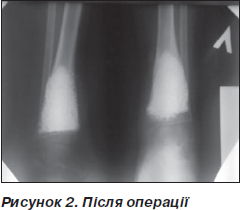
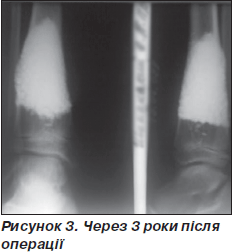
Рентгенологічний контроль проводили через 1, 3, 6, 9, 12 місяців. Дозоване навантаження на кінцівку дозволене через 2–3 місяці після операції залежно від розміру кісти та швидкості перебудови імплантату. Звертає на себе увагу повільне формування кістково-керамічного блоку, що збігається з даними літератури [1] (рис. 1–3).
У двох випадках зниження механічної міцності сегменту кістки в зоні імплантації КЕРГАПу призвело до патологічного перелому кістки після травми.
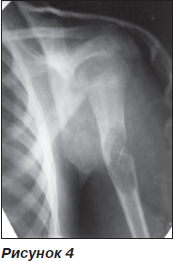
У першому випадку — хвора, 10 років, якій було проведено операційне втручання в 2008 р. з видалення кісти з КЕРГАП-пластикою з приводу остеобластоми верхньої третини правого плеча (рис. 4).
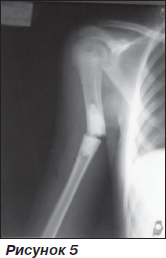
Після операції гіпсова лонгета протягом 1,5 міс. Через 14 міс після операції при падінні з велосипеда виник перелом плеча на рівні імплантату (рис. 5).
У травні 2009 р. проведене оперативне втручання: відкрита репозиція — остеометалосинтез пластиною. Було досягнуто зрощення. У березні 2010 р. пластину видалено (рис. 6).

У наступному випадку хворий 14 років був оперований у 2004 році з приводу фіброзної дисплазії. Було проведено внутрішньокісткову резекцію кісти з КЕРГАП-пластикою.
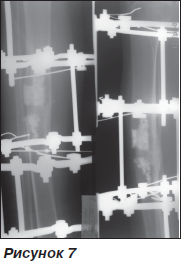
У 2008 р. після падіння зі скейту виник перелом великогомілкової кісти на рівні імплантата. Консервативне лікування протягом 2 місяців не призвело до утворення регенерату. Тому було проведене оперативне втручання: реканалізація великогомілкової кісти, накладання апарату Ілізарова. Досягнуто зрощення, апарат знято (рис. 7).
Проаналізувавши ці випадки, ми дійшли висновку, що в місцях, які піддаються підвищеним навантаженням, та при великих розмірах кіст потрібно застосовувати матеріали з високим ступенем біодеградації. КЕРГАП не відповідає цим вимогам через свою крихкість. Тому в таких випадках ми з 2009 р. почали використовувати остеїн-апатитний комплекс (ОСТАП) з огляду на його фізико-хімічні властивості.
Зважаючи на різну локалізацію кісткових дефектів, їх різні розміри і форми, різні ступені навантаження в зоні імплантації, близькість розташування до росткових ділянок, різні вікові перебудови кістки, підхід до вибору матеріалів для імплантації має бути зваженим і необхідно враховувати властивості, можливості і структуру пластичного матеріалу.
На сьогодні немає остаточно узгодженої точки зору щодо вибору матеріалу для пломбування кісткових дефектів. На наш погляд, за наявності невеликих кіст у метафізарній зоні (до 1/3 діаметра кістки) вибір матеріалу для імплантації принципового значення не має. У місцях діафіза в тих випадках, коли після резекції кісти механічна міцність кістки зменшена, потрібно використовувати імплантат з прискореною біодеградацією. Використання таких матеріалів сприяє відновленню необхідної міцності ушкодженої ділянки кістки.
Також не вирішеним на сьогодні є питання тактики ведення хворих із невеликими кістами. На наш погляд, тактика у таких хворих має бути активна, тому що:
1) ріст пухлини призводить до збільшення об’єму операції, це марна трата часу, збільшення тривалості лікування;
2) вичікування може призвести до ускладнення у вигляді патологічного перелому;
3) не завжди можливо провести пункційне лікування з огляду на розміри і локалізацію кісти;
4) при малих розмірах кіст тяжко встановити точний діагноз;
5) при виникненні патологічного перелому треба дочекатись зрощення, що теж збільшує термін лікування.
Висновки
1. Проблема лікування кісткових кіст у дітей не є остаточно вирішеною в питаннях вибору тактики і вибору матеріалів для їх пломбування.
2. Тактика лікування дітей із кістковими кістами має бути активно-хірургічною з огляду на труднощі диференціальної діагностики, особливо при невеликих розмірах.
3. Вибір матеріалу для пломбування кіст повинен проводитись з урахуванням локалізації розмірів кіст і ступеня механічної міцності сегмента кістки.
Науменко Н.О., Лучко Р.В. Рентгенологічні особливості перебудови імплантантів у кістках дітей при хірургічному лікуванні доброякісних пухлин, пухлиноподібних захворювань // Вісник ортопедії, травматології та протезування. — 2009. — № 4. — С. 38-41.
Волков М.В. Болезни костей у детей. — М., 1985.
Диференційоване застосування різновидів кальцій-фосфатної кераміки для пластики порожнини кісткових дефектів: Дис... канд. мед. наук (04.01.2001 р.) інституту патології хребта та суглобів ім. М.І. Ситенка АМН України.
Рейнберг С.А. Рентгенодиагностика заболеваний костей и суставов. — М.: Медицина, 1964.
Ульянчич Н.В., Поворознюк В.В., Євтушенко О.О., Шеремет О.Б. Гідроксиапатит та його використання в медицині // Проблеми остеології. — 1999. — № 2, № 4. — С. 77-74.
Івченко В.К., Іванченко Л.А., Івченко А.В., Пінчук Н.Д. «Остеопатит керамічний» — біоактивний композиційний матеріал для остеопластики в ортопедії // Вісник ортопедії, травматології та протезування. — 2003. — № 4. — С. 21-25.
7. Загородько О.В., Антонюк Н.Г., Бурбан А.Ф. Загальна характеристика основних остеозаміщувальних імплантатів.
Шимон В.М., Пантьо В.І., Василинець М.М. та ін. Застосування біологічно активних матеріалів (кераміки) при лікуванні вертебральної патології // Вісник ортопедії, травматології та протезування. — 2008. — № 4. — С. 25-28.