Украинский журнал хирургии 1 (10) 2011
Вернуться к номеру
Контроль полноты десимпатизации при эндоскопической грудной симпатэктомии по поводу болезни Рейно
Авторы: О.И. Миминошвили, С.В. Перепелица, И.Н. Шаповалов, С.В. Ярощак, В.В. Долгополов, ГУ «Институт неотложной и восстановительной хирургии им. В.К.Гусака НАМН Украины», Донецк
Рубрики: Хирургия
Разделы: Клинические исследования
Версия для печати
Оценена эффективность предложенного авторами метода контроля полноты десимпатизации при эндоскопической грудной симпатэктомии, выполненной по поводу болезни Рейно. Сравнительный анализ результатов эндоскопической грудной симпатэктомии в группе, где применялся контроль эффективности десимпатизации с результатами группы, где оперативное лечение было осуществлено до внедрения методики показал, что непосредственные результаты грудной симпатэктомии в группах статистически достоверно не отличались. В ближайшем послеоперационном периоде во второй группе зафиксированы неудовлетворительные результаты, когда в первой они отсутствовали. Анализ неудовлетворительных результатов позволил сделать вывод о неполной десимпатизации, как погрешности оперативной техники. Отдаленные результаты грудной симпатэктомии были хуже непосредственных и ближайших и практически не отличались в группах сравнения. Объяснение этого, вероятно, в развитии денервационной чувствительности тканей к циркулирующим катехоламинам.
Оцінено ефективність запропонованого авторами методу контролю повноти десимпатизацs] при ендоскопічної грудної симпатектомії, виконаної з приводу хвороби Рейно. Порівняльний аналіз результатів ендоскопічної грудної симпатектомії у групі, де застосовувався контроль ефективності десимпатизації з результатами групи, де оперативне лікування було здійснене до впровадження методики показав, що безпосередні результати грудної симпатектомії в групах статистично достовірно не відрізнялися. У найближчому післяопераційному періоді у другій групі зафіксовані незадовільні результати, коли в першій вони були відсутні. Аналіз незадовільних результатів дозволив зробити висновок, про неповну десимпатизацію, як похибку оперативної техніки. Віддалені результати грудної симпатектомії були гірше безпосередніх і найближчих і практично не відрізнялися в групах порівняння. Пояснення цього, ймовірно, у розвитку денерваціонной чутливості тканин до циркулюючих катехоламінів.
The efficiency of the method, proposed by the authors, of control the completeness of sympathectomy by endoscopic thoracic sympathectomy performed on the subject of Raynaud’s disease. The comparative analysis of the results of endoscopic thoracic sympathectomy in the group, where the control of effectiveness of sympathectomy with the results of the group was used, and where surgery was performed before the introduction of techniques showed that the immediate results of thoracic sympathectomy in the groups did not differ statistically. In the immediate postoperative period in the second group unsatisfactory results were recorded, while they were absent in the first one. The analysis of unsatisfactory results allowed to draw the conclusion of incomplete sympathectomy as the error of the operative technique. Long-term results of thoracic sympathectomy are worse than spontaneous and imminent and did not differ in the comparison groups. The explanation for this is likely in the developing denervation tissue sensitivity to circulating catecholamines.
болезнь Рейно, эндоскопическая грудная симпатэктомия, контроль полноты десимпатизации.
хвороба Рейно, ендоскопічна грудна симпатектомія, контроль повноти десимпатизації.
Raynaud’s disease, endoscopic thoracic sympathectomy, monitoring completeness of sympathectomy.
Эпидемиология болезни Рейно (БР), по оценкам различных авторов, составляет от 5 до 20% и более [1, 4, 6]. Принимая во внимание тот факт, что заболевание поражает главным образом молодое, трудоспособное, экономически активное население, становится понятна особая актуальность проблемы лечения этой патологии.
Опираясь на практический опыт лечения болезни Рейно, комплексная консервативная медикаментозная терапия зачастую не приводит к стойкому и выраженному эффекту, а прямые методы реваскуляризации ишемизированных участков (реконструктивно-восстановительные операции) являются неприемлемыми из-за распространённости поражения на уровне микроциркуляторного русла. В такой ситуации наиболее оправданы непрямые методы стимуляции кровообращения, среди которых операцией выбора является эндоскопическая грудная симпатэктомия (ЭГСЭ).
Несмотря на широкое признание практической ценности ЭГСЭ оценки результатов вмешательства, по-прежнему, остаются неоднозначными [1, 2, 4, 6, 8, 10]. Хорошие непосредственные результаты, по данным большинства авторов, отмечены у 93,5-98,2% пациентов [2, 4, 8, 9, 10]. Отдаленные результаты хуже непосредственных. По данным A. Cameron [8] только 20% пациентов с болезнью Рейно после этой операции отметили улучшение в отдаленном периоде. Y. Matsumoto et al. [10] сообщает о 28 пациентах, перенесших ЭГСЭ по поводу феномена Рейно, непосредственные положительные результаты были отмечены у всех 28 больных, однако по прошествии 5 лет пароксизмы вазоспазма вернулись к 25 (89,3%) пациентам. Е.П. Кохан [1] в отдаленном периоде у пациентов с болезнью и синдромом Рейно после торакоскопической верхнегрудной симпатэктомии со временем отмечал ухудшение результатов.
Среди причин рецидива можно назвать неполную десимпатизацию из-за вариабельности анатомии симпатического ствола (рассыпчатый тип), массивного развития ретроплевральной клетчатки, наличия альтернативных путей симпатической иннервации верхних конечностей, обходящих шейно-грудной ствол (синовертебральный нерв, нерв Kuntz, плечевое сплетение) [2, 6]. Интраоперационный контроль полноты десимпатизации при ЭГСЭ является залогом положительных результатов оперативного лечения.
Нами был разработан и впоследствии запатентован способ определения полноты десимпатизации при ЭГСЭ, который позволяет уточнять объем эффективной деструкции симпатикуса и осуществлять контроль радикальности десимпатизации (патент на полезную модель № 42612 от 10.07.2009) [5].
Целью настоящего исследования явилось определение роли интраоперационного контроля полноты десимпатизации при эндоскопической грудной симпатэктомии в лечении болезни Рейно.
Материал и методы
Основу работы составили 32 пациента с болезнью Рейно, которым в разные годы была выполнена эндоскопическая грудная симпатэктомия в хирургическом отделении ГУ «ИНВХ им. В.К. Гусака НАМНУ» в период с 1997 по 2009 гг.
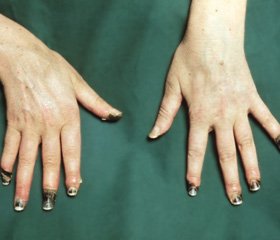
Из 32 пациентов мужчин было 12 (37,5%), женщин 20 (62,5%). Возраст больных составлял от 18 лет до 63 лет, средний возраст 34,2±2,1 года, давность заболевания была различной и составляла от 1 года до 23 лет, в среднем составила 16±2,2года. Стадия заболевания определялась по классификации Г.Л. Ратнера, (1989). II стадия заболевания была диагностирована у 5 (15,6%) пациентов, III стадия – у 19 (59,4%), IV стадия – у 8 (25%) больных.
Все больные были распределены на две группы сравнения. В первой группе больным во время ЭГСЭ производился интраоперационный контроль полноты десимпатизации по нашей методике, во второй – до внедрения методики ограничивались только визуальным контролем.
Показаниями к операции являлись: стойкий болевой синдром, нарушение трофики пальцев кисти, неэффективность адекватной консервативной терапии.
Общая характеристика групп сравнения представлена в таблице 1.
Группы сравнения не отличаются по полу, возрасту, стадии и продолжительности заболевания. Поэтому эти группы можно считать статистически однородными и сопоставимыми.
Всем больным, выполнялись клинико-лабораторные и инструментальные методы исследования. Оценка состояния артерио-венозного русла верхних конечностей, производилась с помощью реовазографии с нитроглицериновой пробой, ультразвуковой допплерографии (УЗДГ) и лазерной допплерофлоуметрии. Степень тяжести ишемии тканей оценивалась полярографическим методом транскутанного определения парциального напряжения кислорода в коже пальцев кистей.
ЭГСЭ выполнялась в условиях эндотрахеального наркоза с раздельной интубацией бронхов по стандартной методике. При этом симпатический ствол резецировали по Adson (иссечение Тh2-Тh3) иссекали и латеральные коммуникантные ветви, отходящие от этих узлов. Контроль полноты десимпатизации осуществляли следующим образом: после визуализации и выделения симпатического ствола проксимальнее предполагаемого места его пересечения накладывали тонкоигольный стимулирующий электрод, а дистальнее места пересечения накладывался регистрирующий электрод. На стимулирующий электрод подавался постоянный электрический ток напряжением 12 В. При этом на регистрирующем электроде отмечали наличие электрического тока, что фиксировалось на экране подключенного монитора. После этого ствол электрокоагуляцией резецировали в необходимом объеме, после чего повторяли процедуру изучения проведения электрического тока. При полном пересечении ствола на регистрирующем электроде отсутствовали какие-либо изменения.
В настоящее время мы модернизировали предложенный нами способ, отказавшись от регистрирующего электрода. Вместо этого мы используем мембранный закрытый электрод типа Clark пульсокиметра, наложенный на II палец кисти со стороны операции. Эффективность проведенного вмешательства определяется путем сравнения данных ТсРО2, полученных перед операцией и результатов интраоперационного и послеоперационного исследований. После эффективно проведенной симпатэктомии в денервируемой зоне при проведении этого теста возрастает парциальное напряжение кислорода в коже пальцев кисти, а при раздражении проксимального конца симпатического ствола стимулирующим электродом этот показатель не изменяется.
Во второй группе производился только визуальный контроль полноты пересечения симпатикуса и коммуникантных ветвей.
Выполнив симпатэктомию и убедившись в отсутствии кровотечения, лаважировали и дренировали плевральную полость. На следующий день плевральный дренаж удаляли.
После операций летальных исходов не было. В послеоперационном периоде у 1 больного первой группы была отмечена умеренная подкожная эмфизема, которая купировалась самостоятельно и не потребовала специального лечения. Во второй группе у одного больного сохранялся остаточный пневмоторакс на протяжении 3 суток, при этом плевральный дренаж функционировал удовлетворительно, прибегнув к активной аспирации из плевральной полости это осложнение было ликвидировано.
В послеоперационном периоде больные получали курс стандартной консервативной терапии.
Результаты и обсуждение
Результат ЭГСЭ оценивался как хороший при исчезновение или значительном уменьшение болевого синдрома, сокращение продолжительности и частоты приступов вазоспазма, повышение кожной температуры пальцев кисти, при наличии язв – их очищение и эпителизация, быстрое заживление ран первичным натяжением после некрэктомий или экономных ампутаций. При ультразвуковой допплерографии регистрировали увеличение линейной скорости кровотока (ЛСК) до 70% от исходного значения, снижение индекса периферического сопротивления (ИПС), дилятация артерий предплечий и кисти. По результатам реовазографии отмечалось увеличение реографического индекса (РИ) – 0,6-0,7. При лазерной допплерофлоуметрии отмечалась картина стойкой вазодилятации, увеличение базального кровотока (БК) более 40 мл/мин/100 г, отрицательные холодовые и нитроглицериновые (НТГ) пробы. При транскутанной оксигемометрии отмечался рост парциального напряжения кислорода (ТсРО2) в коже пальцев кистей до 55-60 mmHg.
Удовлетворительными считали результаты при которых уменьшался болевой синдром, пароксизмы вазоспазма возникали реже, не прогрессировали трофические расстройства, оказывала положительное влияние ранее неэффективная медикаментозная терапия. При допплерографии увеличивалась ЛСК до 30% и снижался ИПС. По результатам реовазографии отмечалось увеличение РИ (0,5-0,59). При лазерной допплерофлоуметрии отмечали увеличение БК до 30-39 мл/мин/100 г, отрицательные холодовые и НТГ пробы. Транскутанная оксигемометрия показывала значения ТсРО2 45-54 mmHg.
Результаты признавали как неудовлетворительные при отсутствии положительного эффекта после операции, возврат или прогрессирование прежних проявлений заболевания.
По времени результаты разделены на непосредственные (от момента операции до выписки), ближайшие (с момента выписки до 6 месяцев) и отдаленные (от 6 месяцев до 12 лет). Непосредственно после операции все больные в обеих группах отмечали потепление пальцев кистей, умеренно выраженную локальную гиперемию и гипертермию, значительное уменьшение или исчезновение болей. Нормализовалась кожная температура и окраска кожных покровов пальцев кисти. При допплерографическом исследовании регистрировалось увеличение линейной скорости кровотока, снижение индекса периферического сопротивления. При лазерной доплерофлоуметрии отмечено увеличение базального кровотока. Результаты, полученные в обеих группах, представлены в таблице 2.
Показательным является тот факт, что в послеоперационном периоде больным не потребовалось назначения наркотических анальгетиков. У пациентов с язвенно-некротическими поражениями пальцев кисти (IV стадия) некротические изменения были устранены путем некрэктомии или местного лечения мазевыми повязками с достижением эпителизации в зоне дефекта. Неудовлетворительных результатов непосредственно после оперативного лечения ни в одной из групп зафиксировано не было
Изучение ближайших результатов представило определенные трудности, поскольку пациенты обеих групп сравнения после оперативного лечения получали значительное облегчение симптомов заболевания и, за редким исключением, в первые 6 месяцев не обращались за медицинской помощью, соответственно не обследовались и не получали плановой консервативной терапии. Поэтому судить о ближайших результатах ГСЭ в группах мы могли лишь по данным анкетирования, что внесло определенную долю субъективизма в исследование.
Ближайшие результаты лечения в I (основной) группе сравнения были оценены как хорошие у 12 пациентов (66,7%), как удовлетворительные – у 6 (33,3%), неудовлетворительных результатов не отмечено.
Во II группе сравнения хорошие результаты отмечались у 9 пациентов (64,3%), удовлетворительные – у 3 (21,4%), неудовлетворительные у 2 (14,3%).
Как видим, в ближайшем периоде во II группе сравнения зафиксированы неудовлетворительные результаты оперативного вмешательства, т.е. пациенты, у которых был отмечен рецидив. Поскольку эти пациенты в тот период обращались повторно за медицинской помощью, были госпитализированы и обследованы, в т.ч. и инструментально, детальное изучение этого контингента больных и объективное подтверждение негативных результатов, в соответствие с указанными выше критериями, не вызвало затруднений. На реовазограмме у этих больных отмечалось уменьшение РИ и повышение периферического сопротивления по сравнению с данными при выписке. При УЗДГ исследовании отмечался гипертонус артерий поверхностной ладонной дуги и пальцевых артерий, уменьшение линейной скорости кровотока, снижение пульсационного индекса. При проведении транскутанной оксигемометрии отмечалось снижение значения ТСРО2.
Причиной негативных результатов оперативного лечения в ближайшем периоде, нам видится, неполная десимпатизация, как погрешность оперативной техники. При этом либо не полностью пересекался симпатический ствол и оставались единичные адренергические волокна, либо не были пересечены коммуникантные ветви Th2 и Th3 узлов, либо оставалась интактной латеральная ветвь ганглия Th2 (нерв Кунца). В такой ситуации симпатическая иннервация верхних конечностей быстро восстанавливалась и патогенетическая цепь вновь замыкалась. Сделать подобные выводы нам позволил анализ протоколов операций больных с неудовлетворительными результатами. У одного больного с неудовлетворительным результатом имел место обширный спаечный процесс, после перенесенного плеврита, который значительно изменил синтопию органов в зоне операции и тем самым не позволил уверенно идентифицировать и пересечь все коммуникантные ветви и нерв Кунца. Во втором случае у больного гиперстеника был отмечен анатомический вариант строения симпатического ствола – рассыпчатый тип в сочетании с массивным развитием ретроплевральной клетчаки. Отдельно следует заметить, что оба случая относились к начальному периоду исследования, когда еще накапливался опыт ЭГСЭ, а также не был внедрен предложенный нами способ определения полноты десимпатизации.
Этим больным в последствии, в разное время, была выполнена пальцевая периартериальная симпатэктомия, значительно улучшившая течение заболевания.
Отдаленные результаты ЭГСЭ, к сожалению, хуже непосредственных и практически не отличались в группах сравнения (табл. 3).
Если непосредственно после оперативного лечения хороший клинический результат при котором купировались все симптомы БР и значительно улучшались инструментальные показатели микрогемодинамики, был отмечен у 22 (68,75%) пациентов, то в отдаленном периоде он сохранился лишь у 5 (15,6%) пациентов. У большинства же пациентов отдаленные результаты были оценены как удовлетворительные, т.е. имел место возврат клинических проявлений заболевания, но они носили более мягкий характер: частота и длительность пароксизмов вазоспазма были меньшими по сравнению с дооперационным периодом, болевой синдром маловыраженным, в межприступный период пальцы кистей оставались теплыми и имели обычную окраску, во всех случаях отсутствовали отеки и трофические нарушения. У 10 пациентов отмечены неудовлетворительные результаты, когда фиксировался полный возврат и прогрессирование прежних проявлений заболевания.
Принципиальным вопросом оценки отдаленных результатов ЭГСЭ были сроки возникновения рецидивов БР. Полученные данные представлены в таблице 4.
Как показывают результаты исследования, в I группе рецидив заболевания зафиксирован у 15 (83,3%) больных, во II группе у 12 (85,7%) больных. У части пациентов рецидив возник в промежуток от 6 месяцев до 1 года. В этот период происходит регенерация поврежденной нервной ткани. Так, в опытах на экспериментальных животных было установлено, что реиннервация симпатического ствола проявляется в период от 6 до 12 месяцев и мало прогрессирует в дальнейшем [3].
У подавляющего большинства пациентов рецидив заболевания возникал в сроки от 2 до 5 лет с момента выполнения ЭГСЭ, причем сроки рецидивирования практически не отличались в группах сравнения. Так, в I (основной) группе у большинства пациентов рецидив возникал через 4,2±0,9лет, а во II группе через 3,9±0,7 лет. Мы не согласны с авторами, объясняющими этот факт восстановлением симпатической иннервации в обход удаленных симпатических узлов, через латеральную ветвь второго грудного симпатического узла (нерв Кунца) [6], поскольку этот процесс происходит гораздо раньше – в первые 6 месяцев после операции. Более аргументированным нам видится объяснения в развитии со временем денервационной гиперчувствительности, т.е. повышение восприимчивости денервированных сосудов к циркулирующим катехоламинам, за счет увеличения популяции внесинаптических специфических рецепторов сосудов (a2, b2). Это является проявлением адаптации вегетативных эффекторов к активности иннервирующих их постганглионарных симпатических нейронов – когда происходит оперативная денервация, возрастает гуморальная чувствительность ткани [7].
Особо отметим тот факт, что количество свободно циркулирующего адреналина в плазме крови после десимпатизации остается на прежнем уровне, поэтому модуляция активности специфических внесинаптических a2- и b2-адренергических рецепторов сосудов, по своей интенсивности не может сравниться с устраненным нейрогенным симпатическим компонентом. Клинически это проявляется более доброкачественным течением заболевания и отсутствием некротических осложнений в отдаленном периоде у больных, перенесших грудную симпатэктомию.
Выводы
1. Эндоскопическая грудная симпатэктомия является малоинвазивным и эффективным методом оперативного лечения болезни Рейно.
2. Причиной рецидивов в ближайшем послеоперационном периоде является неполное пересечение симпатического ствола и коммуникантных ветвей.
3. Интраоперационный контроль полноты десимпатизации при ЭГСЭ, по предложенной нами методике, является залогом положительных результатов оперативного лечения и надежной профилактикой рецидивов заболевания в ближайшем послеоперационном периоде.
4. Отдаленные результаты ЭГСЭ хуже непосредственных: у 83% больных отмечается возвращение симптомов заболевания, но они носят более мягкий и благоприятный характер.
5. Причина рецидива в отдаленном периоде, вероятно, является развитие денервационной чувствительности сосудов акральных зон к циркулирующим катехоламинам.
1. Кохан Е.П. Удаление внутригрудных симпатических ганглиев в лечении болезни Рейно / Е.П. Кохан, О.В. Пинчук, А.В. Фоменко // Эндоскопическая хирургия. – 1997. – № 1. – С. 3-6.
2. Курганский О.В. Верхнегрудная симпатэктомия в лечении ишемии верхних конечностей при дистальных поражениях артериального русла / О.В. Курганский // Хирургия. – 2006. – № 6. – С. 49-53.
3. Лобут О.А. Репаративная регенерация нервных волокон после симпатэктомии. Экспериментальное исследование / О.А. Лобут, И.П. Макарова, С.Ю. Медведева // Ангиология и сосудистая хирургия. – 2004. – Т. 10, № 3. – С. 30-35.
4. Видеоторакоскопическая грудная симпатэктомия при болезни и синдроме Рейно / О.И. Миминошвили, О.А. Никонова, И.Н. Шаповалов [и др.] // Вестник неотложной и восстановительной медицины. – 2003. – Т.4, № 3. – С. 473-475.
5. Патент на корисну модель № 42612 Україна. МПК А61В17/00. Спосіб визначення повноти десимпатизації при торакоскопичній симпатектомії / Міміношвілі О.І., Перепелиця С.В., Ярощак С.В. (Україна). – Заявл. 03.03.09; Опубл. 10.07.09 // Бюл. № 13, 2009.
6. Спирин Ю.С. Хирургическое лечение пациентов с феноменом Рейно : дис... канд. мед. наук: 14.01.03 / Запорожская медицинская академия последипломного образования. – Запорожье, 2005. – С. 153.
7. Физиология человека. В 3 томах. Пер с англ. /Под ред. Р. Шмидта и Г. Тевса. – М.: Мир, 1996. – 875 с.
8. Cameron A.E. Specific complications and mortality of endoscopic thoracic sympathectomy / А.Е. Cameron // Clin. Auton. Res. – 2003. – Vol. 13, № 1. – Р. 31-35.
9. Lowelle R.S. Thoracoscopic cervicodorsal sympathectomy for Raynaud`s symptoms / R.S. Lowelle, P. Gloviczki, K.J. Cherry // Internal Angiology. – 1993. – Vol.12, № 2. – P. 168-172.
10. Endoscopic thoracic sympathicotomy for Raynaud’s phenomenon / Y. Matsumoto, T. Ueyama, M. Endo [et al.] // Journal Vascular Surgery. – 2002. – Vol. 36, № 1. – P. 57-61.

/39/39.jpg)
/41/41.jpg)
/42/42.jpg)