Журнал «» 6 (32) 2013
Вернуться к номеру
Поліморфізм генів ендотеліальної NO-синтази, ангіотензинперетворюючого ферменту та рецептора ангіотензину II типу 1 у хворих на ішемічну хворобу серця з артеріальною гіпертензією
Авторы: Целуйко В.Й., Яковлева Л.М. - Харківська медична академія післядипломної освіти
Рубрики: Семейная медицина/Терапия, Кардиология
Разделы: Клинические исследования
Версия для печати
Мета дослідження — вивчити особливості клінічних проявів ішемічної хвороби серця (ІХС) у хворих з артеріальною гіпертензією (АГ) та можливі асоціації мутації генів ендотеліальної NO-синтази (еNOs), ангіотензинперетворюючого ферменту (АПФ) та рецептора ангіотензину ІІ типу 1 (АT2R1) з розвитком гіпертензії у цих хворих.
Обстежені 120 хворих на ІХС із наявністю гемодинамічно значимих стенозів коронарних артерій (КА) за даними селективної коронарної вентрикулографії (СКВГ), із них 25 — без АГ (І група) та 95 — з АГ в анамнезі (ІІ група). Групу контролю становили 35 осіб без АГ в анамнезі та без атеросклеротичних змін коронарних артерій. Обстеження включало визначення швидкості клубочкової фільтрації (ШКФ), гомілково-плечового індексу та допплер-ультразвукове дослідження судин нижніх кінцівок та сонних артерій з кількісною оцінкою товщини комплексу інтима-медіа (ТКІМ), проведення навантажувального тесту за модифікованим протоколом Bruce. Дослідження алельного поліморфізму Т-786С промотора гена еNOs, інсерційно-делеційного (I/D) поліморфізму гена АПФ та поліморфізму А1166С гена АT2R1 проводили методом полімеразної ланцюгової реакції.
Установлено, що у хворих на ІХС при наявності АГ маніфестація ІХС відбувається в більш молодому віці, перебіг захворювання в більшому відсотку випадків ускладнюється розвитком інфаркту міокарда, атеросклеротичне ураження КА за даними СКВГ частіше має багатосудинний характер. При наявності АГ у хворих на ІХС вірогідно частіше зустрічаються такі фактори ризику, як цукровий діабет ІІ типу, обтяжена спадковість щодо раннього розвитку ІХС та субклінічне ураження сонних артерій (за ТКІМ) та нирок (за ШКФ). Установлено незалежний зв’язок D-алелі I/D-поліморфізму гена АПФ із розвитком АГ у хворих на ІХС — жителів Харківської області. Доведено наявність незалежного впливу С-алелі поліморфізму Т-786С промотора гена еNOs на ТКІМ, D-алелі I/D-поліморфізму гена АПФ — на ШКФ та незалежний зв’язок С- та D-алелей зазначених поліморфізмів генів із багатосудинним ураженням КА (за даними СКВГ).
Цель исследования — изучить особенности клинических проявлений ишемической болезни сердца (ИБС) у больных с артериальной гипертензией (АГ) и возможные ассоциации мутации генов эндотелиальной NO-синтазы (еNOS), ангиотензинпревращающего фермента (АПФ) и рецептора ангиотензина II типа 1 (АT2R1) с развитием гипертензии у этих больных.
Обследованы 120 больных ИБС с наличием гемодинамически значимых стенозов коронарных артерий (КА) по данным селективной коронарной вентрикулографии (СКВГ), из них 25 — без АГ (I группа) и 95 — с АГ в анамнезе (II группа). Группу конт-роля составили 35 человек без АГ в анамнезе и без атеросклеротических изменений коронарных артерий. Обследование включало определение скорости клубочковой фильтрации (СКФ), лодыжечно-плечевого индекса, допплер-ультразвуковое исследование сосудов нижних конечностей и сонных артерий с количественной оценкой толщины комплекса интима-медиа (ТКИМ), проведение нагрузочного теста по модифицированному протоколу Bruce. Исследование аллельного полиморфизма Т-786С промотора гена еNOS, инсерционно-делеционного (I/D) полиморфизма гена АПФ и полиморфизма А1166С гена АT2R1 проводили методом полимеразной цепной реакции.
Установлено, что у больных ИБС при наличии АГ манифестация ИБС происходит в более молодом возрасте, течение заболевания в большем проценте случаев осложняется развитием инфаркта миокарда, атеросклеротическое поражение КА по данным СКВГ чаще носит многососудистый характер. При наличии АГ у больных ИБС достоверно чаще встречаются такие факторы риска, как сахарный диабет II типа, отягощенная наследственность по раннему развитию ИБС, а также субклиническое поражение сонных артерий (по ТКИМ) и почек (по СКФ). Установлена независимая связь D-аллели I/D-полиморфизма гена АПФ с развитием АГ у больных ИБС, которые являются жителями Харьковской области. Доказано независимое влияние С-аллели полиморфизма Т-786С промотора гена еNOS на ТКИМ, D-аллели I/D-полиморфизма гена АПФ — на СКФ и независимая связь С- и D-аллелей указанных полиморфизмов с многососудистым поражением КА (по данным СКВГ).
The aim — to study the features of coronary heart disease (CHD) clinical manifestations in patients with arterial hypertension (AH) and the possible association of mutations endotelial NO-synthase (eNOS), angiotensin-converting enzyme (ACE) and angiotensin II receptor type 1 (AT2R1) genes with hypertension development in these patients.
120 patients with CHD with the presence of hemodynamically significant stenoses of the coronary arteries (CA) according to selective coronary ventriculography (SCVG) were examined, 25 of them — without AH (I group) and 95 — with a history of AH (II group). The control group included 35 people without a history of AH, and without atherosclerotic changes in the coronary arteries. The examination included the determination of glomerular filtration rate (GFR), ankle-brachial index (ABI), Doppler ultrasound of the lower extremities vessels (LEV) and carotid arteries with quantitative assessment of the intima-media thickness (IMT), as well as conducting a load test with the modified Bruce protocol. Study of allelic polymorphism T-786S of gene eNOS promoter, insertion-deletion (I/D) polymorphism of the ACE gene and polymorphism A1166S of AT2R1 gene was performed by polymerase chain reaction.
It is found that in patients with CHD in the presence of AH, CHD manifestation occurs at a younger age, course of disease in a larger percentage of cases is complicated by myocardial infarction, atherosclerotic lesion of CA, according to SCVG, is often of multivessel character. In the presence of AH in patients with CHD risk factors such as type II diabetes, family history of early CHD onset, as well as subclinical lesions of carotid artery (by IMT) and renal function (by GFR) were significantly more common. The independent association of the ACE gene I/D polymorphism D allele with the development of AH in patients with CHD who are residents of Kharkiv region was revealed. The independent influence of C allele of T-786S eNOS gene promoter polymorphism at IMT, D allele of I/D polymorphism of the ACE gene — at GFR and independent association of C and D alleles of these polymorphisms with multivessel CA impairment (according to SCVG) were proved.
Артеріальна гіпертензія (АГ) сьогодні залишається однією з найбільш значимих медикосоціальних проблем, що в основному зумовлено великою поширеністю захворювання та високим ризиком розвитку серцевосудинних ускладнень. Збільшення артеріального тиску (АТ) є незалежним та потужним фактором ризику (ФР) багатьох серцевосудинних захворювань (ССЗ), грізними ускладненнями яких є порушення мозкового кровообігу (ПМК), інфаркт міокарда (ІМ) та серцева недостатність (СН) [2].
Сьогодні переконливо доведений причиннонаслідковий зв’язок АГ із надлишковою вагою тіла, палінням, надмірним вживанням кухонної солі та алкоголю, низькою фізичною активністю, психосоціальним стресом та спадковістю [2]. Генетичні чинники можуть відігравати суттєву роль у розвитку АГ, але спроби пов’язати її розвиток із мутацією унікального гена або генів не зазнали успіху. Доведено, що успадкуванню АГ притаманні ряд особливостей, які підтверджують його полігенний характер [1, 6]. Саме тому в останні роки значна кількість досліджень присвячена пошуку так званих генівкандидатів, продукти експресії яких (фермент, рецептор, структурний або транспортний білок) можуть модулювати внесок тієї чи іншої ланки патогенезу й тим самим прямо або опосередковано впливати на розвиток АГ та клінічні прояви патогенетично пов’язаних із нею ССЗ [9, 10, 17].
Мета дослідження: вивчити особливості клінічних проявів ішемічної хвороби серця (ІХС) у хворих з АГ та можливі асоціації мутації генів ендотеліальної NOсинтази (еNOs), ангіотензинперетворюючого ферменту (АПФ) та рецептора ангіотензину ІІ типу 1 (АT2R1) із розвитком гіпертензії у цих хворих.
Матеріали та методи дослідження.
Обстежені 120 хворих на ІХС (108 чоловіків, 12 жінок), які перебували на обстеженні та лікуванні в Харківській міській клінічній лікарні № 8. Середній вік обстежених — 58,67 ± 0,77 року. Критерієм включення в дослідження були стабільна стенокардія напруження ІІ–ІІІ функціонального класу за класифікацією Канадського серцевосудинного суспільства (1974 р.) та наявність гемодинамічно значимих стенозів коронарних артерій (КА) за даними селективної коронарної вентрикулографії (СКВГ). Критеріями виключення були хронічна СН більше ніж ІІА стадії за класифікацією В.Х. Василенка та М.Д. Стражеска, тяжка супутня патологія (онкологічні захворювання, хронічна ниркова недостатність ІІ стадії, тяжкий перебіг цукрового діабету ІІ типу (ЦД) тощо). До дослідження не включали осіб, вік яких був меншим за 45 років.
У 95 (79,2 %) пацієнтів була діагностована гіпертонічна хвороба (ГХ). Від ожиріння (індекс маси тіла (ІМТ) більше за 30 кг/м2) страждали 48 (40,0 % ) хворих, ЦД ІІ типу — 26 (21,7 %), гіперліпідемія зустрічалася в 98 (81,7 %) обстежених. Такі ФР, як паління та зловживання алкоголем, були виявлені у 72 (60 %) та 20 (16,7 %) хворих відповідно. ІМ в анамнезі перенесли 86 (71,7 %) пацієнтів.
Групу контролю становили 35 осіб (середній вік — 57,7 ± 2,2 року), які не мали в анамнезі АГ, під час обстеження яких із різних причин результат навантажувального тесту був негативним, при проведенні СКВГ не було виявлено атеросклеротичних та морфологічних змін КА.
Обстеження хворих, окрім загальноприйнятого, включало визначення швидкості клубочкової фільтрації (ШКФ) за формулою MDRD, гомілковоплечового індексу (ГПІ) та допплерультразвукове дослідження судин нижніх кінцівок (СНК) та сонних артерій (СА) з кількісною оцінкою товщини комплексу інтимамедіа (ТКІМ), проведення навантажувального тесту за модифікованим протоколом Bruce.
Дослідження алельного поліморфізму Т786С промотора гена еNOs, інсерційноделеційного (I/D) поліморфізму гена АПФ та поліморфізму нонсенсмутації А1166С гена АT2R1 проводили методом полімеразної ланцюгової реакції (ПЛР) з електрофоретичною схемою детекції результату з використанням наборів реактивів «SNPэкспресс» виробництва ТОВ НПФ «Литех» (РФ). Виділення ДНК із букального епітелію виконували за допомогою реагента «ДНКэкспресс» виробництва ТОВ НПФ «Литех» (РФ) за інструкцією. Правильність розподілу частот генотипів визначалася відповідністю рівноваги Харді — Вайнберга (pi2 + 2 pipj + pj2 = 1). Відповідно до Гельсинської декларації усі пацієнти були проінформовані про проведення клінічного дослідження і дали згоду на визначення поліморфізму досліджуваних генів.
Статистична обробка отриманих даних проведена за допомогою пакета статистичних програм Statistica 8.0 (StatSoft Inc, США), Microsoft Office Exсel 2003. При нормальному розподілі кількісні ознаки були наведені у вигляді середнє ± стандартне відхилення (М ± s), із метою порівняння середніх двох вибірок використовували критерій Стьюдента. Міжгрупові відмінності якісних ознак оцінювали з використанням критерію χ2 Пірсона. Багатофакторний регресійний аналіз проводили для створення лінійного рівняння регресії. Коефіцієнти моделі розраховували за методом найменших квадратів. Відмінності коефіцієнтів регресії вважали статистично вірогідними при значенні р < 0,05.
Результати та обговорення
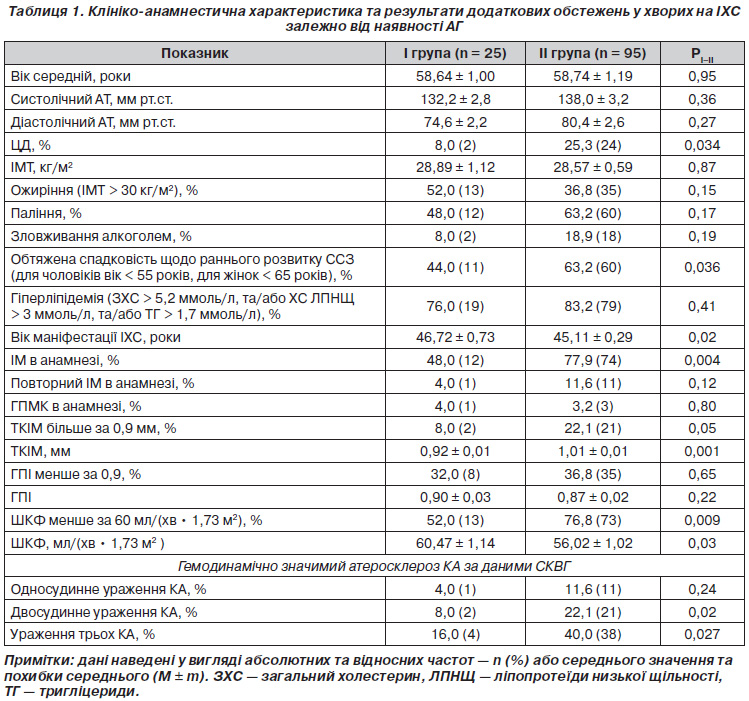
Залежно від наявності АГ обстежені нами хворі на ІХС були розподілені на дві групи (табл. 1).
До І групи увійшли 25 (20,8 %) хворих без АГ в анамнезі, ІІ групу становили 95 (79,1 %) осіб із діагнозом ГХ (у 86 (80,5 %) хворих — ГХ ІІІ стадії, 9 (9,5 %) — ІІ стадії).
Серед обстежених ІІ групи була виявлена АГ І ступеня у 8,4 % (8), ІІ ступеня — у 44,2 % (42), ІІІ — у 47,4 %(45) хворих. Оскільки на момент включення в дослідження всі пацієнти з ГХ отримували адекватну антигіпертензивну терапію, то за такими показниками, як систолічний АТ та діастолічний АТ, обстежені групи хворих статистично не відрізнялись.
Частка хворих на ЦД ІІ типу в групі пацієнтів з АГ становила 25,3 %, що втричі більше, ніж у І групі (8 %, p < 0,05). Отримані дані збігаються з результатами інших досліджень, у яких показано, що при наявності АГ ЦД ІІ типу розвивається у 2,5 раза частіше, ніж у нормотензивних осіб [11]. Це пояснюють наявністю спільних патогенетичних механізмів у розвитку обох захворювань, насамперед центральної та ренальної гіперсимпатикотонії та інсулінорезистентності [13].
Також у ІІ групі питома вага хворих, які мали обтяжену спадковість щодо раннього розвитку ССЗ, була більшою (p < 0,05), а вік маніфестації ІХС — меншим (p < 0,05). ІМ в анамнезі перенесли 77,9 % обстежених ІІ групи, що вірогідно більше, ніж у І групі (48 %, p < 0,05). При аналізі результатів СКВГ встановлено, що у хворих ІІ групи вірогідно частіше, ніж у І групі, зустрічалося багатосудинне ураження КА (p < 0,05).
Установлено, що відсоток хворих зі значенням ТКІМ більше за 0,9 мм, що є маркером ураження СА та розглядається як ФР ІХС та предиктор судинних катастроф, у ІІ групі обстежених був більшим, ніж у І групі (22 проти 8 %, відповідно, p < 0,05). Середнє значення ТКІМ у хворих ІІ групи обстежених становило 1,01 ± 0,01 мм, тоді як у І — 0,92 ± 0,01 мм (p < 0,05).
Проведений у нашому дослідженні аналіз ШКФ, що є визнаним маркером високого ризику несприятливих серцевосудинних подій, свідчить, що найбільший відсоток хворих зi зниженням ШКФ та найменше значення показника зареєстровані у групі хворих з АГ (p < 0,05).
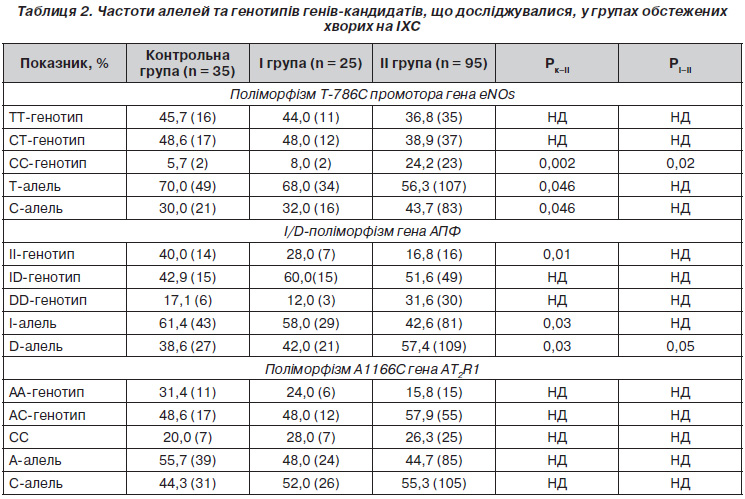
При аналізі поліморфізму Т786С промотора гена еNOs встановлено, що у групі обстежених з АГ частка хворих із патологічним CCгенотипом була вищою, ніж у групі контролю (24,2 проти 5,7 %, χ2 = 5,63, р = 0,002) та у І групі (24,2 проти 8,0 %, χ2 = 3,17, p = 0,02) (табл. 2).
У хворих ІІ групи зустрічальність Талелі була меншою, ніж у групі контролю (56,3 проти 70,0 %, χ2 = 3,99, p = 0,046), а мутантної Салелі — більшою (43,8 проти 30,0 %, χ2 = 3,99, p = 0,046). Отримані нами дані підтверджують результати інших досліджень, у яких доведено, що поліморфізм T786C (rs2070744) у промоторній ділянці гена є найбільш важливим щодо регулювання експресії гена eNOS, мутантна алель якого обумовлює зменшення продукції оксиду азоту [8, 14]. У метааналізі, що узагальнив результати генотипування означеного поліморфізму більше ніж в 11 тисяч осіб у європейській популяції, доведено суттєве зростання ризику розвитку АГ за наявності Cалелі [12].
При дослідженні I/Dполіморфізму гена АПФ встановлено, що зустрічальність домінантної Dалелі у хворих ІІ групи становила 57,4 %, що вірогідно більше, ніж у групі контролю —38,6 % (χ2 = 4,67, p = 0,03) та І групі — 42,0 % (χ2 = 3,77, p = 0,05).
Сьогодні накопичено багато даних щодо асоціації I/Dполіморфізму гена АПФ із розвитком АГ [1, 3, 6]. Так, наприклад, під час виконання Фремінгемського дослідження було встановлено, що наявність Dалелі гена АПФ асоціюється з більшим рівнем діастолічного АТ у чоловіків [7]. Є також свідчення про те, що у хворих на АГ носіїв Dалелі, у яких не було інших ФР, рівень АТ був більшим, ніж в осіб без АГ. У той же час в інших роботах, у яких досліджувалися більш неоднорідні групи хворих на АГ з іншими ФР, супутньою ІХС, які вже отримували антигіпертензивну терапію, подібні закономірності встановлені не були.
Поліморфізм А1166С гена АТ2R1, згідно з результатами одних досліджень, асоціюється з розвитком АГ та з обтяженою спадковістю щодо її розвитку [5, 16]. В інших роботах наявність кореляції АГ із поліморфізмом гена АТ2Р1 не підтверджена [4, 15]. У нашому дослідженні при проведенні порівняльного аналізу розподілу частот алелей і генотипів поліморфізму А1166С гена АT2R1 в групах обстежених хворих і в групі контролю статистично вірогідних відмінностей не встановлено.
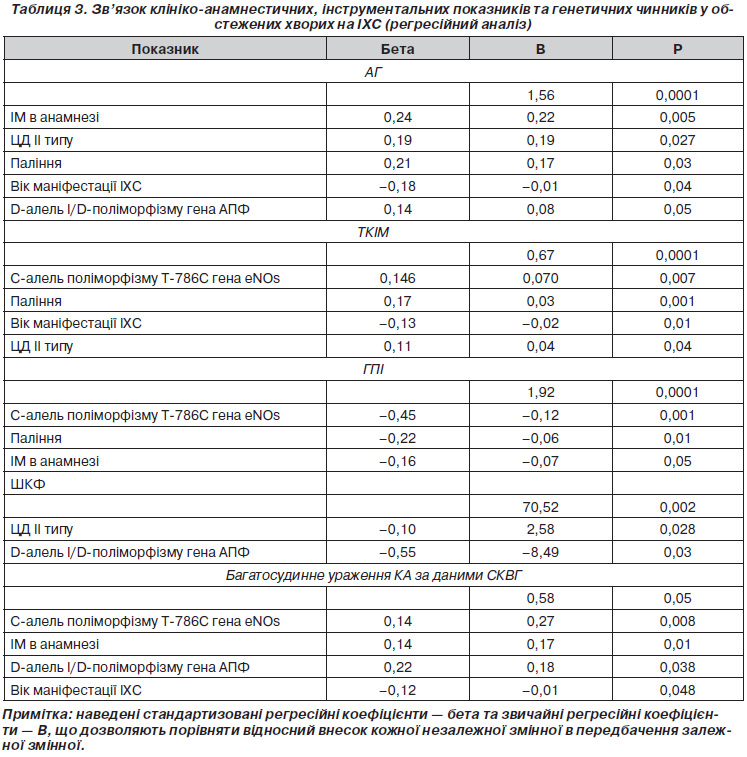
Проведений покроковий регресійний аналіз показав наявність незалежного зв’язку АГ із Dалеллю I/Dполіморфізму АПФ, палінням, перенесеним в анамнезі ІМ, ЦД ІІ типу та віком маніфестації ІХС (табл. 3).
Отримані нами дані щодо відсутності зв’язку АГ з іншими клінікоінструментальними та генетичними показниками, які вірогідно відрізнялись при порівнянні груп обстежених хворих між собою (табл. 2), можна пояснити незалежним характером впливу на них інших факторів, що вивчалися нами або не були предметом дослідження. Так, у нашому дослідженні збільшення ТКІМ незалежно пов’язано з такими показниками, як наявність алелі С поліморфізму Т786С гена еNOs, паління та ЦД ІІ типу; ШКФ — із наявністю Dалелі I/Dполіморфізму АПФ та ЦД ІІ типу, а багатосудинне ураження КА за даними СКВГ — із наявністю Dалелі I/Dполіморфізму АПФ, Салелі поліморфізму Т786С гена еNOs та перенесеним в анамнезі ІМ.
Висновки
1. Установлено, що у хворих на ІХС при наявності АГ маніфестація ІХС відбувається в більш молодому віці, перебіг захворювання в більшому відсотку випадків ускладнюється розвитком ІМ, атеросклеротичне ураження КА за даними СКВГ частіше має багатосудинний характер. При наявності АГ у хворих на ІХС вірогідно частіше зустрічаються такі ФР, як ЦД ІІ типу, обтяжена спадковість щодо раннього розвитку ІХС та субклінічне ураженням СА (за ТКІМ) та нирок (за ШКФ).
2. Установлено незалежний зв’язок Dалелі I/Dполіморфізму гена АПФ із розвитком АГ у хворих на ІХС — жителів Харківської області.
3. Доведено наявність незалежного впливу Салелі поліморфізму Т786С промотора гена еNOs на ТКІМ, Dалелі I/Dполіморфізму гена АПФ — на ШКФ та незалежний зв’язок С та Dалелей означених поліморфізмів генів з багатосудинним ураження КА (за даними СКВГ).
1. Дзяк Г.В. Генотипические «ансамбли» полиморфных маркеров генов ренинангиотензиновой системы у больных с гипертонической болезнью / Г В. Дзяк, Т.В. Колесник // Украинский кардиологический журнал. — 2008. — № 4.— С. 3439.
2. Сіренко Ю.М. Гіпертонічна хвороба і артеріальні гіпертензії: Монографія / Ю.М. Сіренко. — Донецьк: Видавець Заславський О.Ю., 2011. — 304 с.
3. Целуйко В.И. Влияние инсерционноделеционного полиморфизма гена ангиотензинпревращающего фермента на развитие и течение атеросклеротического процесса / В.И. Целуйко, И.В. Кузнецов, О.П. Медведь // Междунар. мед. журн. — 2008. — Т.14, № 2. — С. 3640.
4. Ashavaid T.F. ACE and AT1R gene polymorphisms and hypertension in Indian population / T.F.Ashavaid, K.K. Shalia, K.G. Nair, J.J. Dalal // J. Clin. Lab. Anal. — 2000. — Vol. 14(5). — P. 230237.
5. Bonnardeaux A. Angiotensin II type 1 receptor gene polymorphisms in human essential hypertension / A. Bonnardeaux, E. Davies, X. Jeunemaitre et al. // Hypertension. — 1994. — Vol. 24(1). — P. 6369.
6. Butler M.G. Genetics of hypertension. Current status / M.G. Butler // J. Med. Liban. — 2010. — Vol. 58(3). — P. 175178.
7. O’Donnel J. Evidence for association and genetic linkage of the angiotensinconverting enzyme locus with hypertension and blood in men but women in the Framyngham Heart Study / J. O’Donnel, K. Lindpainter, M.G. Larson et al. // Circulation. — 1998. — Vol. 97. — P. 17721776.
8. Dosenko V.E. Allelic polymorphism of endothelial NOsynthase gene and its functional manifestations / V.E. Dosenko, V. Yu. Zagoriy, N.V. Haytovich et al. // Acta Biochem. Pol. — 2006. — Vol. 53, № 2. — P. 299302.
9. Jiang X. Association between reninangiotensin system gene polymorphism and essential hypertension: a communitybased study / Jiang X., Sheng H., Li J. et al. // J. Hum. Hypertens. — 2009. — Vol. 23(3). — P. 17681. doi: 10.1038/jhh.2008.123.
10. Lieb W. Genetic predisposition to higher blood pressure increases coronary artery disease risk / W. Lieb, H. Jansen, C. Loley et al. // Hypertension. — 2013. — Vol. 61(5). — P. 9951001. doi: 10.1161/HYPERTENSIONAHA.111.00275.
11. Makrilakis K., Bakris G. Diabetic hypertensive patients: improving their prognosis / K. Makrilakis, G. Bakris // J. Cardiovasc. Pharmacol. — 1998. — Vol. 31 (Suppl. 2). — P. S3440.
12. Niu W. An updated metaanalysis of endothelial nitric oxide synthase gene: three wellcharacterized polymorphisms with hypertension / W. Niu, Y. Qi // PLoS One. — 2011. — Vol. 6(9). — P. e24266.
13. Putnam K. The reninangiotensin system: a target of and contributor to dyslipidemias, altered glucose homeostasis, andhypertension of the metabolic syndrome / K. Putnam, R. Shoemaker, F. Yiannikouris, L.A. Cassis // Am. J. Physiol. Heart. Circ. Physiol. — 2012. — Vol. 302(6). — P. H121930. doi: 10.1152/ajpheart.00796.2011.
14. Salimi S. Association of plasma nitric oxide concentration and endothelial nitric oxide synthase T786C gene polymorphism in coronary artery disease / S. Salimi, A. Naghavi, M. Firoozrai et al. // Pathophysiology. — 2012. — Vol. 19(3). — P. 157162.
15. Takami S. Angiotensin II type 1 receptor gene polymorphism is associated with increase of left ventricular mass but not with hypertension / S. Takami, T. Katsuya, H. Rakugi et al. // Am. J. Hypertens. — 1998. — Vol. 11(3 Pt 1). — P. 316321.
16. Wang J.L. Angiotensin II type 1 receptor gene A1166C polymorphism and essential hypertension in Chinese: a metaanalysis / J.L. Wang,X. Li, P.P. Hao et al. // J. Renin Angiotensin Aldosterone Syst. — 2010. — Vol. 11(2). — P. 12735. doi: 10.1177/1470320310364181.
17. Zhang C. Genetic Associations with Hypertension: MetaAnalyses of Six Candidate Genetic Variants / C. Zhang, L. Wang, Q. Liao et al. // Genet. Test. Mol. Biomarkers. — 2013. — Jul 16 [Epub ahead of print].