Газета «Новости медицины и фармации» Гастроэнтерология (489) 2014 (тематический номер)
Вернуться к номеру
Изучение литогенных свойств желчи у больных желчнокаменной болезнью, методы коррекции
Авторы: Гулько О.Н. - К.м.н., старший научный сотрудник отделения хирургии сочетанной патологии
и заболеваний забрюшинного пространства; Национальный институт хирургии и трансплантологии им. А.А. Шалимова, г. Киев
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 19-22
 Желчнокаменная болезнь (ЖКБ) — образование камней в желчном пузыре или в желчных протоках, известна с глубокой древности. C тех пор актуальность этой проблемы не снята с повестки дня, и с каждым годом она приобретает все большую остроту. В течение последних трех десятилетий распространенность ЖКБ в промышленно развитых странах увеличивалась в геометрической прогрессии. В СССР частота диагностированного при жизни холелитиаза увеличивалась вдвое в течение каждых 10 лет, а в 80-е годы на аутопсии желчнокаменную болезнь выявляли у каждого десятого умершего [1]. В начале 2000-х годов в Германии было зарегистрировано более 5 млн, а в США — более 15 млн больных ЖКБ и считалось, что заболеванием страдает около 10 % взрослого населения [2–3].
Желчнокаменная болезнь (ЖКБ) — образование камней в желчном пузыре или в желчных протоках, известна с глубокой древности. C тех пор актуальность этой проблемы не снята с повестки дня, и с каждым годом она приобретает все большую остроту. В течение последних трех десятилетий распространенность ЖКБ в промышленно развитых странах увеличивалась в геометрической прогрессии. В СССР частота диагностированного при жизни холелитиаза увеличивалась вдвое в течение каждых 10 лет, а в 80-е годы на аутопсии желчнокаменную болезнь выявляли у каждого десятого умершего [1]. В начале 2000-х годов в Германии было зарегистрировано более 5 млн, а в США — более 15 млн больных ЖКБ и считалось, что заболеванием страдает около 10 % взрослого населения [2–3].
Оперативное лечение — золотой стандарт лечения желчнокаменной болезни. В Украине ежегодно выполняется 29–30 тысяч операций при ЖКБ. За последнее 10-летие количество холецистэктомий (традиционных и лапароскопических) увеличилось c 24 до 30 тысяч, а частота на 10 тыс. населения — с 4,93 до 6,53 [4].
Согласно литературным данным около 40 % пациентов повторно обращаются за медицинской помощью в связи с развитием постхолецистэктомического синдрома. До 70 % больных после холецистэктомии имеют явления хронического «мягкого» холестаза, хронического холестатического гепатита и компенсаторного желчно-кислотозависимого апоптоза гепатоцитов [5–6].
У 80–90 % пациентов американцев и европейцев определяются холестериновые желчные конкременты (с удельным весом холестерина ≥ 50 %), реже встречаются смешанные конкременты, в которых содержание холестерина колеблется от 20 до 50 % [7].
Одной из главных причин возникновения холестериновых камней служит синтез печенью литогенной желчи. Максимальное насыщение желчи холестерином происходит вследствие ее концентрирования в межпищеварительный период. Однако соотношение молекул желчных кислот и холестерина в пропорции 60 : 10 при наличии 30 молекул фосфатидилхолина способствует растворению холестерина и образованию мицелл. Увеличение молярного соотношения холестерин/фосфатидилхолин до критических значений способствует перенасыщению желчи холестерином, что является фактором образования билиарного сладжа. Экспериментально установлено, что при отсутствии фосфатидилхолина для растворения 3 молекул холестерина требуется около 97 молекул желчных кислот.
Треугольные координаты, которые иллюстрируют растворимость холестерина [8], приведены на рис. 1.
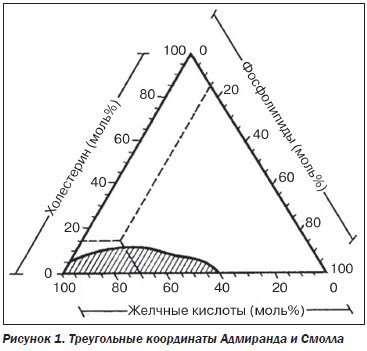
Если общее содержание желчных кислот, лецитина и холестерина принять за 100 %, то любое их соотношение можно представить в виде точки внутри данного треугольника. Заштрихованная зона представляет соотношения трех компонентов, при которых холестерин остается в растворе и не выпадает в виде кристаллов. Желчь, в которой количественные соотношения этих трех компонентов находятся вне заштрихованной зоны, называется литогенной.
Анализируя причины возникновения и факторы, которые приводят к образованию холестериновых конкрементов, можно выделить следующие группы пациентов с ЖКБ:
1. Пациенты, у которых с возрастом снижаются обменные процессы и повышается содержание холестерина в желчи.
2. Пациенты с избыточной массой тела, метаболическим синдромом (у них тоже определяется повышение уровня холестерина).
3. Пациенты, которые неправильно питаются и не имеют адекватных физических нагрузок.
4. Женщины после беременности, родов или принимающие пероральные контрацептивы.
Практически у всех этих пациентов есть избыточная масса тела, нарушены литогенные свойства желчи и наблюдаются изменения в печени. И все это остается даже после операции.
Таким образом, имеющиеся на сегодняшний день данные позволяют утверждать, что холелитиаз и нарушения липидного обмена, стеатоз печени — компоненты одного и того же процесса.
Поэтому пациентам с ЖКБ целесообразно назначение препарата на основе фосфатидилхолина, который улучшит функциональное состояние печени, будет способствовать нормализации обмена холестерина и улучшит литогенные свойства желчи.
Всеми вышеперечисленными свойствами обладает современный препарат Энерлив® («Берлин-Хеми Менарини», Германия). В его состав входят обезжиренные, обогащенные фосфолипиды соевых бобов. Препарат содержит от 73 до 79 % (в среднем 76 %) фосфатидилхолина — основного компонента клеточных мембран. Фармацевтическими технологами были максимально учтены требования безопасности: в отличие от других препаратов на основе эссенциальных фосфолипидов в составе Энерлива отсутствуют красящие компоненты (такие как Е171 и Е172), а также стабилизатор (такой как Е487). В Энерливе содержатся полиненасыщенные жирные кислоты — линолевая и линоленовая, которые обладают холестеринснижающим эффектом.
Цель исследования. Целью нашего исследования было изучение влияния Энерлива на литогенные свойства желчи у пациентов, перенесших лапароскопическую холецистэктомию.
Материалы и методы
Для своего исследования мы отбирали пациентов с холестериновыми желчными камнями. Руководствовались тем, что, по данным S. Gokulakrishnan [9], визуальная оценка цвета камней позволяет с высокой достоверностью разделить желчные камни по составу на две основные группы — холестериновые и билирубиновые, что было подтверждено при инфракрасном анализе состава камней.
После холецистэктомии проводили макроскопическое исследование конкрементов. Характерными особенностями холестериновых камней были: светло-серый или светло-коричневый цвет, мелкозернистая структура и хрупкость при механическом воздействии. Для исследования была отобрана группа больных, у которых были выявлены холестериновые камни.
В желчи исследовалось содержание холестерина, холевой кислоты и фосфолипидов. Определение холевой кислоты желчи проводилось по методу J.G. Reinhold и D.W. Wilson (1932). Содержание холевой кислоты в желчи выражают в миллиграмм-процентах. Для выражения результата в миллимолях на литр результат в миллиграмм-процентах умножают на 0,02547. Определение холестерина желчи проводилось по методу Илька, который основан на реакции Либерманна — Бурхарда. Содержание холестерина выражают в миллиграмм-процентах. Для выражения результатов в миллимолях на литр найденную величину (мг%) умножают на 0,02586. Определение липидного комплекса желчи проводилось при помощи электрофореза с добавлением к образцам краски судана черного, смеси спирта и ледяной уксусной кислоты и последующим колориметрированием при красном светофильтре. Количество липидного комплекса выражают в миллимолях на литр.
На основании полученных результатов рассчитывали коэффициент холиевая кислота/холестерин (ХК/Х) и коэффициент фосфолипиды/холестерин (Ф/Х). Исследование желчи проводили при рН не ниже 7,0.
Интраоперационно, после клипирования пузырного протока, рассекали, а затем катетеризировали пузырный проток тонким катетером по направлению к воротам печени и проводили забор так называемой печеночной желчи в количестве 50 мл. После макроскопической оценки конкрементов из удаленного желчного пузыря и определения их холестериновой природы желчь отправляли на биохимическое исследование.
Нами было отобрано 45 пациентов после лапароскопической холецистэктомии, у которых макроскопически определена холестериновая природа конкрементов. Среди пациентов было 32 (71,1 %) женщины и 13 (28,9 %) мужчин в возрасте от 22 до 56 лет (средний возраст 42,3 ± 2,8 года). В исследование не включали больных с органическими стриктурами желчевыводящих протоков, рецидивным холедохолитиазом, признаками воспалительно-деструктивных поражений ткани печени. В дооперационном периоде больным проводились лабораторные (общий анализ крови, биохимический анализ крови с обязательным определением билирубина, активности щелочной фосфатазы, аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ), холестерина, инструментальные (ультразвуковое исследование (УЗИ), фиброгастродуоденоскопия) исследования. Также измеряли рост, массу тела, рассчитывали индекс массы тела (ИМТ) по формуле Кетле: ИМТ = масса тела/рост2 .
Пациенты были разделены на 2 группы. В первую вошло 25 больных, которым в послеоперационном периоде начиная с 3-х суток после операции назначали Энерлив® курсом по 2 капсулы 3 раза в день во время приема пищи в течение 90 дней. Во вторую (контрольную) группу было включено 20 больных, которым не назначалась терапия фосфолипидными препаратами.
После окончания курса всем исследуемым больным проводили дуоденальное зондирование и исследовали порцию С с целью определения вышеописанных биохимических параметров желчи.
Статистический анализ данных осуществлялся с использованием стандартных пакетов программ (Statistica, MS Excel) для персональных компьютеров.
Результаты и обсуждение
У 31 (68,9 %) обследованного пациента с желчнокаменной болезнью отмечено увеличение массы тела и ИМТ. Среди них избыточная масса тела (ИМТ = 28,8 ± 1,5 кг/м2) была диагностирована у 28 (90 %) больных, а ожирение 1-й степени (ИМТ = 32,8 ± 1,2 кг/м2) — у 3 (10 %). Эти данные свидетельствуют о нарушении обмена веществ у пациентов с желчнокаменной болезнью.
В послеоперационном периоде больные жаловались на умеренную боль и чувство тяжести в правом подреберье — 39 больных, горечь во рту — 19 больных, метеоризм — 21 больной. По данным биохимических исследований, до лечения уровень билирубина в сыворотке крови составил в среднем 32 ± 12 мкмоль/л; холестерина — 7,6 ± 0,5 ммоль/л; активность АлАТ — 51,0 ± 4,2 Ед/л, АсАТ — 49,0 ± 5,1 Ед/л, щелочной фосфатазы — 412,3 ± 15,6 Ед/л. По данным УЗИ, у 40 пациентов была диагностирована гепатомегалия, повышение эхогенности паренхимы с эффектом ослабления в глубоких отделах печени, обусловленные жировой инфильтрацией печени: в контрольной группе — у 17 больных, в исследуемой группе — у 23.
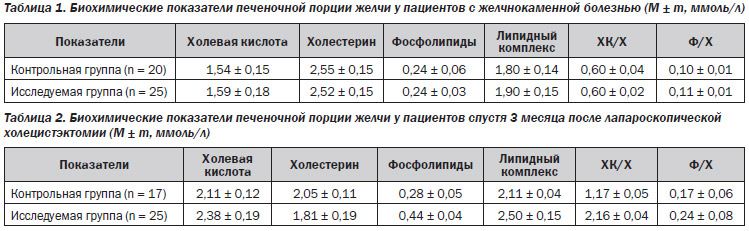
Сравнительный анализ биохимических свойств печеночной порции желчи, полученной во время оперативного вмешательства, у пациентов обеих групп представлен в табл. 1.
При изучении биохимического состава печеночной желчи у пациентов обеих групп выявлено повышение концентрации холестерина, достоверное снижение концентрации холевой кислоты, липидного комплекса, фосфолипидов, холатохолестеринового коэффициента. Таким образом, результаты, полученные в ходе исследования, достоверно показывают, что у больных с желчнокаменной болезнью секретируется более литогенная желчь с повышенным содержанием холестерина, дефицитом желчных кислот и фосфолипидов, необходимых для стабилизации холестерина в желчи. После оценки полученных результатов 25 пациентам назначена терапия фосфолипидным препаратом (Энерлив®).
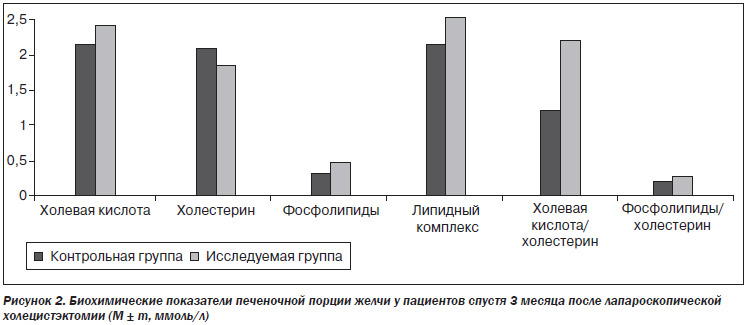
Через 90 дней после операции у пациентов конт–рольной группы (n = 17) (трое больных не явились) и у пациентов, принимающих Энерлив®, проведено биохимическое исследование печеночной порции желчи. Данные исследования приведены в табл. 2, на рис. 2.
При сопоставлении биохимических параметров печеночной порции желчи в сравниваемых группах мы видим следующую картину: в контрольной группе остается сниженной концентрация холевой кислоты, липидного комплекса, фосфолипидов, сниженный уровень холатохолестеринового коэфициента. В исследуемой группе наблюдается значительное улучшение биохимических параметров печеночной желчи, нормализация литогенных свойств.
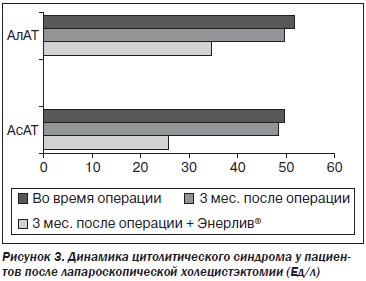
При оценке биохимических анализов крови у больных исследуемой группы отмечена нормализация биохимических показателей: уровень общего холестерина снизился в 1,5 раза и составил 5,1 ± 0,4 ммоль/л, активность АлАТ — 34,0 ± 3,3 Ед/л, АсАТ — 25,2 ± 4,2 Ед/л, активность щелочной фосфатазы уменшилась в 1,3 раза и составила 316,9 ± 3,3 Ед/л. В контрольной группе существенных изменений биохимических показателей сыворотки крови не отмечено: уровень билирубина в сыворотке крови составил в среднем 18,2 ± 6,2 мкмоль/л; холестерина — 7,5 ± 0,5 ммоль/л; активность АлАТ — 49,0 ± 4,2 Ед/л, АсАТ — 48,0 ± 5,1 Ед/л (рис. 3), щелочной фосфатазы — 400,3 ± 15,6 Ед/л.
По данным УЗИ, у 21 (91,3 %) больного исследуемой группы нормализовались размеры печени, снизилась гиперэхогенность, жировая инфильтрация, в контрольной группе улучшение ультрасонографических параметров отмечалось у 3 (17,6 %) пациентов.
Полученная картина позволяет сделать следующие выводы.
Во-первых, к сожалению, оперативное вмешательство окончательно не излечивает больного от желчнокаменной болезни, а лишь устраняет самые явные ее симптомы. Это обстоятельство заставляет искать комплексные решения такой сложной междисциплинарной проблемы.
Во-вторых, изменения биохимического состава печеночной желчи у больных после холецистэктомии — снижение содержания холевой кислоты и фосфолипидов — указывают на нарушение коллоидной устойчивости желчи, что может быть обусловлено не только ее застоем и снижением концентрационной функции желчного пузыря, но и измененной желчеобразующей функцией печени.
В-третьих, назначение Энерлива в послеоперационном периоде существенно уменьшает литогенные свойства желчи, что, в свою очередь, может способствовать уменьшению случаев развития постхолецистэктомического синдрома и холедохолитиаза.
В-четвертых, препарат Энерлив®, обладая гепатопротекторным и гипохолестеринемическим действием, способствует устранению цитолитического синдрома и улучшению липидного обмена, а также сонографических параметров при оценке функционального состояния печени.
В заключение следует подчеркнуть, что фосфолипиды по химической конфигурации соответствуют мембранным фосфолипидам и демонстрируют хорошую переносимость во всех проведенных клинических исследованиях, поэтому их применение обосновано как с позиции доказанной эффективности, так и с позиции подтвержденной безопасности. Побочные эффекты и токсические реакции на фоне применения эссенциальных фосфолипидов не ожидаются, что повышает приверженность врачей и пациентов к лечению этой перспективной группой препаратов.
Таким образом, клиническое значение эссенциальных фосфолипидов, несмотря на их длительное применение в медицинской практике, не уменьшается, но, напротив, возрастает, а круг показаний к их использованию расширяется.
1. Болезни печени и желчевыводящих путей: Руководство для врачей / Под ред. В.Т. Ивашкина. — М.: М–Вести, 2002. — 416 с.
2. Sun H., Tang H., Jiang S. et al. Gender and metabolic differences of gallstone diseases // World J. Gastroenterol. — 2009, April 21. — 15 (15). — 1886–1891.
3. Sandler R.S., Everhart J.E., Donowitz M. et al. The burden of selected digestive diseases in the United States // Gastroenterology. — 2002 May. — 122 (5). — 1500–1511.
4. Гойда С.М. Тенденції поширеності жовчнокам’яної хвороби серед населення України // Український медичний часопис. — 2011. — 4 (84). — 111–113.
5. Нестеренко Ю.А., Лаптев В.В., Цкаев А.Ю. и др. Актуальные вопросы диагностики и лечения больных микрохоледохолитиазом // Анналы хирургической гепатологии. — 2007. — Т. 12, № 2. — С. 62–68.
6. Мехтиев С.Н., Гриневич В.Б., Кравчук Ю.А., Богданов Р.Н. Билиарный сладж: нерешенные вопросы // Лечащий врач. — 2007. — № 6. — С. 4–7.
7. Афанасьев В.В., Лукьянова И.Ю., Климанцев С.А. Роль эссенциальных фосфолипидов в регуляции функциональных систем // Эксперим. и клин. гастроэнтерол. — 2007. — № 5. — С. 124–135.
8. Шерлок Ш., Дули Дж. Заболевания печени и желчных путей: Практич. рук. Пер. с англ. / Под ред. З.Г. Апросиной, Н.А. Мухина. — М.: ГЭОТАР–Медицина, 1999.
9. Gokulakrishnan S., Murugesan R., Mathew S., Prasanthi R., Ashok A.C., Ramesh H., Sivakumar G., Surendran R., Jayanthi V. Predicting the composition of gallstones by infrared spectroscopy // Trop. Gastroenterol. — 2001 Apr–Jun. — 22(2). — 87–9.