Газета «Новости медицины и фармации» Гастроэнтерология (489) 2014 (тематический номер)
Вернуться к номеру
Гастроезофагеальна рефлюксна хвороба (Адаптована клінічна настанова, заснована на доказах)
Разделы: Официальная информация
Версия для печати
Статья опубликована на с. 34-47
Робоча група з адаптації клінічної настанови
|
Харченко Наталія В’ячеславівна |
Завідувач кафедри гастроентерології, дієтології і ендоскопії Національної академії післядипломної освіти імені П.Л. Шупика, член-кор. Національної академії медичних наук України, професор, доктор медичних наук, головний позаштатний спеціаліст МОЗ України зі спеціальності «Гастроентерологія» |
|
Бабак Олег Якович |
Завідувач відділу ДУ «Інституту терапії імені Л.Т. Малої НАМН України», професор, доктор медичних наук, віце-президент Української гастроентерологічної асоціації |
|
Фомін Петро Дмитрович |
Завідувач кафедри факультетської хірургії № 2 Національного медичного університету імені О.О. Богомольця, академік Національної академії медичних наук України, професор, доктор медичних наук, головний позаштатний спеціаліст МОЗ України зі спеціальності «Хірургія» |
|
Матюха Лариса Федорівна |
Завідувач кафедри сімейної медицини Національної медичної академії післядипломної освіти імені П.Л. Шупика, професор, доктор медичних наук, головний позаштатний спеціаліст МОЗ України зі спеціальності «Загальна практика — сімейна медицина» |
|
Ткач Сергій Михайлович |
Професор кафедри внутрішньої медицини № 1 Національного медичного університету імені О.О. Богомольця, професор, доктор медичних наук |
|
Захараш Михайло Петрович |
Завідувач кафедри хірургії № 1 Національного медичного університету імені О.О. Богомольця, член-кор. Національної академії медичних наук України, професор, доктор медичних наук, головний позаштатний спеціаліст МОЗ України зі спеціальності «Проктологія» |
|
Звягінцева Тетяна Дмитрівна |
Завідувач кафедри гастроентерології Харківської медичної академії післядипломної освіти, професор, доктор медичних наук |
|
Скрипнік Ігор Миколайович |
Завідувач кафедри внутрішньої медицини № 1 Вищого державного навчального закладу України «Українська медична стоматологічна академія», професор, доктор медичних наук |
|
Корендович Володимир Степанович |
Головний позаштатний спеціаліст зі спеціальності «Гастроентерологія» Управління охорони здоров’я Житомирської обласної державної адміністрації, завідувач гастроентерологічного відділення Житомирської обласної клінічної лікарні ім. О.Ф. Горбачевського |
|
Драгомирецька Наталія Володимирівна |
Головний науковий співробітник, керівник відділу відновного лікування хворих гастроентерологічного профілю ДП «Український науково-дослідний інститут медичної реабілітації та курортології» МОЗ України, професор кафедри загальної практики та медичної реабілітації Одеського національного медичного університету, доктор медичних наук |
|
Нікішаєв Володимир Іванович |
Завідувач відділення ендоскопічної діагностики та малоінвазивної хірургії Київської міської клінічної лікарні швидкої медичної допомоги, доктор медичних наук |
|
Свінціцький Анатолій Станіславович |
Завідувач кафедри внутрішньої медицини № 3 Національного медичного університету імені О.О. Богомольця, професор, доктор медичних наук |
|
Дроговоз Світлана Мефодіївна |
Професор кафедри фармакології Харківського національного фармацевтичного університету, професор, доктор медичних наук |
|
Червак Ігор Миколайович |
Головний позаштатний спеціаліст зі спеціальності «Гастроентерологія» Головного управління охорони здоров’я Київської міської державної адміністрації, завідувач гастроентерологічного відділення Київської міської клінічної лікарні № 8 |
|
Коруля Ірина Анатоліївна |
Доцент кафедри гастроентерології, дієтології і ендоскопії Національної академії післядипломної освіти імені П.Л. Шупика, кандидат медичних наук |
|
Марухно Ірина Сергіївна |
Асистент кафедри гастроентерології, дієтології і ендоскопії Національної академії післядипломної освіти імені П.Л. Шупика, кандидат медичних наук |
|
Бабінець Лілія Степанівна |
Завідувач кафедри загальної практики — сімейної медицини Тернопільського Державного медичного університету iменi I.Я. Горбачeвського, професор, доктор медичних наук |
|
Рассказова Людмила Миколаївна |
Завідувач амбулаторії загальної практики — сімейної медицини с. Іванівка, Ставищанський район, Київська область |
|
Маяцька Оксана Віталіївна |
Асистент кафедри сімейної медицини та амбулаторно-поліклінічної допомоги Національної медичної академії післядипломної освіти імені П.Л. Шупика, кандидат медичних наук |
Методичний супровід та інформаційне забезпечення
|
Ліщишина Олена Михайлівна |
Директор Департаменту стандартизації медичних послуг ДП «Державний експертний центр МОЗ України» |
|
Степаненко Алла Василівна |
Радник Міністра охорони здоров’я, консультант ДП «Державний експертний центр МОЗ України», професор, доктор медичних наук |
|
Горох Євген Леонідович |
Начальник відділу якості медичної допомоги та інформаційних технологій ДП «Державний експертний центр МОЗ України» |
|
Шилкіна Олена Олександрівна |
Начальник відділу методичного забезпечення нових технологій в охороні здоров’я ДП «Державний експертний центр МОЗ України» |
Державний експертний центр МОЗ України є членом
Guidelines International Network (Міжнародна мережа настанов)
ADAPTE (Франція) (Міжнародний проект з адаптації клінічних настанов)
Рецензенти
|
Лисенко Григорій Іванович |
Директор Інституту сімейної медицини Національної медичної академії післядипломної освіти імені П.Л. Шупика, професор, доктор медичних наук |
|
Безруков Владислав Вікторович |
Директор Державної установи «Інститут геронтології імені Д.Ф. Чеботарьова Національної академії медичних наук України», академік Національної академії медичних наук України, професор, доктор медичних наук |
Перегляд адаптованої клінічної настанови: липень 2016 року.
Зміст
Список скорочень
1. Вступ. Передмова робочої групи
2. Ключові моменти
3. Клінічна проблема
4. Обґрунтування рекомендацій
5. Лікування ГЕРХ
6. Неефективність лікування
7. Підтримуюча терапія
8. Особливі обставини
9. Суперечливі питання
10. Стратегія літературного пошуку
Список літератури, представлений в прототипі адаптованої клінічної настанови
Список літератури, що була використана у процесі адаптації
Перелік скорочень
БА – Бронхіальна астма
ГЕРХ – Гастроезофагеальна рефлюксна хвороба
H.рylori – Helicobacter pylori
H2RAs – Антагоністи Н2-рецепторів гістаміну
ЕГДС – Езофагогастродуоденоскопія
ЕКГ – Електрокардіографія
ІПП – Інгібітор протонної помпи
НЕРХ – Неерозивна рефлюксна хвороба
НЕЗС – Неерозивні захворювання стравоходу
НСС – Нижній стравохідний сфінктер
ШКТ – Шлунково-кишковий тракт
1. Вступ. Передмова робочої групи
ГЕРХ як самостійна нозологічна одиниця одержала офіційне визнання в жовтні 1997 р. на міждисциплінарному конгресі гастроентерологів і ендоскопістів в м. Генвалі (Бельгія). Всесвітньою організацією гастроентерологів ГЕРХ визнано захворюванням ХХІ століття, від якого страждає від 20 до 50 % населення різних країн світу. В Україні статистична реєстрація ГЕРХ почалась з 2009 року, і, на жаль, дані ще не є повними і складають 10 випадків на 1000 населення.
ГЕРХ — хронічна хвороба з довготривалим перебігом, що значно погіршує якість життя хворого. В той же час практикуючі лікарі і самі пацієнти недооцінюють значення цього захворювання. У більшості випадків хворі пізно звертаються до лікаря за медичною допомогою і навіть при виражених симптомах лікуються самостійно. Лікарі, у свою чергу, погано поінформовані про дане захворювання і недооцінюють його наслідки, нераціонально проводять лікування ГЕРХ. Вкрай рідко діагностується таке серйозне ускладнення ГЕРХ, як стравохід Барретта, що розглядається як передраковий стан. Дійсна поширеність захворювання мало вивчена. Це пов’язано з великою варіабельністю клінічних проявів: від епізодичної печії, при якій хворі рідко звертаються до лікаря, до виражених ознак ускладненого рефлюкс-езофагіту, що вимагає госпіталізації.
У більшості хворих симптоми ГЕРХ є слабо вираженими і спорадичними, з приводу яких вони не звертаються до лікарів, а самостійно приймають ліки або користуються порадами знайомих. Саме ці хворі становлять, за образним визначенням D.O. Castell, найбільшу підводну частину айсберга і складають 70–80 % всіх випадків захворювання («телефонні рефлюкси»). Середня надводна частина айсберга — це хворі з рефлюкс-езофагітом (20–25 %) із вираженими або постійними симптомами, але без ускладнень, яким необхідно проводити регулярне амбулаторне спостереження й лікування («амбулаторні рефлюкси»). Нарешті, верхівка айсберга — це невелика група хворих (2–5 %), у яких розвинулися ускладнення (кровотечі, стриктури стравоходу, стравохід Барретта) і які потребують стаціонарного лікування («госпітальні рефлюкси»).
Серед дорослого населення Європи і США печія — кардинальний симптом ГЕРХ — зустрічається у 20–40 %. Причому печію щодня відчувають 10 % населення, щотижня — 30 %, щомісячно — 50 %, проте тільки 2 % пацієнтів лікуються з приводу ГЕРХ. Рефлюкс-езофагіт виявляється у 6–12 % осіб, яким проводиться ендоскопічне дослідження. В Японії, де широко застосовуються скринінгові обстеження населення, тільки ендоскопічно позитивна ГЕРХ виявляється в 16,5 % випадків. Частота виникнення важкого езофагіту в загальній популяції складає 5 випадків на 100 000 населення за рік. Поширеність стравоходу Барретта серед осіб з езофагітом наближається до 8–10 %, при цьому ризик подальшого розвитку аденокарциноми підвищується в десятки разів: до 800 випадків на 100 тис. населення на рік. Поширеність ГЕРХ у стаціонарних хворих складає 30 %, ерозивний езофагіт виявляється у 13 %, НЕРХ — у 16,7 %. У 25 % випадків ГЕРХ проявляється тільки позастравохідними симптомами.
Прототип настанови
Адаптована клінічна настанова «Гастроезофагеальна рефлюксна хвороба» є адаптованою для системи охорони здоров’я України версією клінічної настанови University of Michigan Guidelines for Health System Clinical Care — Gastroesophageal Reflux Disease (GERD) 2007.
Цільова популяція пацієнтів: дорослі.
Мета підготовки настанови: для реалізації економічно та клінічно ефективної і заснованої на доказових даних стратегії діагностики і лікування хворих на гастроезофагеальну рефлюксну хворобу (ГЕРХ).
2. Ключові моменти
Діагностика
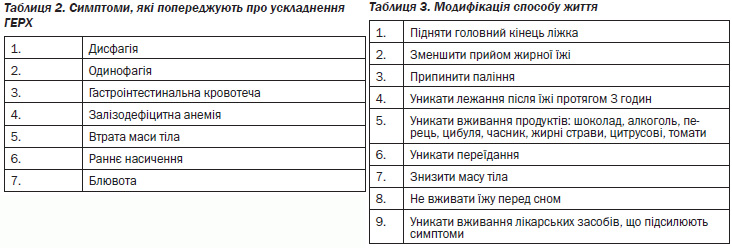
Анамнез. Ретельно зібраний анамнез має важливе значення у встановленні діагнозу ГЕРХ. Якщо класичні симптоми ГЕРХ (печія та відрижка кислим) чітко домінують в анамнезі пацієнта, вони можуть допомогти встановити діагноз ГЕРХ з досить високою специфічністю, хоча чутливість клінічних симптомів залишається низькою порівняно з 24-годинним рН-моніторингом. Наявність атипових симптомів, які нерідко зустрічаються (табл. 1), може ускладнювати встановлення клінічного діагнозу ГЕРХ [B*].
Обстеження. Не існує золотого стандарту для діагностики ГЕРХ [А*]. Хоча дослідження рН приймається в якості стандарту з чутливістю 85 % і специфічністю 95 %, помилкові позитивні та помилкові негативні результати все ще існують [B*]. Ендоскопічному дослідженню не вистачає чутливості при визначенні патологічного рефлюксу. Рентгенологічне дослідження з барієм має обмежене значення в діагностиці ГЕРХ і не рекомендується [B*].
Терапевтичне обстеження. Емпірична кислотосупресивна терапія може ідентифікувати пацієнтів з ГЕРХ, які не мають симптомів ризику [А*], і може бути корисною в оцінці пацієнтів з атиповими проявами ГЕРХ, зокрема некардіальним болем у грудях [B*].
Лікування
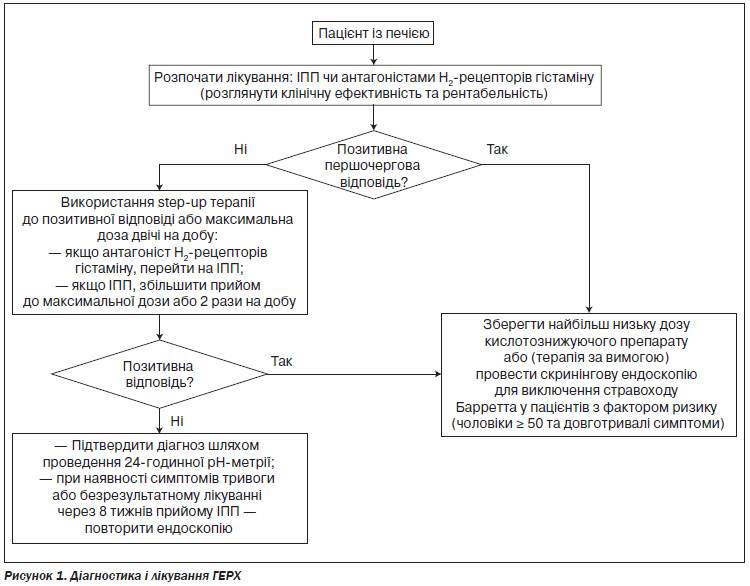
Модифікація способу життя. Модифікація способу життя (табл. 3) повинна бути рекомендована протягом всього лікування ГЕРХ, але достовірних даних для підтримки його ефективності мало [D*].
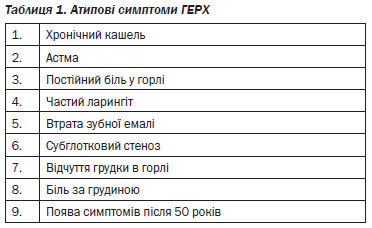
Фармакологічне лікування (табл. 4). Антагоністи Н2-рецепторів гістаміну (H2RAs), інгібітори протонної помпи (ІПП) і прокінетики довели свою ефективність в лікуванні ГЕРХ [А*]. У минулому прокінетики вважалися ефективними, як і антагоністи Н2-рецепторів гістаміну, але в даний час менше використовуються [А*]. Антациди є неефективними [А*], але можуть бути використані як додатковий кислотно-нейтралізуючий агент у деяких пацієнтів із ГЕРХ [D*].
— Неерозивна рефлюксна хвороба (НЕРХ): «Крок вгору» (step-up) терапія (якщо стан не покращиться, після антагоністів Н2-рецепторів гістаміну призначають ІПП) і «крок вниз» (step-down) терапія (послідовне зниження дози ІПП) однаково ефективні для лікування гострих випадків та як підтримуюча терапія [C*]. Витрати на step-down лікування — це в основному придбання ліків, у той час як step-up лікування вимагає більш частого проведення ендоскопії. Терапія за вимогою (patient directed) є найбільш економічно ефективною.
— Ерозивний езофагіт: Початкова терапія ІПП — це препарати вибору для лікування гострих езофагітів та підтримуюча терапія для пацієнтів з підтвердженим ерозивним езофагітом [А*].
— ІПП слід приймати за 30–60 хвилин до їжі для оптимізації ефективності [B*].
Хірургічне лікування. Антирефлюксна хірургія є альтернативою при лікуванні ГЕРХ у пацієнтів, які мають хронічну форму ГЕРХ зі стійкими симптомами [А*]. Хірургія має значні ускладнення (10–20 %).
Ендоскопічні методи. Деякі альтернативні ендоскопічні методи лікування менш інвазивні і характеризуються меншими ускладненнями, але, ймовірно, мають більш низький відсоток позитивної відповіді порівняно з антирефлюксною хірургією [C*].
Довготривалі спостереження
Симптоми, що не змінюються. Якщо симптоми залишаються незмінними у пацієнтів з нормальними даними ендоскопії, повторювати ендоскопію не має потреби і не рекомендується [C*].
Тривожні ознаки. Пацієнтів з тривожними симптомами, що призводять до ускладнень ГЕРХ (табл. 2), слід відправити до спеціаліста — гастроентеролога, хірурга.
Ризик ускладнень. Подальші діагностичні дослідження (наприклад, езофагогастродуоденоскопія, рН-моніторинг) повинні проводитись пацієнтам, які не реагують на кислотосупресивну терапію [C*], а також пацієнтам з анамнезом хронічної ГЕРХ, у яких є ризик розвитку ускладнень (наприклад, стравоходу Барретта, стриктури, аденокарциноми). Хронічний рефлюкс може відіграти важливу роль в розвитку стравоходу Барретта, однак ще невідомо, чи можуть бути поліпшені результати при наявності спостереження та медикаментозного лікування [D*]. Витрати, пов’язані зі спостереженням хворого із стравоходом Барретта без дисплазії, ймовірно, будуть занадто великі [B*]. Було показано, що антирефлюксна терапія знизить необхідність повторної дилатації стравоходу в зв’язку з формуванням стриктури [А*].
*Рівні достовірності відображають найбільш доступну літературу на підтримку інвазивних тестів:
А = рандомізовані контрольовані клінічні випробування;
В = нерандомізовані контрольовані клінічні випробування;
C = обсерваційні клінічні випробування;
D = думка експертів.
Коментар робочої групи
Станом на 01.07.2013 р. в Україні лікарські засоби циметидин, лізатидин не зареєстровані.
3. Клінічна проблема
Захворюваність
Гастроезофагеальна рефлюксна хвороба (ГЕРХ) — хронічне рецидивуюче захворювання, що зумовлює ризик спричинення більш тяжких захворювань та смертності від потенційних ускладнень. Хоча багато пацієнтів самостійно діагностують, лікують і не звертаються за медичною допомогою зі своїми симптомами, інші страждають внаслідок найбільш важких форм хвороби — від ерозивного до виразкового езофагіту.
Понад 60 мільйонів дорослих американців страждають від печії принаймні раз на місяць, і більше 25 мільйонів печія турбує щодня. Національна служба амбулаторної медичної допомоги (NAMCS) виявила, що понад 38 мільйонів щорічних амбулаторних відвідувань дорослими були пов’язані з ГЕРХ. Серед пацієнтів, які мають симптоми ГЕРХ, 40–60 % і більше мають рефлюкс-езофагіт. У 10 % цих пацієнтів після обстеження діагностують ерозивний езофагіт. ГЕРХ стає більш поширеною у вагітних жінок, більше ускладнень розвивається в літніх людей. У пацієнтів із ГЕРХ у цілому спостерігається зниження продуктивності праці, якості життя й загального самопочуття. У багатьох пацієнтів рівень якості життя виявляється нижчим, ніж, наприклад, у пацієнтів зі стенокардією та хронічною серцевою недостатністю. ГЕРХ є фактором ризику розвитку аденокарциноми, що збільшує важливість її діагностики та лікування.
Позастравохідні прояви, пов’язані з ГЕРХ, спостерігаються в 50 % пацієнтів з некардіальним болем у грудях, у 78 % пацієнтів з хронічною охриплістю і в 82 % пацієнтів з астмою. Понад 50 % пацієнтів із ГЕРХ не мають ендоскопічних ознак захворювання. Хоча труднощі в діагностиці зустрічаються рідше, коли пацієнти мають класичні симптоми печії та кислотного рефлюксу, встановити діагноз може бути важко у пацієнтів із відсутністю відповіді на терапію ІПП і позастравохідними проявами цього захворювання.
Коментар робочої групи
Відповідно до класифікації ВООЗ, ГЕРХ — це хронічне рецидивуюче захворювання, зумовлене порушенням моторно-евакуаторної функції гастроезофагеальної зони, що характеризується спонтанними або регулярно повторюваними закидами у стравохід шлункового або дуоденального вмісту, що призводить до ушкодження дистального відділу стравоходу з розвитком у ньому ерозивно-виразкових, катаральних і/або функціональних порушень.
На час підготовки цієї настанови в Україні проводилися лише поодинокі епідеміологічні дослідження, в яких доведено, що в організованій популяції дорослих людей на підставі скарг поширеність типового варіанта ГЕРХ становить 30,0 %: 25,1 % — у чоловіків, 39,1 % — у жінок. Типові скарги (на печію, кисле зригування) щоденно мають 3,3 %, раз на тиждень — 17,3 %, раз на місяць — 9,4 % населення загальної популяції. У той же час відзначена чітка тенденція до збільшення захворюваності на ГЕРХ в Україні.
Проблеми діагностики
Відсутність золотого стандарту в діагностиці ГЕРХ становить клінічну проблему в лікуванні пацієнтів з рефлюкс-симптоматикою. Багато синдромів, у тому числі атипова ГЕРХ, H.рylori-асоційований гастрит, гастродуоденальна виразка і рак шлунка можуть бути аналогічними ГЕРХ, тому ретельний збір анамнезу є важливим. Навіть у цих випадках попередні випробування чутливості та специфічності для точної діагностики залишаються на низькому рівні. Інвазивні методи діагностики дуже часто використовуються і не завжди економічно ефективні, враховуючи невеликий ризик встановлення помилкового діагнозу при добре зібраному анамнезі в пацієнта. Емпірична фармакотерапія є економічно вигідною, що базується як на вартості лікування, так і на зручності для пацієнта.
Вирішення проблем лікування
Хоча зазвичай відбувається полегшення симптомів на фоні емпіричного лікування, наслідки довгострокового застосування антирефлюксних препаратів досі невідомі. Ускладнення ГЕРХ (наприклад, стравохід Барретта, аденокарцинома) рідкісні, але існують; у 10–15 % хворих з ГЕРХ буде розвиватися стравохід Барретта, і у 5–10 % з цих хворих за 10–20 років буде розвиватися аденокарцинома. Ще невідомо, чи може хронічний рефлюкс імовірно відігравати важливу роль у розвитку стравоходу Барретта (спеціалізований циліндричний епітелій/кишкова метаплазія), якщо стан може бути поліпшений шляхом спостереження та лікування. Було показано, що антирефлюксна терапія знижує потребу в періодичній дилатації стравоходу при формуванні стриктури.
Попередні моделі вивчення економічної ефективності лікування мали недоліки в тому, що певні дослідження розглядали тільки хворих з ерозивним езофагітом і не включали хворих із неерозивним езофагітом (НЕРХ), в той час як деякі інші дослідження включали тільки дані про антирефлюксне хірургічне лікування пацієнтів, яким не допомагала медикаментозна терапія. Ці дослідження мали короткостроковий аналіз терапевтичної ефективності, а також не передбачали переходу з одних ліків на інші.
4. Обґрунтування рекомендацій
Етіологія
Більшість пацієнтів із ГЕРХ мають нормальний тонус нижнього стравохідного сфінктера. Найбільш поширеним механізмом виникнення кислотного рефлюксу є епізоди релаксації нижнього стравохідного сфінктера (> 90 % випадків рефлюксу у здорових і > 75 % випадків у пацієнтів із симптоматичною ГЕРХ). Інші механізми включають порушення тонусу нижнього стравохідного сфінктера через збільшення внутрішньочеревного тиску. Інші фактори включають розлади моторики шлунка та дванадцятипалої кишки, вживання лікарських препаратів (зокрема, блокаторів кальцієвих каналів), наявність грижі стравохідного отвору діафрагми, зниження стравохідного кліренсу (порушення моторики стравоходу, склеродермія, зниження слиновиділення).
Анамнез захворювання
Більшість пацієнтів з ГЕРХ не звертаються за медичною допомогою (80–90 %) та займаються самолікуванням (50 %). Лікарі у більшості пацієнтів відмічають хронічні симптоми, які залежать від лікування. Пацієнти з більш важкими формами езофагіту мають симптоми, що повторюються більш часто, майже завжди мають періодичні симптоми езофагіту та знаходяться під наглядом протягом ≥ 1 року. Прогресування хвороби спостерігається приблизно у 25 % пацієнтів з езофагітом, але це менш ймовірно, якщо езофагіт відсутній або менш виражений (Лос-Анджелеська класифікація — ступінь A, B). Такі ускладнення, як стравохід Барретта, виразки, стриктури або аденокарцинома стравоходу, зустрічаються дуже рідко. Симптоми ГЕРХ і нормальні ендоскопічні дані дають позитивний клінічний прогноз.
Діагностика
При спробі оцінити діагностичні критерії ГЕРХ існують науково обґрунтовані обмеження. Більшість досліджень методологічно недосконалі, оскільки не існує золотих стандартів діагностики ГЕРХ. Останні дослідження показують, що поєднання кількох діагностичних методів (омепразоловий тест, рН-моніторинг та ендоскопія) може збільшити чутливість діагностики ГЕРХ (наближається до 100 %), але цей підхід не є рутинним у клінічній практиці.
Анамнез. Добре зібраний анамнез має важливе значення у встановленні діагнозу ГЕРХ. Було показано, що правильно визначити ГЕРХ з чутливістю 89 % та специфічністю 94 % дають можливість класичні симптоми печії в загрудинній ділянці з кислим або гірким присмаком та відрижка кислим. Тим не менш частота, тривалість і тяжкість симптомів однаково виявляються серед пацієнтів із різними ступенями езофагіту і стравоходом Барретта і не можуть надійно діагностувати ускладнення ГЕРХ.
Діагностичний тест з ІПП. Позитивна відповідь на короткий курс лікування інгібіторами протонної помпи (ІПП) зазвичай вважається підтвердженням діагнозу ГЕРХ. ІПП були достатньо вивчені та застосовуються частіше з урахуванням їх більш високої ефективності, ніж антагоністи Н2-рецепторів гістаміну. Нещодавно проведений метааналіз показав, що дослідження успішної короткострокової терапії ІПП з використанням 24-годинного рН-моніторингу як еталонного стандарту не дають впевненості у встановленні діагнозу ГЕРХ (чутливість 78 %, специфічність 54 %). Це може бути пов’язано з попереднім використанням ІПП при лікуванні інших кислотозалежних станів (диспепсія), у частини пацієнтів — з підвищеною чутливістю стравоходу до кислоти (без істинної ГЕРХ) або навіть у зв’язку з плацебо-ефектом. У дослідженнях у хворих з некардіальним болем у грудях застосовувались більші дози омепразолу (40 мг вранці, 20 мг ввечері) та спостерігалась чутливість 78 % і специфічність 85 %. Стандартні дози можуть мати низьку чутливість і специфічність.
Емпіричні/терапевтичні дослідження. Дані діагностичних досліджень не можуть надійно виключити ГЕРХ, навіть якщо вони негативні. Тому емпірична терапія може бути швидким способом діагностики ГЕРХ у пацієнтів із класичними симптомами, а також з симптомами, які вказують на ускладнення (наприклад, рак, стриктури). (Див. також обговорення «крок вгору» терапії і «крок вниз» терапії в розділі 5. Лікування ГЕРХ).
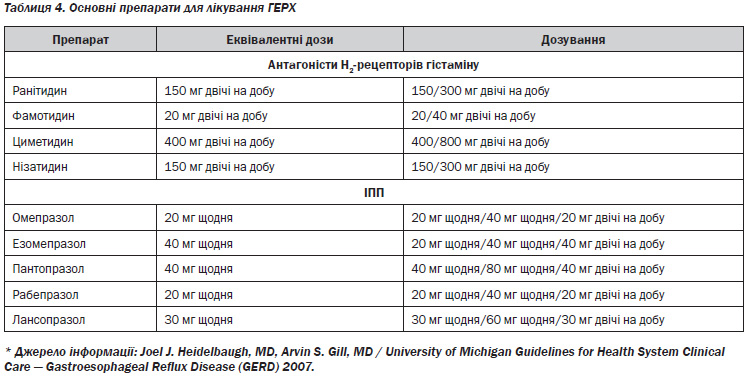
Емпірична терапія повинна бути здійснена протягом двох тижнів у пацієнтів із типовими симптомами ГЕРХ. Лікування може бути розпочате в стандартному дозуванні або антагоністами Н2-рецепторів гістаміну (за вимогою), або ІПП (за 30–60 хвилин до першого прийому їжі один раз на добу), вибір препарату залежить від клінічної картини і відповідної економічної ефективності та повного зникнення симптомів (див. рис. 1, табл. 4). Якщо симптоми не зникають на фоні початкового використання антагоністів Н2-рецепторів гістаміну, то повинні бути використані ІПП. Якщо на початку лікування використовувалися ІПП, а симптоми не зменшуються, необхідно збільшити ІПП до максимальної дози щодня (за 30–60 хвилин перед першим і останнім прийомами їжі).
Для тих пацієнтів, у яких з самого початку були більш важкі й більш часті прояви симптомів ГЕРХ, лікування може бути розпочате з найбільш високих та більш частих доз антагоністів Н2-рецепторів гістаміну або ІПП. Якщо полегшення симптомів не відбувається з початкової дози, то необхідно підвищити дозу/частоту до отримання повного зникнення симптомів: з високих доз антагоністів Н2-рецепторів гістаміну до ІПП щоденно, з ІПП щоденно до ІПП у максимальних дозах або ІПП двічі на добу. Якщо немає відповіді на лікування при використанні більш високих доз, то повинні бути виконані діагностичні дослідження. Якщо пацієнт з езофагітом без інструментальної діагностики добре відповідає на терапію, то її призначають на 8–12 тижнів. Якщо в пацієнта спостерігається повне зникнення симптомів протягом 8–12 тижнів лікування, то зниження дози препарату проводять протягом 1 місяця до мінімальної ефективної дози. Якщо симптоми повторюються, то залежно від клінічної картини пацієнта повертають на початкову ефективну лікувальну дозу та проводять подальшу діагностику.
Очікування позитивної відповіді на емпіричну терапію в пацієнтів, які мають атипові або позастравохідні прояви ГЕРХ, займає більше часу. Якщо в таких пацієнтів немає покращень симптомів після одного місяця лікування, необхідно продовжити діагностичні обстеження.
Ендоскопія. Ендоскопія є основним методом оцінки стану слизової оболонки і виявлення стриктури стравоходу, а також стравоходу Барретта з чутливістю 50 % і специфічністю 95 %. Ендоскопічні докази наявності езофагіту виявляють не менш ніж у 50 % хворих, які мають симптом печії більше ніж два рази на тиждень протягом шести місяців.
Езофагіт найкраще можна визначити за Лос-Анджелеською системою класифікації (LA classification system), яка визначає ступінь тяжкості пошкодження слизової оболонки від А до D (ерозії або виразки), з яких ступінь D є найбільш серйозним. А саме:
Ступінь А — один або більше дефектів слизової оболонки, обмежених складками слизової, довжина яких не перевищує 5 мм.
Ступінь В — один або більше дефектів слизової оболонки, обмежених складками слизової, довжина яких перевищує 5 мм.
Ступінь С — один або більше дефектів слизової оболонки, розміщених на складках і між ними (можуть зливатися між собою), але ураження займає менш ніж 75 % периметра стравоходу.
Ступінь D — пошкодження слизової оболонки займає більш ніж 75 % периметра стравоходу.
(Dent J. et al. An evidence-based appraisal of reflux disease management — the Genval Workshop Report // Gut 1999; 44(2S): 1S-16S).
В ендоскопічній практиці «малі зміни» слизової стравоходу, а саме еритема, набряк, ранимість, не є надійними ознаками езофагіту через суб’єктивність оцінки.
Коментар робочої групи
В ендоскопічній практиці діагноз рефлюкс-езофагіту встановлюють при наявності дефектів слизової оболонки, «малі зміни» — еритема, набряк, ранимість, згідно з Генвальським консенсусом (1999 р.), не є надійними ознаками через суб’єктивність оцінки; з певними застереженнями таких хворих зараховують до групи ендоскопічно-негативної рефлюксної хвороби. В теперішній час для опису змін при рефлюкс-езофагіті найбільш уживаною є Лос-Анджелеська класифікація (1996 р.), яка дає змогу максимально об’єктивізувати і стандартизувати опис. Згідно з нею пошкодженням (дефектом — mucosal break) слизової оболонки стравоходу вважаються не лише виразки й ерозії, а й ділянки еритеми з чіткою демаркацією від нормальної слизової оболонки стравоходу.
Пошкодження слизової оболонки, пов’язані з ГЕРХ, завжди починаються від SCJ (Z-лінії) та поширюються догори, якщо немає уражень по лінії стику — слід думати про можливі інші причини езофагіту. Ступені А і В за LA трактують як «сприятливий» варіант, оборотні при лікуванні ІПП зміни. Ступені C і D — важкий перебіг, що потребує тривалого лікування і підтримуючої терапії після загоєння.
Сучасна відеоендоскопія зі збільшенням і цифровими технологіями (NBI, FICE) дає змогу виявляти рефлюкс-езофагіт з мінімальними ендоскопічними проявами (minimal change oesophagitis) — відсутністю візуалізації палісадних судин за рахунок потовщення епітелію слизової стравоходу, потовщенням епітелію безпосередньо біля Z-лінії.
Ендоскопію слід проводити в тих пацієнтів, які мають тривожні симптоми (див. табл. 2) і у яких є підозра на ускладнення ГЕРХ. Подальші діагностичні дослідження повинні бути виконані й у пацієнтів, які не відповідають на терапію, мають довготривалий перебіг хвороби і фактори ризику розвитку стравоходу Барретта.
Повторювати ендоскопію при позитивних результатах лікування, швидше за все, не варто. Спостереження протягом 10 років за пацієнтами з початково нормальною ендоскопією не виявило прогресування до тяжких форм езофагіту. Однак у деяких пацієнтів спостерігалось прогресування езофагіту до А ступеня.
Коментар робочої групи
Для виявлення стравоходу Барретта доцільно виконувати хромоендоскопію.
Хромоендоскопія передбачає використання хімічних барвників для ідентифікації специфічних субтипів епітелію або виділення поверхневих характеристик епітелію. Також при стравоході Барретта хромоендоскопію виконують для визначення ділянок, з яких слід взяти біопсію. Це підвищує точність виявлення кишкової метаплазії і дисплазії. Чутливість і специфічність біопсії з попереднім забарвленням розчином Люголя, оцтовою кислотою чи індигокарміном перевищує 95 і 97 % відповідно. Така прицільна біопсія може поліпшувати діагностику короткого сегмента кишкової метаплазії в дистальному відділі стравоходу. Застосування даного діагностичного методу можливе в усіх закладах охорони здоров’я України.
РH-діагностика. Багато пацієнтів не мають доказів езофагіту при ендоскопії, хоча вони позитивно реагують на кислотосупресивну терапію. Пацієнтам з ендоскопічно негативною ГЕРХ, а також тим, які не відповідають на кислотосупресивну терапію, краще проводити амбулаторний рН-моніторинг. В цілому у пацієнтів з ендоскопічно негативною ГЕРХ вплив кислоти на слизову менший, ніж у хворих з езофагітом. Тим не менше, нормальний рівень кислоти в стравоході був виявлений приблизно у 29 % пацієнтів із рефлюкс-езофагітом і в 33 % пацієнтів з ендоскопічно негативною ГЕРХ.
Амбулаторний 24-годинний рН-моніторинг заснований на кількісній оцінці внутрішньостравохідного рН. З метою поліпшення діагностичного результату пацієнтам рекомендовано дотримуватись свого звичайного способу життя і звести до мінімуму дієтичні обмеження.
Останні досягнення в області «бездротового» рН-моніторингу — це радіотелеметрична капсульна технологія, яка усуває необхідність у використанні незручних назоезофагеальних трубок, підвищує діагностичний результат і дозволяє довше проводити моніторинг (наприклад, в даний час — 48-годинний, а незабаром — 96-годинний). Крім того, внутрішньостравохідний імпеданс-моніторинг може виявити «безкислотний» (тобто рідина/газ) рефлюкс, що може бути важливим у медикаментозно резистентних хворих із регургітацією, які знаходяться на етапі розгляду для хірургічного лікування, або у пацієнтів з нетиповими симптомами.
Мета рН-зондування повинна бути визначена до його проведення, а саме для діагностики ГЕРХ або для визначення адекватності терапії. Дослідження має проводитись без застосування ліків, якщо діагноз знаходиться під питанням. Основним показанням до виконання 24-добового рН-моніторування є перевірка невдач лікування, або проведення антирефлюксної хірургії, або призначення за медичними показаннями.
Коментар робочої групи
На момент підготовки даної адаптованої клінічної настанови рН-моніторинг за допомогою радіотелеметричних капсульних технологій в Україні не застосовується.
Інші діагностичні дослідження. Інші діагностичні дослідження включають манометрію, тест Бернштейна та гастроезофагеальну сцинтиграфію. Внаслідок численних обмежень ці тести не повинні регулярно використовуватись. Барій не може використовуватися в оцінці ГЕРХ, хоча він використовувався в минулому. Він корисний в оцінці дисфагії, але обмежений у своїх можливостях як скринінг-тест для діагностики ГЕРХ, як і всі вищезгадані дослідження.
5. Лікування ГЕРХ
Модифікація способу життя. Протягом терапії ГЕРХ пропонуються різні модифікації способу життя (див. табл. 3). Ні ефективність, ні потенційні негативні наслідки змін способу життя на якість життя пацієнтів не були належним чином досліджені при будь-якій зміні. Доцільно пояснювати пацієнтам фактори, що можуть викликати рефлюкс.
Підняття головного кінця ліжка. Численні дослідження показали, що висота головного кінця ліжка пацієнта повинна бути від 4 до 8 дюймів (10–20 см), а також необхідно уникати положення лежачи протягом 3 годин або більше після вживання великої кількості їжі або жирної їжі. Ці рекомендації можуть зменшувати кислотний рефлюкс у дистальному відділі стравоходу. Однак дані, що відображають справжню ефективність цього способу у пацієнтів з ГЕРХ, практично повністю відсутні. Також вважається, що пацієнти повинні уникати сну на додаткових подушках, оскільки це може збільшити внутрішньочеревний тиск і призвести до посилення рефлюксу.
Уникайте вживання певних продуктів. Деякі продукти, як вважається, мають пряму подразнюючу дію стосовно стравоходу: соки цитрусових, газовані напої, кава і кофеїн, шоколад, гостра їжа, жирні продукти харчування, вживання їжі пізно ввечері. Однак рандомізованих контрольованих досліджень з цього приводу не проводилось. Тому індивідуальні дієтичні рекомендації можуть мати місце в кожному конкретному випадку.
Втрата ваги. Зв’язок між вагою, рефлюксом і його ускладненнями був доведений. Було показано, що втрата ваги призводила до поліпшення симптомів, особливо якщо надлишкова вага мала місце до початку розвитку симптомів ГЕРХ.
Припинення паління і вживання алкоголю. Припинення паління та уникнення або мінімізація вживання алкоголю також пропонується для покращення стану здоров’я. Було досліджено, що нікотин і алкоголь знижують тиск нижнього стравохідного сфінктера і призводять до подальшого подразнення стравоходу.
Уникайте вживання ліків, що знижують тонус нижнього стравохідного сфінктера. Слід уникати вживання ліків, які знижують тиск нижнього стравохідного сфінктера в пацієнтів із симптомами ГЕРХ. До таких ліків належать блокатори кальцієвих каналів, бета-агоністи, агоністи альфа-адренергічних рецепторів, теофілін, нітрати та деякі седативні засоби.
Уникайте тісного одягу навколо талії. Існує припущення, що пацієнти повинні утримуватися від носіння вузького одягу навколо талії, щоб мінімізувати виникнення рефлюксу.
Безрецептурні ліки. Антациди та безрецептурні кислотосупресанти показані в якості ініціальної терапії ГЕРХ. Антациди (Tums, Rolaids, Maalox) та комбіновані антациди/альгінати (Gaviscon) продемонстрували більшу ефективність порівняно з плацебо в зменшенні щоденних симптомів ГЕРХ. У 2 довготривалих клінічних дослідженнях у 20 % пацієнтів спостерігалось полегшення симптомів під впливом лікування антацидами.
Усі форми блокаторів гістамінових рецепторів 2-го типу (циметидин, ранітидин, фамотидин, нізатидин) в стандартних дозах дозволені (допущені) до застосування в США. У вказаних дозах антагоністи Н2-рецепторів гістаміну знижують продукцію соляної кислоти, особливо в постпрандіальний період, не впливаючи на дисфункцію стравохідно-шлункового бар’єра. Всі ці препарати вірогідно взаємозамінні (однаково ефективні) в стандартних дозах щодо швидкості настання кислотосупресії й тривалості їх впливу на шлункову секрецію. Економічні витрати при застосуванні оригінальних антагоністів Н2-рецепторів гістаміну однакові (хоча при застосуванні генеричних препаратів такі витрати відрізняються). Деякі пацієнти можуть передчувати, коли у них можуть з’явитись симптоми рефлюксу, і профілактичне застосування антагоністів Н2-рецепторів гістаміну може виявити позитивний ефект. Вважається, що ефективність антагоністів Н2-рецепторів гістаміну вища порівняно з антацидами, альгінатами та плацебо.
Коментар робочої групи
— Tums, Rolaids, Maalox, Gaviscon — торгові назви лікарських засобів;
— станом на 01.07.2013 р. лікарські засоби циметидин, нізатидин не зареєстровані в Україні.
Антагоністи Н2-рецепторів гістаміну (H2RAs). У численних рандомізованих контрольованих дослідженнях було показано, що стандартні дози антагоністів Н2-рецепторів гістаміну за ефективністю перевищують плацебо стосовно полегшення печії у хворих з ГЕРХ у 60 % випадків. Систематичний огляд досліджень показав, що частота загоєння езофагіту в пацієнтів, які приймали антагоністи Н2-рецепторів гістаміну, вища порівняно з пацієнтами групи плацебо. Загоєння езофагіту протягом 4–8 тижнів лікування спостерігалось у 50 % пацієнтів, яких лікували антагоністами Н2-рецепторів гістаміну, і у 24 % пацієнтів, які вживали плацебо.
Застосування високих доз і більш частий режим прийому антагоністів Н2-рецепторів гістаміну виявилися ефективнішим при лікуванні симптомів рефлюксу і загоєнні езофагіту. У випадку призначення максимального дозування недоліком такої терапії може бути висока вартість, яка рівноцінна або перевищує вартість лікування ІПП, та погіршення комплаєнтності пацієнта.
Немає рандомізованих, контрольованих досліджень, в яких оцінювався б перебіг неповністю пролікованої ГЕРХ, так само немає чітких даних щодо природного перебігу хронічного нелікованого езофагіту. Недостатньо інформації щодо досягнення рівня кислотної супресії, яка необхідна для забезпечення повного загоєння езофагіту.
У пацієнтів, імовірно, розвивається певна толерантність до антагоністів Н2-рецепторів гістаміну з помірним зниженням ефективності такого лікування після 30 днів терапії.
У короткотривалих рандомізованих плацебо-контрольованих дослідженнях частота небажаних побічних явищ у пацієнтів, які приймали антагоністи Н2-рецепторів гістаміну, була схожою з групою плацебо. Більш наочно небажані побічні ефекти описані при проведенні неконтрольованих досліджень та у випробуваннях «випадок-контроль». При застосуванні антагоністів Н2-рецепторів гістаміну зрідка спостерігалась цитопенія, гінекомастія, порушення печінкових ферментів та реакції гіперчутливості. Довгострокових контрольованих досліджень з віддаленою оцінкою безпечності тривалого застосування антагоністів Н2-рецепторів гістаміну не проводилось.
Інгібітори протонної помпи (ІПП). Численні докази, отримані при проведенні значної кількості рандомізованих контрольованих досліджень, свідчать про більшу ефективність ІПП порівняно з антагоністами Н2-рецепторів гістаміну і плацебо стосовно контролю симптомів ерозивного рефлюкс-езофагіту (83, 60 та 27 % відповідно) при проведенні 4–8-тижневого лікувального періоду. В одному систематичному огляді було порівняно ефективність ІПП і антагоністів Н2-рецепторів гістаміну і встановлено, що більша частина пацієнтів відмічала симптоматичне полегшення при застосуванні ІПП, в той час як достовірної різниці між групами щодо досягнення ремісії печії встановлено не було. Одне з рандомізованих контрольованих досліджень показало, що через 12 місяців після застосування омепразолу достовірно більше осіб залишались в ремісії порівняно з пацієнтами, які приймали ранітидин. Інше рандомізоване клінічне дослідження виявило, що застосування омепразолу більш вірогідно полегшувало симптоми хвороби та рівень психологічного самопочуття (благополуччя).
Швидкість загоєння ерозивного езофагіту при лікуванні ІПП вища порівняно з антагоністами Н2-рецепторів гістаміну й плацебо (78, 50 і 24 % відповідно) при 4–8-тижневому лікуванні. Рандомізовані клінічні дослідження з більш тривалим курсом лікування не проводились.
Одне рандомізоване клінічне дослідження не виявило достовірних відмінностей у швидкості загоєння ерозивного езофагіту між різними ІПП, включаючи омепразол, ланзопразол, рабепразол і пантопразол. Ефективність щодо змін рН в цьому дослідженні не вивчалась. Омепразол, зокрема його генеричні форми, та рецептурні кислотосупресанти є найдешевшою формою лікування.
Одне дослідження показало, що езомепразол, S-ізомер омепразолу, в дозі 20 мг і 40 мг більш ефективний, ніж омепразол 20 мг, у припиненні симптоматики у хворих з ГЕРХ і швидкості загоєння езофагіту з подібним профілем переносимості.
Недавні рандомізовані клінічні дослідження порівнювали езомепразол 40 мг і ланзопразол 30 мг. Езомепразол виявив кращий ефект в полегшенні симптомів та загоєнні езофагіту, з особливо очевидною перевагою в лікуванні важких стадій езофагіту.
Потенційна перевага тривалої терапії ІПП у пацієнтів із хронічною чи ускладненою формою ГЕРХ у цілому переважає теоретичні ризики виникнення побічних явищ. Хоча було встановлено зниження абсорбції ціанокобаламіну, клінічно значимого зниження рівня вітаміну В12 сироватки крові, як правило, не спостерігалось. ІПП спричиняють значне зниження секреції соляної кислоти в шлунку, що призводить до підвищення продукції гастрину G-клітинами слизової антрального відділу шлунка. Жодного випадку раку шлунка чи карциноїду, пов’язаних з використанням ІПП, не було зареєстровано протягом 20 років застосування препаратів цього класу. Із використанням ІПП пов’язують нечасті випадки виникнення запалень легенів, псевдомембранозного коліту, перелому шийки стегна.
Декілька досліджень показали, що терапія «на вимогу» із застосуванням ІПП є найбільш оптимальним способом ведення хворих з НЕРХ з економічної і клінічної точки зору.
Хірургічне лікування. Антирефлюксне хірургічне втручання є загальноприйнятим альтернативним методом лікування хворих з ГЕРХ із симптоматичним кислим чи біліарним рефлюксом. Основні завдання хірургічного лікування спрямовані на зменшення кісти стравохідного отвору діафрагми, відновлення діафрагмального отвору, зміцнення антирефлюксного бар’єра методами фундоплікацій. Операції виконуються як відкритим, так і лапароскопічним методом. Контрольовані дослідження з порівнянням відкритого і лапароскопічного методів лікування продемонстрували схожість обох методів щодо ефективності та виникнення післяопераційних ускладнень, а також більш низький рівень смертності та коротший період перебування в стаціонарі при застосуванні лапароскопії.
Післяопераційні ускладнення, які виникали у пацієнтів, зазвичай були короткотерміновими і легко усувались. Короткотривала дисфагія твердою їжею спостерігалась в 10 % випадків, 2–3 % страждали від перманентих симптомів дисфагії, здуття живота виникало у 7–10 % пацієнтів. Діарея, нудота, раннє насичення виникали з меншою частотою (рідше). Деякі ускладнення виникали з частотою до 20 %, в той час як більшість спостерігалась значно рідше: у 3–4 % випадків. Рівень задоволення операцією був високий, якщо після оперативного втручання вдавалося ефективно контролювати симптоми ГЕРХ.
Контрольовані дослідження з метою порівняння ефективності антирефлюксної хірургії з застосуванням антацидів, антагоністів Н2-рецепторів гістаміну та ІПП продемонстрували незначну перевагу хірургічних методів. Недавні порівняльні дослідження хірургічного лікування з ІПП показали однакову ефективність обох методів. Дослідження з довготривалим післялікувальним спостереженням показали, що 52 % хворих повернулись до медикаментозного лікування через 3–5 років після виконання операції, що, можливо, пов’язано з поганим відбором пацієнтів для оперативного втручання та хірургічними помилками.
Відбір хворих для визначення методу хірургічного втручання повинен бути строго індивідуалізованим. У пацієнтів необхідно підтвердити (задокументувати) кислотний рефлюкс чи неспроможність (дефективність) антирефлюксного бар’єра, виключити сповільнення евакуації шлункового вмісту, порушення стравохідної моторики, а також підтвердити недостатню ефективність лікування ІПП. Хірургічні методи лікування більш ефективні в подоланні печії та регургітації (75–90 %), ніж у припиненні позастравохідних симптомів (50–75 %).
Нові ендоскопічні методи. Радіочастотна терапія стравохідно-шлункового з’єднання (Стретта), ендоскопічна гастропластика (за Бардом, Уїлсом, Куком), імплантація полімерів в стравохідно-шлунковий перехід демонструють поліпшення симптомів і підвищення рівня якості життя в «хибних» контрольованих дослідженнях. Жодна з цих методик не досягає стійкого пониження впливу кислоти на стравохід. Полімерні ін’єкції на даний час вилучені з переліку методів лікування з міркувань безпеки. Недостатня тривалість позитивної відповіді на нові методики лікування (30–50 % протягом 3 років) може обмежити довгострокову перспективу їх застосування. Ускладнення зустрічаються значно рідше, ніж при лікуванні хірургічними методами.
6. Неефективність лікування
Для пацієнтів з типовими симптомами рефлюксу очікуваний час відповіді на лікування повинен становити 2–4 тижні. Пацієнти з атиповими рефлюксними симптомами теж відповідають на лікування протягом місяця. Пацієнти з атиповими симптомами можуть потребувати вищих доз ІПП для досягнення відповіді на терапію. Емпіричне лікування атипових симптомів показано у випадку, коли хворі скаржаться також на типові симптоми рефлюксу. Найкращим ініціальним підходом для пацієнтів з атиповими симптомами є проведення внутрішньостравохідного рН-моніторингу в період без призначення антирефлюксних препаратів, оскільки тільки близько 30 % пацієнтів мають атипові ГЕРХ-асоційовані рефлюксні симптоми. Пацієнти, які не відповідають на терапію протягом 1–3 місяців, вірогідно не страждають на ГЕРХ. Таким пацієнтам показано подальше обстеження для виявлення істинної причини виникнення симптомів.
Коментар робочої групи
З власного досвіду клініцистів — членів робочої групи відомо, що пацієнти, які не відповідають на кислотосупресивну терапію, можуть мати біліарний рефлюкс, що вимагає призначення додаткових діагностичних заходів та адекватного лікування.
7. Підтримуюча терапія
Метою підтримуючої терапії є стабільна відсутність симптоматики у пацієнтів без ендоскопічних ознак езофагіту. Для досягнення вказаної мети застосовуються різноманітні режими терапії. Підвищення важкості езофагіту потребує посиленої антисекреторної терапії (наприклад, довготривалої підтримуючої терапії ІПП). Оскільки більшості пацієнтів з ГЕРХ не проводиться ЕГДС, їм призначається тривала кислотосупресивна терапія. Варіанти такої терапії включають наступні режими: step-up терапія (починати лікування з менш сильного препарату і, при необхідності, рухатись далі до досягнення відповіді на лікування), step-down терапія (починати ініціальну терапію з сильного кислотосупресанта з подальшим зниженням дози або переходом на слабший препарат, здатний контролювати симптоми), терапія за вимогою (on demand) та хірургічне лікування. Кінцевою метою кожного варіанта лікування є повний контроль над симптомами захворювання.
Step-up терапія. Розпочинаючи терапію (step-up/крок вгору), достатньо 2 тижнів лікування для оцінки його ефективності. Якщо пацієнт не відповідає на лікування антагоністами Н2-рецепторів гістаміну протягом 2 тижнів, слід призначати ІПП, рекомендуючи режим прийому за 30 хвилин до їжі, для того щоб ІПП мали час для взаємодії з активованими протонними помпами парієтальних клітин. Якщо хворий не відповідає на такий режим лікування, ефективним може бути прийом подвійних доз ІПП за 30 хв перед сніданком і за 30 хв перед вечерею. Якщо і такий курс виявиться неефективним, симптоми захворювання вірогідно не пов’язані з кислотним рефлюксом. В такому випадку показано виконання додаткових діагностичних тестів. Не менше 40 % пацієнтів, яким призначається терапія ІПП, потребують підвищення дози препарату протягом проведення курсу лікування. При тривалому застосуванні спостерігається звикання до дії антагоністів Н2-рецепторів гістаміну. Основною метою лікування є застосування найменшої дози найменш сильного антисекреторного препарату, здатного досягнути повної стабільної відповіді на терапію. Особливо вночі може спостерігатись прорив симптомів, і в таких випадках пацієнт може застосовувати антациди і/або антагоністи Н2-рецепторів гістаміну. Такі рекомендації надаються тільки тим пацієнтам, у яких не досягається відповіді на ініціальну терапію, незважаючи на те, що рефлюкс є доведеною причиною їх симптомів. Це може бути невелика кількість пацієнтів. Антагоністи Н2-рецепторів гістаміну не слід призначати одночасно з ІПП.
Step-down терапія. Після того, як симптоми рефлюксу припинились на фоні step-up терапії і пацієнт пройшов курс 8-тижневої терапії ІПП з адекватним контролем симптомів, рекомендується перехід на антагоністи Н2-рецепторів гістаміну, а в подальшому, якщо пацієнт залишається безсимптомним на фоні прийому антагоністів Н2-рецепторів гістаміну, переходити на лікування антацидами в режимі «на вимогу» (оn demand). Переважна більшість пацієнтів, які приймали ІПП частіше однократної дози і добилися припинення симптомів, можуть в подальшому успішно переходити на зниження дози до однократного прийому без загрози повернення симптомів рефлюксу. Невелика частина пацієнтів з рефрактерною ГЕРХ потребуватиме довготривалої терапії високими дозами ІПП для контролю симптомів.
On demand терапія (терапія «на вимогу»). Лікування може розпочинатись із стандартної дози ІПП однократно або антагоністів Н2-рецепторів гістаміну двічі на день при потребі (самостійно призначене лікування при виникненні симптомів). Вибір медикаменту залежить від наявного асортименту ліків, оптимального співвідношення ціна/якість та результативності щодо полегшення симптомів.
8. Особливі обставини
Пацієнти старшого віку
У пацієнтів старше 50 років вперше встановлений діагноз ГЕРХ є тривожною ознакою, тому початковим діагностичним обстеженням повинна бути ендоскопія. Якщо рефлюкс все ще розглядається як основна причина захворювання після отримання негативного результату ендоскопії, доцільним буде емпіричне лікування.
Атипові симптоми ГЕРХ
Як зазначено в табл. 1, ГЕРХ може маніфестувати атипово легеневими (астма, хронічний кашель), отоларингологічними (ларингіт, осиплість голосу, сухе горло, глобус) або кардіальними (загрудинний біль) симптомами, часто без проявів печії та регургітації. Механізм виникнення атипових симптомів пов’язаний з мікроаспірацією малих порцій шлункового вмісту в гортань та бронхіальне дерево, що спричиняє локальне подразнення і кашель. Стимуляція кислотою аферентних нервових закінчень блукаючого нерва в дистальній частині стравоходу спричиняє виникнення некардіального загрудинного болю та вагус-опосередкованого бронхоспазму.
Легеневі симптоми. Бронхіальна астма (БА) і ГЕРХ є поширеними захворюваннями, які часто присутні в одного й того ж пацієнта. У 50–80 % хворих з БА зустрічається ГЕРХ, і майже у 75 % хворих виявляються зміни (порушення) при проведенні рН-метрії. Разом з тим тільки у 30 % хворих, у яких виявлено обидва діагнози, ГЕРХ є причиною виникнення БА. Причинно-наслідковий зв’язок між БА і ГЕРХ складний, оскільки кожен з цих станів може спричиняти виникнення іншого (ГЕРХ може викликати БА, але також і БА може провокувати виникнення ГЕРХ через виникнення негативного інтраторакального тиску і подолання бар’єрної функції НСС). До того ж препарати, які застосовуються для лікування БА, зокрема бронхолітики, провокують наростання рефлюксної симптоматики. Основні прояви ГЕРХ-асоційованої БА включають погіршення перебігу БА після вживання великих порцій їжі, алкоголю, перебування в горизонтальному положенні тіла, а також рефрактерність до лікування БА. Проведення діагностичних тестів, таких як рН-метрія й ЕГДС, має обмежені можливості у встановленні причинно-наслідкового зв’язку виникнення обох цих захворювань.
ЛОР-органи (вухо, горло, ніс). У 10 % випадків осиплості голосу, 60 % випадків хронічного ларингіту, 25–50 % випадків відчуття грудки в горлі (глобусу) виникають у зв’язку з наявністю гастроезофагеального рефлюксу. Ендоскопічна картина і дані рН-метрії в цих пацієнтів переважно в нормі. Рефлюксний ларингіт діагностується, як правило, на основі виявлення еритеми й набряку гортані, поверхневих виразок, гранульом, міжретиноїдних порушень (змін) при проведенні ларингоскопії. Незважаючи на те, що недавні дослідження показали, що такі порушення не є специфічними для ГЕРХ, тільки один симптом з вищенаведених спостерігався у 91 з 105 (87 %) здорових осіб без ознак рефлюксу чи ларингеальних порушень. Значна частина ларингеальних симптомів може бути пов’язана з іншими подразниками: алкоголь, тютюнопаління, респіраторні вірусні захворювання, перевантаження голосових зв’язок, алергени навколишнього середовища. Це також може пояснити той факт, що значна частина пацієнтів із ларингеальними симптомами (40–50 %) не відповідають на інтенсивну антисекреторну терапію. Ларингіт задньої стінки гортані, серединна еритема голосових зв’язок, контактні порушення (виразки, гранульоми) у пацієнтів з ГЕРХ виявляються частіше й дають кращу позитивну відповідь на антисекреторну терапію.
Лікування. Інтенсивна кислотосупресивна терапія ІПП двічі на добу перед їжею тривалістю 2–3 місяці визнана стандартом лікування атипових симптомів ГЕРХ і може бути кращим доказом взаємозв’язку між ГЕРХ та позастравохідними симптомами. Нещодавно проведені подвійні сліпі плацебо-контрольовані дослідження не показали очевидного ефекту від застосування ІПП двічі на добу в подоланні ларингеальних симптомів. Подібні дослідження у пацієнтів із БА виявили незначний позитивний ефект тільки в пацієнтів із нічними проявами БА. Виконання антирефлюксних хірургічних операцій із метою подолання БА виявило нижчу результативність порівняно з пацієнтами, яким оперативне втручання проводилось з метою припинення печії (45–50 % і 80–90 % відповідно).
Коментар робочої групи
Санаторно-курортне лікування є доцільним та ефективним етапом лікування хворих на ГЕРХ завдяки збільшенню періоду ремісії, підвищенню якості життя та зниженню ризику розвитку ускладнень [17–28].
Безперечною перевагою використання природних та преформованих фізичних чинників є здатність кожного з них впливати на декілька ланок патогенезу формування патологічного процесу одночасно, що суттєво поліпшує перебіг основного та супутніх захворювань.
Завдяки застосуванню фізичних чинників відбувається пригнічення кислотоутворення, підвищення тонусу нижнього стравохідного сфінктера, реалізуються протизапальний та аналгезуючий ефекти щодо слизової оболонки стравоходу, відбувається відновлення антеградної моторики та трофіки езофагогастродуоденальної системи, поліпшується функціональний стан підшлункової залози та гепатобіліарної системи, що особливо важливе при змішаному рефлюктаті.
9. Суперечливі питання
Скринінг стравоходу Барретта
ГЕРХ є головною причиною виникнення аденокарциноми стравоходу (68–90 %). Аденокарцинома частіше зустрічається в пацієнтів із ГЕРХ, і її частота зростає паралельно підвищенню частоти й важкості симптомів рефлюксу. Первинна діагностика (скринінг) показана більшою мірою для осіб білої раси чоловічої статі віком старше 50 років із тривалістю симптомів рефлюксу більш ніж 10 років. Якщо при проведенні первинної ендоскопії не виявлено стравоходу Барретта і/або езофагіту, наступне ендоскопічне спостереження не показано до тих пір, поки у пацієнта не спостерігатимуться значні зміни в симптоматиці захворювання. Необхідність повторного ендоскопічного спостереження за пацієнтами зі стравоходом Барретта дискусійна, оскільки аденокарцинома стравоходу діагностується в США рідко (6000–7000 випадків на рік), а стравохід Барретта виявляється у 0,4–0,8 % населення. Спостереження за таким пацієнтом протягом року вимагає високих затрат — 100 000–500 000 доларів США. Сучасні стандарти рекомендують виконувати повторні ендоскопії кожні 2 роки. Контрольні ендоскопічні спостереження за дисплазією виконуються частіше. Спостереження припиняється, якщо клінічна ситуація потребує проведення резекції стравоходу.
Ендоскопічні види лікування, такі як термальна абляція, фотодинамічна терапія і ендоскопічна резекція ураженої слизової, дають надію на одужання пацієнтам, яким протипоказано оперативне втручання. Такі методи лікування спричиняють менше ускладнень, але також дають нижчу ефективність (60–70 % одужання від раку і дисплазії високого ступеня після контрольного огляду через 2 роки). Прихований рак або дисплазія високого ступеня, локалізовані нижче епітеліального шару, можуть перешкоджати успішному ендоскопічному моніторингу.
Лікування інфекції Н.рylori
Інфікування бактерією Helicobacter pylori в пацієнтів із переважаючими (домінуючими) симптомами рефлюксу зустрічається з такою ж частотою або рідше, ніж в загальній популяції. Успішна ерадикаційна терапія не призводить до зменшення симптомів рефлюксу. В деяких дослідженнях виявлено зменшення ефективності ІПП після успішної антихелікобактерної терапії, однак такі висновки залишаються неоднозначними. В одному рандомізованому клінічному дослідженні було встановлено, що ерадикація H.pylori призводить до більш стійкої форми ГЕРХ. Обов’язкова ерадикація Н.pylori не показана хворим із ГЕРХ.
10. Стратегія літературного пошуку
Для попередньої версії цих настанов було розпочато пошук літератури з вересня 2000 року. Було враховано результати двох попередніх літературних оглядів:
— Американська колегія гастроентерологів: оновлені рекомендації з діагностики та лікування гастроезофагеальної рефлюксної хвороби (2005 рік), пошук літератури з початку 2004 року;
— Клініко-практичні рекомендації для лікування дорослих з гастроезофагеальною рефлюксною хворобою на етапі первинної медичної допомоги (2003 рік), пошук літератури з травня 2002 року.
Пошук більш сучасної літератури був проведений на Medline із січня 2004 по травень 2006 року з використанням основних ключових слів: гастроезофагеальна рефлюксна хвороба (ГЕРХ або НЕРХ (неерозивна рефлюксна хвороба), НЕЗС (неерозивні захворювання стравоходу)), дорослі, англійська мова, клінічні випробування й настанови. Термінологія, що використовується для конкретних специфічних пошуків в рамках основних ключових слів, включає наступне: симптоми (атипові симптоми, печія, загрудинна печія, що проявляється після їжі або у положенні лежачи, осиплість голосу, ларингіт, біль у горлі, хронічний кашель, біль у грудній клітці, бронхоспазм/астма, дентальні ерозії), нічні симптоми (або нічний кислотний прорив), ендоскопія, рН-моніторинг, манометрія, провокаційні тести (Бернштейна), відеоезофагографія, емпіричні/терапевтичні випробування кислотосупресією, спосіб життя/лікування (уникання жирної їжі, шоколаду, перцю, продуктів, що містять етанол; положення лежачи протягом 3 годин після їжі; підйом головного кінця ліжка; втрата ваги), антациди, альгінати (гавіскон), обволікаючі, прокінетики (цизаприд, метоклопрамід, бетанекол, домперидон), антагоністи Н2-рецепторів гістаміну (нізатидин, ранітидин, фамотидин, циметидин), інгібітори протонної помпи (омепразол, лансопразол, рабепразол, пантопразол, езомепразол), фундоплікація (відкритий доступ або лапароскопічно; антирефлюксні ендоскопічні процедури), стравохід Барретта (скринінг, спостереження). Детальні терміни спостереження й стратегії доступні за запитом. Пошук проводився по кожному компоненту, що пов’язаний з конкретним завданням (за запитом). Пошук був доповнений новою інформацією, доступною для експертів, у тому числі резюме з недавніх конференцій і результатів клінічних досліджень. Проводився спеціальний пошук негативної інформації в дослідженнях. Пошук проводився однократно, висновки базувались на проспективних рандомізованих клінічних дослідженнях, якщо це було можливо для виключення інших даних, а якщо рандомізовані контрольовані дослідження були недоступні, то до розгляду були прийняті клінічні спостереження. Для оцінки рівня ефективності були прийняті до уваги думки експертів.
Розкриття інформації про конфлікт інтересів
Університет штату Мічиган системи охорони здоров’я схвалює стандарти Американської колегії гастроентерологів і Ради з акредитації з медичної освіти та розкриває відносини з комерційними компаніями, чиї продукти або послуги обговорюються в ньому. Розкриття відносин має на меті не пошук похибки в поданій інформації, а надання читачам інформації, яка може становити потенційну важливість для них.
|
Члени команди |
Відношення |
Компанія |
|
Joel J. Heidelbaugh, MD |
(жодного) |
|
|
Arvin S. Gill, MD |
(жодного) |
|
|
R. Van Harrison, PhD |
(жодного) |
|
|
Timothy T. Nostrant, MD |
Консультант |
Astra-Zeneca, Astra-Zeneca, Sartoris, Tapp (Takeda), Wyeth |
Список літератури, представлений у прототипі адаптованої клінічної настанови
1. American College of Gastroenterology: DeVault K.R., Castell D.O. Updated Guidelines for the Diagnosis and Treatment of Gastroesophageal Reflux Disease. American Journal of Gastroenterology, 2005; 100: 190–200. (В Консенсусі викладені рекомендації Американського коледжу гастроентерології з діагностики та лікування ГЕРХ).
2. American College of Gastroenterology: DeVault K.R. Updated Guidelines for the Diagnosis and Treatment of Gastroesophageal Reflux Disease. American Journal of Gastroenterology, 1999; 94(6): 1434–1442 (Консенсус включає в себе інформацію без останніх оновлень (див. вище)).
3. VA/DoD Clinical Practice Guideline for the Management of Adults with Gastroesophageal Reflux Disease in Primary Care Practice. Department of Veterans Affairs and Department of Defense, Draft 8a, March 12, 2003 (На 60 сторінках викладена детальна інформація з кожного аспекту діагностики та лікування).
4. Heidelbaugh J.J., Nostrant T.T. A Cost-Effective Approach to the Pharmacologic Management of Gastroesophageal Reflux Disease. Drug Benefit Trends 2004; 16: 463–471 (Поглиблене вивчення різних економічно ефективних підходів до лікування ГЕРХ).
5. Heidelbaugh J.J., Nostrant T.T. Medical and surgical management of gastroesophageal reflux disease. In: Heidelbaugh J.J. (ed.). Clinics in Family Practice: Gastroenterology. Philadelphia, PA: Elsevier, September 2004, 6(3): 547–568 (Систематичний огляд літератури та науково обґрунтованих рекомендацій для практики в діагностиці та лікуванні ГЕРХ).
6. Kahrilas P.J. Gastroesophageal Reflux Disease. JAMA, 1996; 276(12): 983–988 (Всеохоплюючий огляд лікування ГЕРХ з меншим акцентом на діагностичні методи).
7. Numans M.Е., Lau J., de Wit N.J., Bonis P.A. Short-term treatment with proton-pump inhibitors as a test for gastroesophageal reflux disease: a meta-analysis of diagnostic test characteristics. Annals of Internal Medicine, 2004; 140(7): 518–27 (Систематичний огляд літератури з 15 досліджень, що показують чутливість і специфічність успішного короткострокового лікування ІПП із використанням 24-годинного рН-моніторингу при встановленні діагнозу ГЕРХ).
8. Sridhar S. Clinical economics review: cost-effectiveness of treatment alternatives for gastro-oesophageal reflux disease. Alim. Pharmacol. Ther., 1996; 10: 865–873 (Економічна оцінка ефективності різних методів лікування. Інгібітори протонної помпи вважаються більш рентабельними, ніж антагоністи Н2-рецепторів гістаміну у пацієнтів з ерозивним езофагітом).
9.Vaezi M. Gastroesophageal reflux disease and the larynx. J. Clin. Gastroenterol, 2003; 36(3): 198–203 (Пропозиції щодо раціонального підходу до виявлення пацієнтів з ларингеальними ознаками та симптомами, що пов’язані з ГЕРХ).
Список літератури, що була використана в процесі адаптації
1. Наказ МОЗ України від 28.09.2012 № 751 «Про створення та впровадження медико-технологічних документів зі стандартизації медичної допомоги в системі Міністерства охорони здоров’я України».
2. Tack J. Functional gastroduodenal disorders / Tack J., Talley N.J., Camilleri M. [et al.] // Gastroenterology. — 2006. — № 130. — P. 1466–1479.
3. Vakil N. The Montreal Definition and Classification of Gastroesophageal Reflux Disease: A Global Evidence-Based Consensus / N. Vakil, S.V. van Zanten, P. Kahrilas [et al.] // Am. J. Gastroenterol. — 2006. — № 101. — P. 1900–1920.
4. Ofman J. The economic and quality-of-life impact of symptomatic gastroesophageal reflux disease / Ofman J. // Am. J. Gastroenterol. — 2003. — № 98 (suppl.). — P. S8–S14.
5. Pace F. Heterogeneity of endoscopy negative heartburn: Epidemiology and natural history / Fabio Pace, V. Casini // World J. Gastroenterol. — 2008. — № 14(34). — P. 5233–5236.
6. Wahlqvist P. Validity of a work productivity and activity impairment questionnaire for patients with symptoms of gastro-esophageal reflux disease (WPAI-GERD) — results from a cross-sectional study / Wahlqvist P., Carlsson J., Stalhammer N.O. [et al.] // Value Health. — 2002. — № 5. — P. 106–13.
7. Ofman J.J. The clinical and economic impact of competing management strategies for gastro-esophageal reflux disease / Ofman J.J., Dorn G.H., Fennerty M.B. [et al.] // Aliment. Pharmacol. Ther. — 2002. — № 16. — P. 261–73.
8. Camilleri M. Functional Gastrointestinal Disorders: Novel Insights and Treatments / M. Camilleri // http://www.medscape.com/viewarticle/407938.
9. Wahlqvist P. Relationship between symptom load of gastro–esophageal reflux disease and health related quality of life, work productivity, resource utilization and concomitant diseases: survey of US cohort / Wahlqvist P., Karlsson M., Jonson D. [et al.] // Aliment. Pharmacol. Ther. — 2008. — № 27(10). — Р. 960–970.
10. Talley N.J. Functional Gastrointestinal Disorders as a public health problem / Talley N.J. // Neurogastroenterol. Motil. — 2008. — № 20, Suppl. — P. 121–129.
11. Tytgat G.N. New algorithm for the treatment of Gastro-esophageal reflux disease / G.N. Tytgat, K. Mccoll, J. Tack [et al.] // Alimentary Pharmacology and Therapeuts / Posted 02.04.2008.
12. Dickman R. The effect of a therapeutic trial of high-dose rabeprasole on symptom response of patients with non-cardiac chest pain: a randomized doubl-blind, placebo-controlled, crossover trial / R. Dickman, S. Emmons, H. Cui [et al.] // Aliment. Pharmacol. Ther. — 2005. — № 22. — P. 547–555.
13. Chiba T. Effects of itiopride hydrochloride and ranitidine in patients with functional dyspepsia: comparison between prokinetic and acid suppression therapies / T. Chiba, Y. Tokunaga, K. Ikeda [et al.] // Hepatogastroenterology. — 2007. — № 54(78). — P. 1878–1881.
14. Malfertheiner P. The Maastricht recommendations and their impact on general practice. Ibid, (suppl. 2): 563–567.
15. Острогляд А.В. Гастроезофагеальна рефлюксна хвороба: діагностика, поширеність, фактори ризику: автореф. дис... д-ра мед. наук / А.В. Острогляд. — 2008. — 32 с.
16. Canto M.I.F., Setrakian S., Willis J. et al. Methylene bluedirected biopsies improve detection of intestinal metaplasia and dysplasia in Barrett’s esophagus // Gastrointest. Endosc.— 2001.— 54(3).— P. 289–293.
17. Александров В.В. Основы восстановительной медицины и физиотерапии: учеб. пособие / В.В. Александров, А.И. Алгазин. — М.: ГЭОТАР-Медиа, 2009. — 144 с.
18. Вологжанина Л.Г. Эффективность применения питьевой сульфатной магниево-кальциевой минеральной воды в комплексном лечении больных язвенной болезнью двенадцатиперстной кишки, сочетающейся с гастроэзофагеальной рефлюксной болезнью / Л.Г. Вологжанина, Е.В. Владимирский // Вопросы курортологии, физиотерапии и лечебной физической культуры. — 2005 — № 6. — С. 17–19.
19. Выгоднер Е.Б. Физические факторы в гастроэнтерологии / Выгоднер Е.Б. — Москва, 1987. — 302 с.
20. Корепанов А.М., Михайлова М.Д. Применение курортных факторов в лечении гастроэзофагеальной рефлюксной болезни // Вопросы курортологии, физиотерапии и лечебной физической культуры. — 2011 — № 2. — С. 27–30.
21. Медицинская реабилитация. В 3 т. / Под ред. В. М. Боголюбова. — М.: 2007. — Т. 3. — 584 с.
22. Мінеральні води України / За ред. Е.О. Колесника, К.Д. Бабова. — К.: Купріянова, 2005. — 571 с.
23. Михайлова М.Д. Гастроэзофагеальная рефлюксная болезнь: сравнительная эффективность немедикаментозного и медикаментозного методов лечения: Автореф. дис... канд. мед. наук: спец. 14.01.04 «Внутренние болезни» / Михайлова М.Д. — Ижевск, 2012. — 25 с.
24. Пономаренко Г.Н., Золотарева Т.А. Физические методы лечения в гастроэнтерологии. — Спб.: ИИЦ «Балтика», 2004. — 287 с.
25. Русенко Н.И. Минеральные воды в лечении больных гастроэзофагеальной рефлюксной болезнью с кардиальными проявлениями: Автореф. дис... канд. мед. наук: спец. 14.00.51 «Восстановительная медицина, спортивная медицина, курортология и физиотерапия» / Русенко Н.И. — Москва, 2006. — 23 с.
26. Санаторная терапия больных с гастроэзофагеальной рефлюксной болезнью / Л.Т. Гильмутдинова [и др.] // Физиотерапевт. — 2011. — № 6. — С. 55–56.
27. Физиотерапия и курортология / Под ред. В.М. Боголюбова. — Книга IІ. — М.: БИОНОМ, 2008. — 408 с.
28. Физиотерапия: национальное руководство / Под ред. Г.Н. Пономаренко. — М.: Медиа, 2009. — 864 с.