Журнал «Здоровье ребенка» 2 (53) 2014
Вернуться к номеру
Новые возможности вакцинопрофилактики: инвазивные пневмококковые заболевания, пневмонии, отиты у детей можно предупредить
Авторы: Бережной В.В., Козачук В.Г. - Национальная медицинская академия последипломного образования им. П.Л. Шупика, г. Киев
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
В обзорной статье приведены данные о роли пневмококковой инфекции в развитии заболеваний лор-органов и дыхательной системы у детей. Рассмотрены вопросы антибиотикорезистентности и применения вакцин против пневмококковой инфекции у детей.
В оглядовій статті надані дані про роль пневмококової інфекції в розвитку захворювань лор-органів і дихальної системи в дітей. Розглянуті питання антибіотикорезистентності й використання вакцин проти пневмококової інфекції в дітей.
This review article presents data on the role of pneumococcal infection in the development of diseases of ENT organs and respiratory system in children. We considered the problems of antibiotic resistance and the use of vaccines against pneumococcal infection in children.
пневмококк, пневмония, отит, вакцины, Синфлорикс™.
пневмокок, пневмонія, отит, вакцини, Синфлорикс™.
pneumococcus, pneumonia, otitis, vaccines, Synflorix™.
Статья опубликована на с. 69-75
Пневмококковые заболевания продолжают оставаться проблемой здравоохранения во всем мире. Большая распространенность пневмококковых инфекций, разнообразие инвазивных серотипов пневмококков, нарастание антибиотикорезистентности определили целесообразность широкой вакцинации, которую осуществляют в настоящее время во многих странах мира. Согласно позиции Всемирной организации здравоохранения (ВОЗ), специфическая вакцинопрофилактика — единственный способ существенно повлиять на заболеваемость пневмококковой инфекцией. В Европе каждый год регистрируется более 250 тыс. случаев пневмококковой инфекции. В 95 % случаев пневмококковые инфекции имеют внегоспитальный характер [1].
По данным ВОЗ, именно пневмококковая инфекция является ведущей причиной смертности от управляемых с помощью вакцинопрофилактики инфекций [2].
При этом 90 % летальных случаев отмечено в развивающихся странах [3].
Исследование, проведенное в США Центром по контролю и предупреждению заболеваемости (Center of Disease Control and Prevention, 2009), выявило, что приблизительно в одной трети летальных случаев в результате пандемии гриппа А (H1N1) в 2009 г. причиной смерти стала коинфекция с пневмококком.
Пневмококк является возбудителем инвазивных и неинвазивных пневмококковых заболеваний у детей в возрасте до 5 лет. Инвазивные пневмококковые заболевания (ИПЗ) определяются выделением пневмококка из стерильных жидкостей организма (ликвор, кровь, плевральная, перикардиальная жидкости). Неинвазивные пневмококковые заболевания определяются выделением возбудителя из мокроты, жидкости среднего уха, слизистой задней стенки носоглотки и др. [4].
В среднем около 75 % всех случаев ИПЗ и 83 % случаев пневмококкового менингита наблюдаются среди детей в возрасте младше 2 лет. От 8,7 до 52 % случаев пневмонии наблюдается среди детей в возрасте младше 6 месяцев. Показатель летальности при ИПЗ остается высоким, колеблясь от 20 % при септицемии до 50 % при менингите в развивающихся странах. Показатели смертности наиболее высокие среди детей раннего возраста [4].
Наиболее тяжелой формой ИПЗ и основной причиной смерти у детей в возрасте до 1 года является сепсис. Ежегодно в мире миллионы детей умирают от тяжелого сепсиса вследствие пневмококковой инфекции [3, 5].
/69/69.jpg)
Пневмококковый менингит является самой тяжелой формой менингита и смертельно опасным заболеванием с летальностью от 5 до 30 %. В 60 % случаев пневмококковый менингит сопровождается стойкими неврологическими последствиями (потеря слуха, психические нарушения, нарушения двигательной активности, умственные расстройства) [6–14].
Пневмококк является лидирующей причиной внебольничных пневмоний у детей первых лет жизни. Детский фонд ООН (ЮНИСЕФ) назвал пневмонию «невидимым убийцей детей» [15].
Во всем мире более 150 миллионов детей в возрасте до 5 лет ежегодно страдают от пневмонии, из них 1,4 миллиона погибают. Во всем мире пневмония убивает больше детей в возрасте до 5 лет, чем СПИД, малярия и корь, вместе взятые [17–18].
Острый средний отит (ОСО) остается одной из наиболее распространенных детских болезней. Пневмококк и нетипируемая гемофильная инфекция являются основными возбудителями бактериального ОСО у детей в возрасте до 5 лет. В среднем в 80 % случаев ОСО вызваны пневмококком (25–62 % случаев) и нетипируемой гемофильной инфекцией (17–56 % случаев) [18–24].
80 % детей в возрасте до 3 лет имеют по крайней мере один эпизод ОСО с возможными рецидивами в более позднем детстве. ОСО может приводить к потере слуха, головокружению и шуму в ушах. В Канаде результаты исследования лиц, ухаживающих за маленькими детьми, показали, что почти 40 % таких людей были вынуждены отпрашиваться с работы, чтобы обеспечить медицинский уход, требуемый для лечения ОСО у этих детей [25–27].
В Украине, согласно статистике Министерства здравоохранения, каждый год среди детей в возрасте от 0 до 6 лет наблюдается более 120 тыс. случаев ОСО, 45–50 тыс. случаев пневмонии и 2 случая менингита невыясненной этиологии [28].
В России, по данным исследования PAPIRUS, заболеваемость внебольничными пневмониями (согласно определению ВОЗ) в год составила более 530 случаев на 100 тыс. детей в возрасте до 5 лет. Показатель заболеваемости ОСО (клинически диагностированным оториноларингологом) составил около 27 случаев на 100 человеко-лет, или 2,27 случая на 100 человеко–месяцев, у детей до 5 лет [29].
Возбудитель
В 1881 г. Пастер и Стернберг выделили микроорганизм, который в 1886 г. Френкель назвал пневмококком. В 1944 г. Авери, Мак-Лиг и Мак-Карти описали различия капсулированных и некапсулированных штаммов, ставшие принципиальным маркером разделения микроорганизмов [30].
Пневмококк представляет собой грамположительный инкапсулированный диплококк.
/70/70.jpg)
Полисахаридная капсула бактерии является существенным фактором вирулентности. На основе различий в композиции полисахаридной капсулы на сегодняшний день выделяют 46 серогрупп пневмококков, подразделяющихся на 93 серотипа. Иммунитет, индуцируемый инфекцией, сероспецифичен, но может наблюдаться и перекрестная защита среди родственных серотипов [31].
80–90 % ИПЗ вызывают 10–15 серотипов. Распространение серотипов, вызывающих заболевание, варьирует в зависимости от возраста, клинических проявлений заболевания, тяжести течения, географического местоположения и времени [4, 32, 33].
Заболевание
Пневмококковая инфекция передается воздушно–капельным и контактным путем. Пневмококк может поражать различные системы организма, что способствует возникновению определенного числа синдромов заболевания. Временная колонизация пневмококка на слизистой оболочке носоглотки является первичным очагом инфекции и редко трансформируется в заболевание. Определенные серотипы пневмококка иногда могут проникать в поток крови, вызывая бактериемию и, возможно, вторичное инфицирование органов, таких как мозг, с развитием менингита. В других случаях непосредственное распространение возбудителя из носоглотки может вызвать такие заболевания, как средний отит или синуситы, воспаление верхних и нижних дыхательных путей. В случае если пневмония ассоциируется с бактериемией, заболевание классифицируется как ИПЗ. Пневмококковые средний отит и синуситы являются неинвазивными и менее тяжелыми заболеваниями, но встречаются более часто [4].
Основой лечения пневмококковых заболеваний является антибактериальная терапия. Антибактериальные препараты пенициллинового ряда являются средствами выбора при пневмококковых инфекциях. Однако резистентность пневмококка к пенициллину все более часто наблюдается во всех странах мира. Исследования, проведенные в нескольких европейских государствах, показали, что в 25 % случаев выделенный пневмококк не был чувствителен к пенициллину [35].
Изучение чувствительности пневмококков в России свидетельствует об устойчивости к пенициллину около 10 % штаммов, циркулирующих среди населения; уровень устойчивости выше в детских коллективах. В последние годы во многих странах мира отмечается рост резистентности пневмококка к различным классам антибактериальных препаратов, при этом региональные данные о резистентности пневмококков в значительной степени могут различаться. Доля резистентных штаммов микроорганизма в мире варьирует от менее 5 % до более 50 %, что зависит от географического региона, популяции (чаще у детей), локализации инфекции и клинического окружения. По данным эпидемиологического исследования PROTEKT, в 2003–2004 гг. нечувствительность к пенициллину была отмечена у 35,7 %, а к макролидам — у 36 % клинических штаммов пневмококка. Чувствительность к цефалоспоринам II–III поколений в целом коррелировала с чувствительностью к пенициллину [36].
/71/71.jpg)
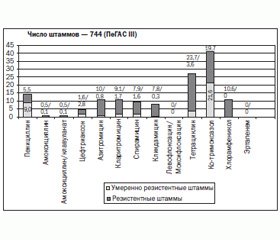
В России, по данным многоцентрового исследования ПеГАС I–III, за период 1999–2009 гг. количество резистентных к пенициллину, амоксициллину (амоксициллину/клавуланату и амоксициллину/сульбактаму), цефиксиму, цефтибутену, цефтриаксону и цефотаксиму штаммов составляло 11; 0,4 (0,4 и 0,4); 6,8; 12,9 и 1 % соответственно. Согласно исследованиям, устойчивость пневмококка к 14-, 15- и 16-членным макролидам в течение указанного периода составляла 8,2; 8,2 и 6,3 % соответственно. Резистентность пневмококков к эритромицину, по данным исследований PROTEKT и SAUCE 4, в США составила 29,3 %, в Испании — 81,3 % и в Японии — 81,9 %. Стабильно низкая активность в отношении пневмококка в России наблюдалась у ко-тримоксазола (31,7 % устойчивых штаммов в 1999–2003 гг. и 39,0 % в 2006–2009 гг.), а также у тетрациклина (27,3 % устойчивых штаммов в 1999–2003 гг. и 24,6 % — в 2006–2009 гг.) [37].
Причины развития устойчивости к антибактериальным препаратам многообразны. Среди них значимое место занимают необоснованное назначение антибактериальных средств; ошибки в выборе антибактериального препарата, режима дозирования антибактериального препарата, комбинированного назначения антибиотика, длительность антибактериальной терапии. Самый большой уровень резистентности наблюдается среди штаммов, выделенных у детей, посещающих детские учреждения, которые принимали антибактериальные препараты [38].
Повышение уровня антибиотикорезистентности особенно подчеркивает важность иммунопрофилактики. В результате широкомасштабного внедрения иммунизации против пневмококковой инфекции наблюдается снижение циркуляции резистентных штаммов [4].
ВОЗ рекомендует введение вакцинации против пневмококковой инфекции для детей первых лет жизни. В настоящее время для профилактики пневмококковых инфекций сертифицированы принципиально отличающиеся по составу и тактике применения вакцины — полисахаридные и конъюгированные. С 2000 г. пневмококковые конъюгированные вакцины стали применять в рамках универсальной массовой вакцинации. В 2011 г. 72 страны мира внедрили универсальную массовую вакцинацию против пневмококковых заболеваний, из них 22 страны в Европе. Наиболее распространенной схемой вакцинации в рамках универсальной программы является схема 2 + 1, где 2 дозы вводятся на 1-м году жизни с интервалом 2 месяца, а 3-я доза вводится через 6 месяцев после предыдущей. Вакцинация против пневмококковых заболеваний может быть проведена одновременно с введением других педиатрических вакцин во время одного визита к врачу [4].
Ряд исследований демонстрирует, что во время сезонных вспышек гриппа в предыдущие годы заранее проведенная вакцинация пневмококковыми конъюгированными вакцинами способствовала снижению риска госпитализации и смерти детей от гриппа. В частности, была показана высокая эффективность среди младенцев в отношении гриппа А и вирус-ассоциированных пневмоний, что подчеркивает необходимость включения пневмококковых вакцин в расширенную стратегию по предотвращению грипп-ассоциируемой заболеваемости и смертности (табл. 3).
Пневмококковые вакцины
Первые попытки иммунизации против пневмококка относятся к 1911 г., когда А. Райт и соавт. с относительным успехом применили цельноклеточную убитую пневмококковую вакцину для иммунизации в Южной Америке. После установления роли полисахаридной капсулы пневмококка довольно успешно были внедрены в практику 4-валентная и 6-валентная полисахаридные вакцины. В 1977 г. была создана и зарегистрирована в США 14-валентная вакцина, а в 1983 г. ее сменили 23-валентные препараты. Недостатком пневмококковых полисахаридных вакцин был слабый иммунный ответ у детей в возрасте до 2 лет. Именно по этой причине были разработаны пневмококковые конъюгированные вакцины. Принцип конъюгации полисахаридов с белками предложили в 1928 г. Гобель и Авери. Определение «пневмококковая конъюгированная вакцина» применяется для вакцин, основанных на химическом соединении полисахаридов пневмококка с конъюгатом. Конъюгированные вакцины — Т-зависимые антигены. Конъюгат является, с одной стороны, носителем, а с другой — адъювантом, и это способствует сильному Т-зависимому ответу даже у детей первых месяцев жизни. Важнейший механизм защиты, создаваемый конъюгированной вакциной, — формирование протеинспецифических Т- и полисахаридспецифических В-клеток памяти, при контакте с инфекцией обеспечивающих быстрое образование высокоавидных антител в высоких концентрациях. Это усиливает выработку антител и индуцирует иммунную память [4, 30].
В настоящее время на рынке имеется два разных типа пневмококковых вакцин: 23-валентная пневмококковая полисахаридная вакцина (ППВ23), которая доступна с 1980 г., и две пневмококковые конъюгированные вакцины, доступные на рынке с 2009 г.: 10-валентная (ПКВ10 + NTHi) и 13-валентная (ПКВ13). 7-валентная конъюгированная вакцина (ПКВ7) постепенно исчезает с рынка [4].
Пневмококковые конъюгированные вакцины:
— ПКВ7: 4, 6B, 9V, 14, 18C, 19F, 23F;
— ПКВ13: 4, 6B, 9V, 14, 18C, 19F, 23F, 1, 5, 7F, 3, 6A, 19A;
— ПКВ10 + NTHi: 4, 6B, 9V, 14, 18C, 19F, 23F, 1, 5, 7F.
ПКВ10 + NTHi (Синфлорикс™) содержит очищенные капсулярные полисахариды, 10 серотипов: 1, 4, 5, 6В, 7F, 9V, 14, 18C, 19F и 23F. Белок D внешней мембраны нетипируемой Haemophilus influenzae используется как белок-носитель для 8 из 10 серотипов (серотипов 1, 4, 5, 6В, 7F, 9V, 14 и 23F); серотип 19F конъюгирован с дифтерийным анатоксином, а серотип 18С — со столбнячным анатоксином [4].
Конъюгация на D-белке нетипируемой Haemophilus influenzaе (NTHi) минимизирует риск интерференции, связанной с белком-носителем, и благодаря своим антигенным свойствам может предотвратить ОСО, вызываемый NTHi. Три дополнительных серотипа (1, 5 и 7F) по сравнению с предшественником ПКВ7 расширили покрытие серотипов против ИПЗ до 80 % и более в большинстве регионов, включая серотипы, ответственные за заболевания у детей старшего возраста [39].
Обзор исследований, проведенных для ПКВ10 + NTHi (Синфлорикс™)
Результаты более чем 80 клинических научных исследований, проведенных в разных странах мира, позволили четко обосновать безопасность, иммуногенность и эффективность ПКВ10 + NTHi (Синфлорикс™).
Системный анализ и метаанализ данных по серотипам ИПЗ, полученным от детей в возрасте младше 5 лет в течение 1980–2007 гг., т.е. до внедрения на национальном уровне ПКВ7, продемонстрировали, что серотипы, включенные в ПКВ7, были ответственны за возникновение 49 % и более случаев ИПЗ в каждом географическом регионе, хотя и с выраженными региональными колебаниями (49–82 %), с наивысшим уровнем охвата в Северной Америке и Европе. Соответствующий охват, рассчитанный для серотипов вакцин PСV10 и PСV13, достигал 70 % и более случаев ИПЗ в каждом регионе с колебаниями от 70 до 84 % и от 74 до 88 % соответственно.
Предшественница ПКВ10 + NTHi (Синфлорикс™), первая инициальная 11-валентная ПКВ, содержала серотип 3 в дополнение к 10 серотипам, содержащимся в ПКВ10 + NTHi. Каждый из 11 серотипов был конъюгирован на протеине D. Эффективность предшественника 11-валентной ПКВ была изучена в рамках крупного рандомизированного двойного слепого плацебо–контролируемого исследования эффективности против пневмококкового отита (POET), которое проводилось в Европе в период с 2000 по 2004 год. В исследовании принимали участие 4968 младенцев, из которых 2489 получили ПКВ11 — PD. По результатам исследования в ПКВ11 — PD, испытанную в предыдущих клинических исследованиях, были внесены три ключевых изменения. В последней рецептуре ПКВ10 + NTHi (Синфлорикс™) белок-носитель для полисахарида серотипа 18C был заменен столбнячным анатоксином, а белок-носитель для полисахарида серотипа 19F — дифтерийным анатоксином. Кроме того, было принято решение удалить из вакцины серотип 3, поскольку защитная эффективность против эпизодов ОСО, вызванных пневмококковым серотипом 3, не могла быть продемонстрирована в исследовании POET. Еще одной причиной удаления данного серотипа стало появление атипичной иммунной реакции против серотипа 3, для которой концентрации антител после бустерной вакцинации оставались ниже уровней, измеренных после первичной вакцинации, и даже значительно ниже концентраций антител к серотипу 3, измеренных после однократной дозы конъюгированной вакцины на втором году жизни. Кроме того, функциональная опсонофагоцитарная активность против серотипа 3 хотя и измерялась после первичной иммунизации и вызывала достаточно высокую бустерную реакцию, не соотносилась с клинической защитой. Было установлено, что серотип 3 имеет специфические характеристики, которые снижают чувствительность данного серотипа к иммунологическим защитным механизмам.
Также было отмечено, что ПКВ10 + NTHi (Синфлорикс™) индуцирует выработку перекрестно-реагирующих антител против серотипов 6A и 19A после первичной и бустерной вакцинации. Перекрестная иммунная реакция на серотип 6A после вакцинации ПКВ10 + NTHi находится в том же диапазоне, что и после вакцинации ПКВ7. Титр антител перекрестно-реагирующих серотипов 19A был выше после вакцинации ПКВ10 + NTHi по сравнению с ПКВ7 [39].
Влияние вакцинации ПКВ10 + NTHi (Синфлорикс™) на частоту ИПЗ рассматривалось в рамках первого рандомизированного контролируемого Европейского клинического исследования The Finnish Invasive Pneumococcal Disease Vaccine Trial (FinIP), в котором принимало участие 47 369 детей. ПКВ10 + NTHi (Синфлорикс™) продемонстрировала высокую клиническую эффективность в предупреждении ИПЗ (93–100 %) у детей в возрасте до 2 лет жизни, которые подвергаются наибольшему риску возникновения инфекции. Результаты исследования FinIP продемонстрировали, что вакцина имеет высокую эффективность при использовании 3-дозовой схемы вакцинации (2 + 1) и 4-дозовой схемы (3 + 1) у детей в возрасте от 7–18 месяцев (дети получили две или три дозы на 1-м году жизни с ревакцинацией на 2-м году жизни).
Впервые в мире результаты клинического исследования подтвердили эффективность вакцинации ПКВ по схеме 2 + 1, используемой в рамках национальных программ иммунизации в отношении ИПЗ. При использовании схемы вакцинации препаратом Синфлорикс™ 2 + 1 количество случаев ИПЗ, вызванных серотипами, входящими в состав вакцины, снизилось на 92 %. Вакцинация препаратом Синфлорикс™ по схеме 3 + 1 обеспечила 100% предотвращение случаев ИПЗ, вызванных серотипами, входящими в состав вакцины. Снижение числа всех случаев ИПЗ независимо от типа Streptococcus pneumoniae (S.pneumoniae) составило 93 % (табл. 4).
В исследовании POET была продемонстрирована эффективность предшественника ПКВ10 + NTHi (Синфлорикс™) в предупреждении острых средних отитов у детей. Было отмечено снижение на 57,6 % частоты отитов, вызванных серотипами, входящими в состав вакцины, и на 33,6 % уменьшилось количество всех острых средних отитов независимо от возбудителя [19].
В США Национальное руководство по диагностике и лечению острых средних отитов для врачей-отоларингологов рекомендует обязательную вакцинацию детей ПКВ для предупреждения острых средних отитов. Рутинная вакцинация детей ПКВ против ИПЗ, пневмоний, острых средних отитов в США проводится с 2000 г. [41].
Также изучена эффективность ПКВ10 + NTHi (Синфлорикс™) в предупреждении пневмоний. Вакцинация ПКВ10 + NTHi (Синфлорикс™) предупреждает 1 из 4 случаев пневмоний, подтвержденных рентгенологически, независимо от возбудителя, что было продемонстрировано результатами, полученными в Латинской Америке в ходе проведенного исследования COMPAS [42, 43].
Вакцинация ПКВ10 + NTHi (Синфлорикс™) у детей демонстрирует эффективность в предупреждении:
— всех случаев ИПЗ, вызванных серотипами пневмококка, входящими в состав вакцины;
— 1 из 3 случаев острого среднего отита независимо от возбудителя;
— 1 из 4 случаев пневмонии независимо от возбудителя.
ПКВ10 + NTHi (Синфлорикс™) впервые была зарегистрирована в 2008 г. На сегодняшний день она зарегистрирована в 117 странах мира, применяется в 96 странах.
В 2013 г. почти более 40 стран признали Синфлорикс™ предпочтительной вакциной для применения у детей в рамках национальных календарей иммунизации (например, Финляндия, Швеция, Чехия, Канада, Нидерланды, Новая Зеландия, Бразилия).
Синфлорикс™ была первой ПКВ, получившей преквалификацию ВОЗ для использования у детей в рамках национальных программ иммунизации. В мире использовано более 100 млн доз вакцины Синфлорикс™.
Вакцина Cинфлорикс™ предназначена для применения у детей в возрасте от 1,5 мес. жизни до 5 лет. Вакцинация препаратом Cинфлорикс™ дополняет Национальный календарь вакцинации по схеме 3 + 1 (3–4–5–18 мес. жизни). Вакцина может быть одновременно введена с другими педиатрическими вакцинами в разные участки тела во время одного визита к врачу (табл. 5) [44, 45].
В Украине в соответствии с Национальным календарем вакцинации вакцинация против пневмококковых заболеваний относится к рекомендованным прививкам. Применение пневмококковых конъюгированных вакцин позволит в ближайшем будущем значительно снизить заболеваемость пневмококковой инфекцией, предупредить развитие генерализованных форм заболевания, снизить показатели инвалидности и смертности.
Статья подготовлена при поддержке
ООО «ГлаксоСмитКляйн Фармасьютикалc Украина»
1. O’Brien K.L. et al. Burden of disease caused by Streptococcus pneumoniae in children younger than 5 years: global estimates // Lancet. — 2009. — 374. — 893–902.
2. WHO Global Immunization Vision and Strategy, April 2005. — www.who.int/vaccines/GIVS/english/Global_imm._data_EN.pdf.
3. National Institute of Allergy and Infectious Diseases. Pneumococcal Diseases. Available at: http://www.niaid.nih.gov/topics/pneumococal/Pages/PneumococcalDisease.aspx. Last accessed October 2012.
4. Pneumococcal vaccines, WHO position paper // Weekly epidemiological record. — 2012. — № 14, 87. — 129–144.
5. European Centre for Disease Prevention and Control Pneumococcal Infection. Factsheet for Healthcare Professionals. Available at: http://ecdc.europa.eu/en/healthtopics/pneumococcal_infection/basic_facts/Pages/health_prof essionals.aspx. Last accessed July 2011.
6. NINDS Meningitis and Encephalitis Information Page. Available at: http://www.ninds.nih.gov/disorders/encephalitis_meningitis/detail_encephalitis_meningitis.htm. Last accessed Nov 2012.
7. Isaacman D.J., McIntosh D., Reinert R.R. Burden of invasive pneumococcal disease and serotype distribution among Streptococcus pneumoniae isolates in young children in Europe: impact of the 7-valent pneumococcal conjugate vaccine and considerations for future conjugate vaccines // Int. J. Infect. Dis. — 2010. — 14. — e197–209.
8. Meningitis. Available from: http://emedicine.com/MED/topic2613.htm. Last accessed June 2012.
9. Atkinson W. et al. Epidemiology and prevention of vaccine–preventable diseases. — 10th ed.
10. Washington D.C. — Public Health Foundation. — 2008.
11. Pagliano P. et al. Pneumococcal meningitis in childhood: a longitudinal prospective study.
12. FEMS Immunol. Med. Microbiol. —2007. — 51. — 488–495.
13. Баранов А.А., Брико Н.И., Намазова-Баранова Л.С. // Вакцинопрофилактика. — 4/12.
14. McIntosh E.D. Treatment and prevention strategies to combat paediatric pneumococcal meningitis // Expert Rev. Anti Infect. Ther. — 2005. — 3(5). — 739–750.
15. UNICEF/WHO — Pneumonia: The forgotten killer of children. 2006. Available at: http://www.unicef.org/publications/files/Pneumonia_The_Forgotten_Killer_of_Children.pdf.
16. Rudan I. et al. Epidemiology and etiology of childhood pneumonia // Bull. World Health Organ. —2008. — 86. — 408–16.
17. Liu L. et al. Global, regional, and national causes of child mortality: an updated systematic analysis for 2010 with time trends since 2000 // Lancet. —2012. — 379. — 2151–2161
18. Ruohola et al. // Clin. Infect. Dis. — 2006. — 43. — 1417–22.
19. Prymula R., Peeters P., Chrobok V. et al. Pneumococcal capsular polysaccharides conjugated to protein D for prevention of acute otitis media caused by both Streptococcus pneumoniae and non-typeable Haemophilus influenzae: a randomised double-blind efficacy study // Lancet. — 2006. — 367. — 740–748.
20. Leibovitz E. et al. Haemophilus influenzae: a significant pathogen in acute otitis media // Pediatr. Infect. Dis. J. —2004. — 23. — 1142–1155.
21. Pichichero M.E. Evolving Shifts in Otitis Media Pathogens: Relevance to a Managed Care Organization // Am. J. Manag. Care. — 2005. — 11. — S192–S201.
22. Casey J.R., Pichichero M.E. Changes in frequency and pathogens causing acute otitis media in 1995–2003 // Pediatr. Infect. Dis. J. — 2004. — 23. — 824–828.
23. Casey J.R., Pichichero M.E. New Patterns in the Otopathogens Causing Acute Otitis Media Six to Eight Years After Introduction of Pneumococcal Conjugate Vaccine // Pediatr. Infect. Dis. J. — 2010. — 29. — 304–309.
24. Block S.L. et al. Community-wide vaccination with the heptavalent pneumococcal conjugate significantly alters the microbiology of acute otitis media // Pediatr. Infect. Dis. J. —2004. — 23. — 829–833.
25. Vergison A. et al. Otitis media and its consequences: beyond the earache // Lancet Infect. Dis. — 2010. — 10. — 195–203.
26. Dubé E. et al. Burden of acute otitis media on Canadian families // Can. Fam. Physician. —2011. — 57. — 60–65.
27. EAR Infections Attitude Research. — Oct. — Dec. 2010. Data on file GSK.
28. Чернышова Л.И. Пневмококові захворювання — проблема, що має рішення // Здоровье ребенка. — 2013. — № 3(46).
29. Козлов Р.С. и др. Результаты исследования распространенности в России внебольничной пневмонии и острого среднего отита у детей в возрасте до 5 лет (PAPIRUS). Роль S.pneumoniae и H.influenzae в этиологии данных заболеваний // Клин. микробиол. антимикроб. химиотер. — 2013. — 15(4). — 246–260.
30. Вакцины и вакцинация: Национальное руководство / Под ред. В.В. Зверева, Б.Ф. Семенова, Р.М. Хаитова. — 2011. — 872 с.
31. Prevention of pneumococcal disease among infants and children — use of 13-valent pneumococcal conjugated vaccine and 23-valent pneumococcal polysaccharide vaccine // MMWR Recommendation Report. — 2010. — Vol. 59. — P. 18.
32. PneumoADIP: Summary report of Stage 1/Version 1 analysis for SAGE meeting, 2007.
33. Hausdorff et al. // Lancet Infect. Dis. — 2005. — 5. — 83–93.
34. PneumoADIP: Summary report of Stage 1 / Version 1 analysis for SAGE meeting, 2007.
35. Карапетян Т.А. Проблема антибиотикорезистентности пневмококка в Карелии // Фундаментальные исследования. — 2006. — № 12. — С. 94–96.
36. Blasi F., Farrell D.J., Dubreuil L. Antibacterial activity of telithromycin and comparators against pathogens isolated from patients with communityacquired respiratory tract infections: the Prospective Resistant Organism Tracking and Epidemiology for the Ketolide Telithromycin study year 5 (2003–2004) // Diagn. Microbiol. Infect. Dis. — 2009. — 63(3). — 302–10.
37. Козлов Р.С., Сивая О.В., Кречникова О.И., Иванчина Н.В. Динамика резистентности Streptococcus pneumoniae к антибиотикам в России за период 1999–2009 гг. // Клиническая микробиология и антимикробная химиотерапия. — 2010. — Т. 12, № 4. — С. 329–341.
38. Infectious Diseases in Children, 2002; April: 51 http://microbiology.ru/index.php?article=557.
39. Roman Prymula and Lode Schuerman 10-valent pneumococcal nontypeable Haemophilus influenzae PD conjugate vaccine: Synflorix™ Expert Rev. // Vaccines. — 2009. — 8(11). — 1479–1500.
40. Palmu A. et al. Effectiveness of the ten-valent pneumococcal Haemophilus influenzae protein D conjugate vaccine (PHiD-CV10) against invasive pneumococcal disease: a cluster randomised trial // The Lancet. — 2012.
41. Allan S. et al. The Diagnosis and Management of Acute Otitis Media; Clinical Practice Guideline // Pediatrics. — March 2013. — Vol. 131, № 3.
42. Tregnaghi et al., XIV SLIPE, Punta Cana, May 2011.
43. Tregnaghi et al., 29th ESPID, The Hague, June 2011.
44. Наказ МОЗ України від 16.09.2011 № 595.
45. Инструкция по применению. Р.с. МЗ Украины № 850/11–300200000 от 21.07.2011.

/72/72.jpg)
/74/74.jpg)