Журнал «Здоровье ребенка» 4 (55) 2014
Вернуться к номеру
Участие интерлейкинового семейства 1 в развитии воспалительной реакции при инфекционном процессе. 3. Роль IL-1F4 (IL-18)
Авторы: Абатуров А.Е. - ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»; Волосовец А.П. - Национальный медицинский университет им. А.А. Богомольца, г. Киев;
Юлиш Е.И. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
В обзоре представлена характеристика IL-1F4 (IL-18), его механизма действия и значения в развитии воспалительной реакции.
В огляді подана характеристика IL-1F4 (IL-18), його механізму дії та значення в розвитку запальної реакції.
The review presents the characteristics of IL-1F4 (IL-18), its mechanisms of action and value in the development of inflammatory response.
воспаление, цитокин IL-1F4 (IL-18), инфекционный процесс.
запалення, цитокін IL-1F4 (IL-18), інфекційний процес.
inflammation, cytokine IL-1F4 (IL-18), infectious process.
Статья опубликована на с. 135-138
Введение
IL-1F4 (IL-18)
Цитокин IL-1F4 (IL-18), первоначально выделенный в 1989 году как IFN-y-индуцирующий фактор, продукция которого обусловлена введением LPS [11], был включен в интерлейкиновое семейство 1 только в 1995 году [7].
Синтез, процессинг и высвобождение IL-1F4 (IL-18)
Молекула IL-1F4 (IL-18) состоит из 192 аминокислотных остатков. Предполагается, что существует и короткая изоформа IL-1F4 (IL-18), образующаяся в результате альтернативного сплайсинга, который приводит к потере последовательности из 19 аминокислотных остатков [20].
Продуценты IL-1F4 (IL-18)
В самых разнообразных типах клеток человеческого организма отмечается конституциональная продукция проформы IL-1F4 (IL-18) 24-kDa. Основными продуцентами IL-1F4 (IL-18) являются макрофаги и DC [7], но в продукции IL-1F4 (IL-18) участвуют клетки Купфера, эпителиоциты слизистой оболочки кишечника, микроглиальные клетки, синовиальные фибробласты, хондроциты, остеобласты, кератиноциты, адипоциты [21, 22].
Процессинг и секреция IL-1F4 (IL-18)
Про-IL-1F4 (IL-18) становится активным только после каспаза-1-процессинга инфламмасомой, при котором происходит расщепление проформы IL-1F4 (IL-18) в Asp35 положении. Однако про-IL-1F4 (IL-18) может приобрести активную форму и под влиянием других внутриклеточных протеаз, таких как протеаза 3 (PR-3), сериновая протеаза, эластаза, катепсин G. Расщепление молекулы про-IL-1F4 (IL-18) в Asp71-Ser72- и Asp76-Asn77-положениях каспазой-3 приводит к образованию биологически неактивных пептидов. Активированная форма IL-1F4 (IL-18) секретируется в экстрацеллюлярное пространство, неактивированный про-IL-1F4 (IL-18) подвергается убиквитинированию [5, 8, 26, 28].
Активность секреции IL-1F4 (IL-18) зависит от процессов аутофагии клетки [17].
Рецепторы IL-1F4 (IL-18)
Высвобожденные из клеток продуцентов в экстрацеллюлярное пространство молекулы IL-1F4 (IL-18) оказывают свое биологическое действие, взаимодействуя со специфическим клеточным рецептором, который экспрессируется на мембранной поверхности разнообразных клеток, включая Т-лимфоциты, NK, макрофаги, моноциты, нейтрофилы, хондроциты. Рецептор IL-1F4 (IL-18) состоит из двух субъединиц IL-1R5 (IL-1Rrp1, IL-18R1 или IL-18Ra) и IL-1R7 (IL-18RacP, IL-18RII или IL-18Rb), молекулы которых состоят из трех иммуноглобулинподобных эктодоменов и одного интрацеллюлярного TIR домена. Молекула IL-1F4 (IL-18) непосредственно связывается только с субъединицей IL-1R5, что предопределяет формирование гетеротримерного комплекса IL-1R5/IL-1R7/IL-1F4 (IL-18) с последующей активацией TIR домена и возбуждением ассоциированных внутриклеточных сигнальных путей. Активации рецептора IL-1F4 (IL-18) препятствуют две изоформы IL-18-связывающего протеина (IL-18BPa, IL-18BPb), которые обладают высоким аффинитетом к зрелой форме IL-18. Молекула IL-18BP с единственным иммуноглобулинподобным доменом напоминает экстрацеллюлярный домен рецептора IL-18. IL-18BP также может образовывать с IL-1F7 комплекс IL-18BP/IL-1F7, который блокирует рецептор IL-18 [1, 2, 9, 13, 21, 32, 34]. В функционировании системы IL-18 принимают участие и короткие изоформы субъединиц рецептора IL-1F4 (IL-18). Короткая изоформа II типа субъединицы IL-1R5 (IL-1R5 II, IL-18Ra II типа), лишенная TIR домена, и солютабная короткая изоформа субъединицы IL-1R7 –(sIL-1R7, –sIL-18Rb), состоящая только из одного иммуноглобулинподобного домена, взаимодействуя с IL-1F4 (IL-18), препятствуют образованию его связи с полноценной субъединицей–IL-1R5 рецептора IL-1F4 (IL-18) [3, 27].
Действие IL-1F4 (IL-18)
В экспериментальных работах показано, что биологические свойства IL-1F4 (IL-18) зависят от цитокинового окружения. Особое влияние на характер действия IL-1F4 (IL-18) оказывают IL-2, IL-12, IL-15, IL-23, которые индуцируют экспрессию рецепторной субъединицы IL-1R7 [24]. В результате истинного синергизма IL-1F4 (IL-18) и IL-2, IL-12, IL-15 происходит матурация Т-лимфоцитов и NK, индуцируется продукция IFN-y CD4+, CD8+ T-лимфоцитами, NK и FasL NK. В свою очередь IFN-y усиливает экспрессию каспазы-1 и предопределяет развитие Th1 ответа и, возможно, аутоиммунного процесса. Совместное действие IL-1F4 (IL-18) и IL-23 активирует продукцию IL-17 Th17 клетками [5, 10, 30, 31, 35].
IFN-y является основным провоспалительным цитокином. Под влиянием IFN-y усиливается продукция интерлейкинов (IL-1F2 (IL-1-a), IL-6); провоспалительного цитокина TNF-a; рецептора интерлейкина IL-1а, хемокинов (хемотаксического фактора DC — CCL20), монокина, индуцируемого IFN-y (MIG/CXCL9), IFN-индуцибельного протеина-10 (IFN-inducible protein-10 — IP-10/CXCL10), IFN-индуцибельного Т-клеточного хемоаттрактанта (IFN-inducible T cell-a chemoattractant — I-TAC/CXCL11), тромбоцитарного фактора 4 (CXCL4), CCL5, ENA-78 (epithelial neutrophil-activating peptide-78), моноцитарных хемотаксических протеинов 2 (MCP2) и 3 (MCP3/CCL7), EBI1, SCYA2, SCYA5, SCYB10); хемокиновых рецепторов (CCR1, CCR3 и CCR6) [14, 15, 18, 22]. IFN-y активизирует продукцию макрофагами монооксида азота, обладающего мощным бактерицидным эффектом [12].
Цитокин IL-1F4 (IL-18) также способствует продукции IL-1F2 (IL-1-b), IL-8, TNF-a, MIP-3a/CCL20, молекул адгезии, в частности ICAM-1 (intracellular adhesion molecule-1), VCAM-1 (vascular cell adhesion molecule-1), и индуцирует ангиогенез [22].
Самостоятельно IL-1F4 (IL-18) индуцирует развитие Th2 ответа. Показано, что IL-1F4 (IL-18) без цитокинового окружения активирует продукцию гистамина тучными клетками, гистамина и IL-4 базофилами [24, 36]. Следует отметить, что IL-1F4 (IL-18) оказывает свое действие на наивные CD4+ Т-лимфоцитов в зависимости от цитокинового окружения. IL-1F4 (IL-18) в комбинации с IL-2 стимулирует дифференциацию наивных CD4+ Т-лимфоцитов в Th2 клетки, а совместно с IL-12 индуцирует дифференциацию наивных CD4+ Т-лимфоцитов в Th1-клетки и продукцию IFN-y. Совместное действие IL-12 и IL-1F4 (IL-18) приводит к ингибированию синтеза IgE, способствует снижению эозинофилии и уровня гиперреактивности бронхиального дерева [6, 30]. Таким образом, IL-1F4 (IL-18) может активировать генерацию как Th1, так и Th2 клеток [4, 16]. Однако in vivo избыточная продукция IL-1F4 (IL-18) способствует развитию Th1-ассоциированных заболеваний (волчаночноподобной болезни, аутоиммунного энцефаломиелита), атеросклероза и сопровождает инфаркт миокарда с высоким риском неблагоприятного исхода [5].
Клинические проявления гипопродукции IL-1F4 (IL-18)
Особенности проявлений IL-1F4 (IL-18)-дефицитного возбуждения представлены в табл. 1.
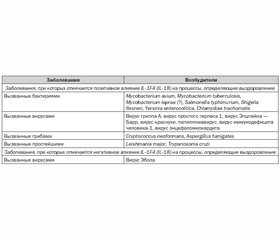
Значение IL-1F4 (IL-18) при инфекционных заболеваниях
Цитокин IL-1F4 (IL-18) играет ключевую роль в саногенезе инфекционных заболеваний (табл. 2) [33].
Заключение
Цитокин IL-1F4 (IL-18) является представителем интерлейкинового семейства 1. IL-1F4 (IL-18), как и IL-1F2 (IL-1b), первоначально синтезируется в виде предшественника, который приобретает биологическую активность после каспаза-1-зависимого процессинга. Активная форма IL-1F4 (IL-18) оказывает мощное провоспалительное действие, в результате которого усиливается матурация NK-клеток, Т-лимфоцитов и индуцируется продукция цитокинов, хемокинов и молекул клеточной адгезии. В зависимости от цитокинового окружения IL-1F4 (IL-18) может активировать генерацию как Th1, так и Th2 клеток. Цитокин IL-1F4 (IL-18) является важнейшим фактором, определяющим как уровень активности, так и характер воспалительного процесса.
1. A complex of the IL-1 homologue IL-1F7b and IL-18-binding protein reduces IL-18 activity / P. Bufler, T. Azam, F. Gamboni-Robertson, L.L. Reznikov, S. Kumar, C.A. Dinarello, S.H. Kim // Proc. Natl. Acad. Sci. USA. — 2002. — Vol. 99, № 21. — P. 13723-13728.
2. A unique bivalent binding and inhibition mechanism by the yatapoxvirus interleukin 18 binding protein / B. Krumm, X. Meng, Z. Wang, Y. Xiang, J. Deng // PLoS Pathog. — 2012. — Vol. 8, № 8. — P. e1002876. doi: 10.1371/journal.ppat.1002876.
3. Alboni S., Cervia D., Sugama Sh., Conti B. Interleukin 18 in the CNS// J. Neuroinflammation. — 2010. — Vol. 7. — P. 9.
4. Blom L., Poulsen L.K. IL-1 family members IL-18 and IL-33 upregulate the inflammatory potential of differentiated human Th1 and Th2 cultures // J. Immunol. — 2012. — Vol. 189, № 9. — P. 4331-4337. doi: 10.4049/jimmunol.1103685.
5. Boraschi D., Dinarello C.A. IL-18 in autoimmunity: review // Eur. Cytokine. Netw. — 2006. — 17, № 4. — P. 224-252.
6. Chen Z.F., Zhou R., Xia B., Deng C.S. Interleukin-18 and -12 synergistically enhance cytotoxic functions of tumor-infiltrating lymphocytes // Chin. Med. J. (Engl). — 2012. — Vol. 125, № 23. – P. 4245-4248.
7. Cloning of a new cytokine that induces IFN-gamma production by T cells / H. Okamura, H. Tsutsui, T. Komatsu, M. Yutsudo, A. Hakura, T. Tanimoto, K. Torigoe, T. Okura, Y. Nukada, K. Hattori, K. Akita, M. Namba, F. Tanabe, K. Konishi, S. Fukuda, M. Kurimoto // Nature. — 1995. — Vol. 378, № 6552. — P. 88-91.
8. Cutting Edge: The NLRP3 Inflammasome Links Complement-Mediated Inflammation and IL-1Release / F. Laudisi, R. Spreafico, M. Evrard, T.R. Hughes, B. Mandriani, M. Kandasamy, B.P. Morgan, B. Sivasankar, A. Mortellaro // J. Immunol. — 2013. — Vol. 191, № 3. — P. 1006-1010. doi: 10.4049/jimmunol.1300489.
9. Dinarello C.A. Targeting interleukin 18 with interleukin 18 binding protein // Ann. Rheum. Dis. — 2000. — Vol. 59 (suppl I). — P. i17-i20.
10. Effects of interleukin-18 on natural killer cells: costimulation of activation through Fc receptors for immunoglobulin / S. Srivastava, D. Pelloso, H. Feng, L. Voiles, D. Lewis, Z. Haskova, M. Whitacre, S. Trulli, Y.J. Chen, J. Toso, Z.L. Jonak, H.C. Chang, M.J. Robertson // Cancer Immunol. Immunother. — 2013. — Vol. 62, № 6. — P. 1073-1082. doi: 10.1007/s00262-013-1403-0.
11. Endotoxin-induced serum factor that stimulates gamma interferon production / K. Nakamura, H. Okamura, M. Wada, K. Nagata, T. Tamura // Infect. Immun. — 1989. — Vol. 57, № 2. — P. 590-595.
12. Enhanced gamma interferon production through activation of Valpha14 (+) natural killer T cells by alpha-galactosylceramide in interleukin-18-deficient mice with systemic cryptococcosis / K. Kawakami, Y. Kinjo, S. Yara et al // Infect. Immun. — 2001. — Vol. 69, № 11. — P. 6643-6650.
13. Expression, purification and structural analysis of human IL-18 binding protein: a potent therapeutic molecule for allergy / T. Kimura, Z. Kato, H. Ohnishi, H. Tochio, M. Shirakawa, N. Kondo // Allergol. Int. — 2008. — Vol. 57, № 4. — P. 367-376. doi: 10.2332/allergolint.O-08-546.
14. Functional classification of interferon-stimulated genes identified using microarrays / M.J. de Veer, M. Holko, M. Frevel, E. Walker, S. Der, J.M. Paranjape, R.H. Silverman, B.R. Williams // J. Leukoc. Biol. — 2001. — Vol. 69, № 6. — P. 912-920.
15. Gene expression and production of the monokine induced by IFN-gamma (MIG), IFN-inducible T cell alpha chemoattractant (I-TAC), and IFN-gamma-inducible protein-10 (IP-10) chemokines by human neutrophils / S. Gasperini, M. Marchi, F. Calzetti, C. Laudanna, L. Vicentini, H. Olsen, M. Murphy, F. Liao, J. Farber, M.A. Cassatella // J. Immunol. — 1999. — Vol. 162, № 8. — P. 4928- 4937.
16. Gracie J.A., Robertson S.E., McInnes I.B. Interleukin-18 // J. Leukoc. Biol. — 2003 — Vol. 73, № 2. — P. 213-224.
17. Harris J. Autophagy and IL-1 Family Cytokines // Front Immunol. — 2013. — Vol. 4. — P. 83. doi: 10.3389/fimmu.2013.00083.
18. IFN-b-inducible protein-10 is essential for the generation of a protective tumor-specific CD8 T cell response induced by single-chain IL-12 gene therapy / U. Pertl, A.D. Luster, N.M. Varki, D. Homann, G. Gaedicke, R.A. Reisfeld, H.N. Lode // J. Immunol. — 2001. — Vol. 166, № 11. — P. 6944-6951.
19. IL-1beta processing in host defense: beyond the inflammasomes // M.G. Netea, A. Simon, F. van de Veerdonk, B.J. Kullberg, J.W. Van der Meer, L.A. Joosten // PLoS Pathog. — 2010. — Vol. 6, № 2. — P. e1000661. doi: 10.1371/journal.ppat.1000661.
20. Induction of interferon-gamma inducing factor in the adrenal cortex / B. Conti, J.W. Jahng, C. Tinti, J.H. Son, T.H. Joh // J. Biol. Chem. — 1997. — Vol. 272, № 4. — P. 2035-2037.
21. Interleukin 18: a pleiotropic participant in chronic inflammation / I.B. McInnes, J.A. Gracie, B.P. Leung, X.Q. Wei, F.Y. Liew // Immunol. Today. — 2000. — Vol. 21, № 7. — P. 312-315.
22. Interleukin-18 as an in vivo mediator of monocyte recruitment in rodent models of rheumatoid arthritis / J.H. Ruth, C.C. Park, M.A. Amin, C. Lesch, H. Marotte, S. Shahrara, A.E. Koch // Arthritis Res. Ther. — 2010. — Vol.12, № 3. — P. R118.
23. Manry J., Quintana-Murci L. Génétique des populations et immunité chez l’homme: Le cas des interférons // Med. Sci. (Paris). — 2012. — Vol. 28, № 12. — P. 1095-1101. doi: 10.1051/medsci/20122812020
24. Nakanishi K., Tsutsui H., Yoshimoto T. Importance of IL-18-induced super Th1 cells for the development of allergic inflammation // Allergol. Int. — 2010. — Vol. 59, №2. — P. 137-141. doi: 10.2332/allergolint.10-RAI-0208.
25. Neumann D., Martin M.U. Interleukin-12 upregulates the IL-18Rb chain in BALB/c thymocytes // J. Interferon. Cytokine Res. — 2001. — Vol. 21, № 8. — P. 635–642.
26. Neutrophil proteinase 3-mediated induction of bioactive IL-18 secretion by human oral epithelial cells / S. Sugawara, A. Uehara, T. Nochi, T. Yamaguchi, H. Ueda, A. Sugiyama, K. Hanzawa, K. Kumagai, H. Okamura, H. Takada // J. Immunol. — 2001. — Vol. 167, № 11. — P. 6568-6575.
27. O’Neill L.A., Dinarello C.A. The IL-1 receptor/toll-like receptor superfamily: crucial receptors for inflammation and host defense // Immunol. Today. — 2000. — Vol. 21, № 5. — P. 206-209.
28. Plantinga T.S., Joosten L.A., Netea M.G. Assessment of inflammasome activation in primary human immune cells // Methods Mol. Biol. — 2013. — Vol. 1040. — P. 29-39. doi: 10.1007/978-1-62703-523-1_4.
29. Prevention of Th2-like cell responses by coadministration of IL-12 and IL-18 is associated with inhibition of antigen-induced airway hyperresponsiveness, eosinophilia, and serum IgE levels / C.L. Hofstra, I. Van Ark, G. Hofman, M. Kool, F.P. Nijkamp, A.J. Van Oosterhout // J. Immunol. — 1998. — Vol. 161, № 9. — P. 5054-5060.
30. Smith D.E. The biological paths of IL-1 family members IL-18 and IL-33 // J. Leukoc. Biol. — 2011. — Vol. 89, № 3. — P. 383-392. doi: 10.1189/jlb.0810470.
31. Srivastava S., Salim N., Robertson M.J. Interleukin-18: Biology and Role in the Immunotherapy of Cancer // Curr. Med. Chem. — 2010. — Vol. 17, № 29. — P. 3353-3357.
32. Structural requirements of six naturally occurring isoforms of the IL-18 binding protein to inhibit IL-18 // S.H. Kim, M. Eisenstein, L. Reznikov, G. Fantuzzi, D. Novick, M. Rubinstein, C.A. Dinarello // Proc. Natl. Acad. Sci. USA. — 2000. — Vol. 97, № 3. — P. 1190-1195.
33. The role of interleukin-1 and interleukin-18 in pro-inflammatory and anti-viral responses to rhinovirus in primary bronchial epithelial cells / S.C. Piper, J. Ferguson, L. Kay, L.C. Parker, I. Sabroe, M.A. Sleeman, E. Briend, D.K. Finch // PLoS One. — 2013. — Vol. 8, № 5. — P. e63365. doi: 10.1371/journal.pone.0063365.
34. The structure and binding mode of interleukin-18 / Z. Kato, J. Jee, H. Shikano, I. Ohki, H. Ohnishi, A. Li, K. Hashimoto, E. Matsukuma, K. Omoya, Y. Yamamoto, T. Yoneda, T. Hara, N. Kondo, M. Shirakawa // Nat. Struct. Biol. — 2003. — Vol. 10, № 11. — P. 966-971.
35. Wong J.L., Berk E., Edwards R.P., Kalinski P. IL-18-Primed Helper NK Cells Collaborate with Dendritic Cells to Promote Recruitment of Effector CD8+ T Cells to the Tumor Microenvironment // Cancer Res. — 2013, Jul 25.
36. Yoshimoto T., Nakanishi K. Roles of IL-18 in basophils and mast cells // Allergol. Int. — 2006. — Vol. 55. — № 2. — P. 105-113.

/136/136.jpg)
/137/137.jpg)