Международный эндокринологический журнал 4 (60) 2014
Вернуться к номеру
Лечение аналогами глюкагоноподобного пептида-1 — прорыв в терапии сахарного диабета 2-го типа
Авторы: Орленко В.Л., Зак К.П. - ГУ «Институт эндокринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины», г. Киев
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
В статье проанализированы данные современной научной литературы относительно нового класса препаратов, воссоздающих эффект глюкагоноподобного пептида-1 (ГПП-1). Согласно современным представлениям, патофизиологические механизмы лечебного действия аналогов ГПП-1 у пациентов с сахарным диабетом (СД) 2-го типа прежде всего обусловлены их благоприятным действием на дисфункцию β-клеток, роль которой в патогенезе СД 2-го типа до недавнего времени недооценивалась. Главной мишенью ГПП-1 являются панкреатические островки, где он глюкозозависимо стимулирует продукцию и секрецию инсулина и соматостатина и ингибирует секрецию глюкагона. Кроме того, ГПП-1 препятствует деструкции β-клеток и стимулирует их пролиферацию, увеличивая их количество. В статье приведены данные основных многоцентровых исследований аналогов человеческого ГПП-1, проанализированы сахароснижающая эффективность инкретинов и другие их положительные эффекты.
У статті проаналізовано дані сучасної наукової літератури щодо нового класу препаратів, що відтворюють ефект глюкагоноподібного пептиду-1 (ГПП-1). Відповідно до сучасних уявлень, патофізіологічні механізми лікувальної дії аналогів ГПП-1 у пацієнтів із цукровим діабетом (ЦД) 2-го типу передусім обумовлені їх сприятливою дією на дисфункцію β-клітин, роль якої в патогенезі ЦД 2-го типу донедавна недооцінювалася. Головною мішенню ГПП-1 є панкреатичні острівці, де він глюкозозалежно стимулює продукцію та секрецію інсуліну і соматостатину та інгібує секрецію глюкагону. Крім того, ГПП-1 перешкоджає деструкції β-клітин і стимулює їх проліферацію, збільшуючи їх кількість. У статті наведено дані основних багатоцентрових досліджень аналогів людського ГПП-1, проаналізовано цукрознижувальну ефективність інкретинів та інші їх позитивні ефекти.
The paper analyzes the data of modern scientific literature on the new class of drugs that restore the effect of glucagon-like peptide-1 (GLP-1). According to modern concepts, the pathophysio-logical mechanisms of therapeutic action of GLP-1 analogues in patients with diabetes mellitus (DM) type 2 primarily due to their bene-ficial effects on β-cell dysfunction, whose role in the pathogenesis of DM type 2 until recently been underestimated. The main targets of GLP-1 are pancreatic islets, where it glucose-dependently stimulates production and secretion of insulin and somatostatin secretion and inhibits glucagon secretion. Furthermore, GLP-1 inhibits β-cell destruction and stimulates their proliferation, increasing their number. The article presents information on the main multicenter studies on analogues of human GLP-1, analyzes hypoglycemic effectiveness of incretins and others of their positive effects.
сахарный диабет, глюкагон, инсулин, инкретины, глюкагоноподобный пептид.
цукровий діабет, глюкагон, інсулін, інкретини, глюкагоноподібний пептид.
diabetes mellitus, glucagon, insulin, incretins, glucagon-like peptide-1.
Статья опубликована на с. 112-117
Открытие инсулина и использование его для лечения сахарного диабета (СД) 1-го и 2-го типов являются величайшим достижением человечества, спасшим жизнь миллионам людей. За последнее столетие были затрачены огромные усилия для получения различных высокоактивных препаратов инсулина, разработаны методы рациональной прецизионной инсулинотерапии вплоть до автоматического компьютерного регулирования содержания инсулина в крови больного в течение суток, аналогичного естественному. Вместе с тем известно, что не у всех больных СД с помощью инсулина удается полностью нормализовать все звенья метаболизма и иммунитета, т.е. приблизить их к уровню здорового человека и, следовательно, уберечь больного от неизбежных сердечно-сосудистых и других осложнений. Это объясняется тем, что в поддержании обмена веществ и иммунитета в организме, кроме инсулина, принимает участие и ряд других гормонов и гормоноподобных соединений. Так, в последнее время стало известно, что в панкреатических островках Лангерганса, а также в L- и К-клетках кишечника вырабатываются другие жизненно важные биологически активные соединения, контролирующие уровень глюкозы, липидов и других веществ в крови. Было доказано, что у больных с СД, наряду с нарушением секреции инсулина, в значительной степени изменена также продукция глюкагона и гормонов инкретинового ряда, в особенности глюкагоноподобных пептидов.
Значительной вехой в лечении больных СД, особенно 2-го типа, стало возникновение и развитие принципиально нового направления в диабетологии — инкретинотерапии, т.е. создание и использование в клинической практике препаратов, воссоздающих эффект глюкагоноподобного пептида-1 (ГПП-1) [1].
Хорошо известно, что глюкагон, наряду с инсулином, является жизненно важным гормоном, который участвует в регуляции многих физиологических процессов в организме, и прежде всего в поддержании углеводного и жирового обменов. Глюкагон продуцируется альфа-клетками островков Лангерганса поджелудочной железы. Наряду с рядом других биологически значимых полипептидов глюкагон образуется из более крупного пептида — преглюкагона, который кодируется геном проглюкагона, расположенным у человека в хромосоме 2. В панкреатических L-клетках и L-клетках тонкого кишечника проглюкагон расщепляется прогормонконвертазой-1/3 на глюкагон и ряд других пептидов [2].
Глюкагон — одноцепочечный полипептид, состоящий из 29 аминокислот. Его молекулярная масса равна 3,4 кДа. У здорового человека средняя концентрация иммунореактивного глюкагона в плазме составляет 75 пг/мл. На долю собственно панкреатического глюкагона приходится более 30–40 % этого количества. Период полужизни глюкагона в крови равен 3–6 мин. Он элиминируется из крови главным образом печенью и почками.
Секрецию глюкагона ингибирует глюкоза. Пока не ясно, воздействует ли она непосредственно на b-клетки или через повышение продукции инсулина и соматостатина, которые затем прямо ингибируют b-клетки. Повышение секреции глюкагона вызывают также многие аминокислоты, хотя и в разной степени. Аргинин, например, повышает образование как глюкагона, так и инсулина, аланин стимулирует главным образом секрецию глюкагона, а лейцин — мощный стимулятор инсулина — вовсе не влияет на секрецию глюкагона. К веществам, стимулирующим секрецию глюкагона, относят также катехоламин и глюкокортикоиды.
В отличие от инсулина, который способствует запасанию энергии в разных тканях, глюкагон обеспечивает ткани энергией между приемами пищи. От соотношения инсулин/глюкагон зависит активность ключевых ферментов обмена веществ, особенно формирование и расходование запасов питательных веществ.
Главным органом-мишенью глюкагона является печень. Сигналы из печени реализуются через глюкагоновые рецепторы, сопряженные с G-белками. Наибольшее их количество расположено на поверхности гепатоцитов. Связывание с этими рецепторами активизирует аденилатциклазу и продукцию циклического аденозинмонофосфата, что, в свою очередь, стимулирует распад гликогена, образование глюкозы из аминокислот-предшественников (глюконеогенез) и кетоновых тел из жирных кислот (кетогенез). В результате этого продукция печенью источников энергии (глюкозы и кетоновых тел) возрастает. Гиперглюкагонемия натощак является ранним патогенетическим нарушением у больных СД 2-го типа. Недавно было показано, что у молодых пациентов с ожирением, инсулинорезистентностью и нарушением толерантности к глюкозе имеется выраженная гиперглюкагонемия натощак. Эти данные свидетельствуют о раннем дефекте регуляции a- и b-клеток поджелудочной железы, который предшествует нарушению метаболизма глюкозы, и, возможно, в будущем будут разработаны препараты, препятствующие развитию этого дефекта.
Особое внимание диабетологов сейчас приковано к родственным глюкагону пептидным гормонам — инкретинам, получившим свое название от латинского increscere, что означает «повышать» и отображает их мощный инсулинотропный эффект. В L-клетках тонкой кишки из проглюкагона под действием прогормонконвертазы-1/3 образуется целый набор пептидов: глицетин, полипептид, родственный глицетину, и два глюкагоноподобных пептида — ГПП-1 и ГПП-2. Последний принадлежит к ключевым регуляторам роста клеток тонкого кишечника, участвуя в метаболизме питательных веществ.
ГПП–1 является важным инкретиновым гормоном и обладает широким физиологическим действием. Он секретируется L-клетками в ответ на прием пищи и связывается со своими рецепторами, сходными с рецепторами глюкагона. В крови ГПП-1 быстро инактивируется (t1/2 < 2 минут) вездесущей, находящейся почти во всех тканях дипептидилпептидазой-4 (ДПП-4).
Согласно современным представлениям, патофизиологические механизмы лечебного действия аналогов ГПП-1 при СД 2-го типа прежде всего обусловлены их благоприятным действием на дисфункцию b-клетки, роль которой в патогенезе СД 2-го типа до недавнего времени недооценивалась.
Главной мишенью ГПП-1 являются панкреатические островки, где он глюкозозависимо стимулирует продукцию и секрецию инсулина и соматостатина [3] и ингибирует секрецию глюкагона. Кроме того, ГПП–1
препятствует деструкции b-клеток и стимулирует их пролиферацию, увеличивая массу b-клетки [4]. К другим органам-мишеням ГПП-1 относятся желудок (ГПП-1 тормозит его опорожнение и ингибирует секрецию соляной кислоты), головной мозг (ГПП-1
угнетает аппетит, приводя к снижению веса).
ГПП-1 и его аналоги полипотентны и многосистемны, так как рецепторы к ним имеются практически во всех тканях. Кроме благоприятного воздействия на дисфункцию островков Лангерганса, они обладают и внепанкреатическим действием. Так, их мишенью является и ЦНС. За счет экспрессии ГПП-1 в стволе мозга и гипоталамусе они участвуют в регуляции аппетита и потребления пищи, способствуют похудению. Благоприятный эффект они оказывают и на сердечно-сосудистую систему. Показано, что такое действие обусловлено не только нормализацией уровня глюкозы крови и уменьшением массы жировой ткани, но и другими механизмами, независимыми от гипергликемии. Они снижают кровяное давление, уменьшают гипоксию, улучшают функцию миокарда.
При приеме пищи одновременно с ГПП-1 секретируется и ГПП-2. ГПП-2 взаимодействует с рецепторами, которые также очень похожи на рецепторы глюкагона, и также инактивируется ДПП-4. Главной мишенью ГПП-2
является, по-видимому, кишечник, где он стимулирует рост слизистой и всасывание питательных веществ, одновременно угнетая перистальтику.
В последние годы фармацевтическая промышленность выпустила целый ряд препаратов, обладающих высоким терапевтическим эффектом при СД 2-го типа, действие которых основано на инкретиновом эффекте.
Существует три различных вида лечебных препаратов ГПП-1:
1. Различные аналоги человеческого ГПП-1.
2. Агонисты рецепторов ГПП-1 (а-ГПП-1Р).
3. Ингибиторы фермента ДПП-4 (и-ДПП-4).
Среди этих препаратов ГПП-1 наиболее активным действием обладают аналоги человеческого ГПП-1, к которым относятся Liraglutide, Semaglutide, Albiglutide и Dulaglutide. Liraglutide (виктоза) — единственный аналог человеческого ГПП-1 суточного действия, разрешенный к применению с 2009 года. Semaglutide, Albiglutide и Dulaglutide — аналоги человеческого ГПП-1 продленного действия (для введения 1 раз в неделю) — находятся на стадии клинических испытаний.
Уже первоначальные испытания, проведенные по всем правилам доказательной медицины, показали, что эти препараты, хотя и имеют различия в химическом строении, фармакодинамике, степени активности и продолжительности действия, безопасны и хорошо переносятся. Они обладают выраженным гипогликемическим действием (снижение уровня HbA1c). Кроме того, в отличие от инсулинов и других сахароснижающих средств, они не вызывают гипогликемии, снижают массу тела, обладают кардиопротективным действием.
Среди аналогов человеческого ГПП-1 особо выделяется препарат Liraglutide (Victoza/виктоза), производимый компанией Novo Nordisk, в молекуле которого одна из аминокислот заменена (Lys в положении 34 на Arg) и посредством глютамина боковой цепью присоединена пальмитиновая кислота (С-16). Эти изменения молекулы приводят к замедленной абсорбции препарата из подкожной жировой ткани, обратимому связыванию с альбумином и устойчивости к дезактивации ферментом ДПП-4. Однократная инъекция Liraglutide создает максимальное его повышение в крови в течение 8–12 часов после введения, а период его полувыведения составляет приблизительно 13 часов.
В слепых рандомизированных исследованиях с использованием плацебо, с участием большого количества больных СД 2-го типа было показано, что Liraglutide приводит к значительному снижению уровня HbAlc, нормализуя уровень глюкозы в крови, снижает избыточный вес пациента, а также препятствует развитию гипогликемии, нередко наблюдаемой при терапии производными сульфонилмочевины и инсулинами [5, 6]. Сообщается также, что Liraglutide улучшает липидный обмен [7], снижает артериальное давление [8] и обладает кардиопротективными свойствами [9–11]. Сравнительные исследования показали, что аналог человеческого ГПП-1 Liraglutide эффективнее агонистов рецепторов ГПП-1 (инкретиномиметики) [12, 13].
В 6-месячном рандомизированном двойном слепом исследовании добавление Liraglutide к предшествующей терапии пероральными сахароснижающими препаратами обеспечило большее снижение уровня HbAlc по сравнению с инсулином glargine при равном уровне гликемии натощак. Применение Liraglutide привело к снижению массы тела, а назначение инсулина glargine — к ее увеличению; различие между группами превысило 3 кг [14].
В настоящее время проводятся поиск и испытание новых препаратов — аналогов человеческого ГПП-1, обладающих большей устойчивостью к разрушаемому действию эндогенного ДПП-4, что позволяет их применять в режиме один раз в неделю.
Так, компания Novo Nordisk проводит клинические испытания третьей фазы высокоактивного аналога человеческого ГПП-1, обладающего ультрапролонгированным действием, — Semaglutide. Semaglutide представляет собой уникальный ацетилированный ГПП-1 с временем полужизни 160 часов. 12-недельное рандомизированное двойное слепое сравнительное испытание с плацебо и Liraglutide с участием 411 больных СД 2-го типа доказало, что Semaglutide безопасен и хорошо переносится. Применение Semaglutide в дозе 0,8 мг 1 раз в неделю в течение 12 недель показало эффективное действие, превышающее Liraglutide по снижению HbA1c (на 1,7 %) и массы тела (на 4,8 кг) [15].
В отличие от аналогов человеческого ГПП–1 строение молекулы препаратов агонистов рецепторов ГПП-1
(а-ГПП-1Р) или инкретиномиметиков (Exenatide, Exenatide-LАR и Lixsenatide) значительно отличается от естественного пептида (схожесть не более 53 %). Благодаря такой модификации а-ГПП-1Р не подвергаются нейтрализующему действию фермента ДПП-4. Среди а-ГПП-1Р
выделяют препараты короткого действия (Exenatide/Bayetta и Lixisenatide/Lyxumia), которые вводят 1–2 раза в день, и препарат длительного действия (Exenatide-LАR/Bydureon) для введения 1 раз в неделю. Как и аналоги человеческого ГПП-1, эти препараты обладают выраженным лечебным действием (снижают уровень HbA1c, улучшают гликемический контроль и уменьшают массу тела), однако по эффективности они уступают аналогам ГПП-1. Снижение постпрандиальной гликемии под влиянием а-ГПП-1Р короткого действия обусловлено в первую очередь замедлением эвакуации пищи из желудка, что обусловливает замедление поступления глюкозы в двенадцатиперстную кишку и, соответственно, в кровоток [16]. Именно поэтому данные препараты вводят в строго определенное время перед приемом пищи.
Многоцентровое 2,5-летнее сравнительное рандомизированное исследование а–ГПП–1Р длительного действия Exenatide-LАR с инсулином glargine (в режиме точно титрированных доз) показало, что Exenatide-LАR одновременно со снижением уровня HbA1c и массы тела способствует нормализации показателей сердечно-сосудистого риска (АД, липопротеины низкой плотности, липопротеины высокой плотности, триглицериды и С-реактивный белок) [17].
В последние годы для более продолжительного действия собственного ГПП-1 у больных СД 2-го типа стали применять препараты ингибиторов фермента ДПП-4 (Linagliptin, Sitagliptin, Saxagliptin, Vildagliptin и др.). Как уже нами упоминалось, время полужизни эндогенного ГПП-1 в крови человека очень ограниченное (3–6 минут) ввиду его разрушения ферментом ДПП-4. Поэтому идея использования блокатора ДПП-4 открыла дополнительную возможность в терапии СД 2-го типа. ДПП-4 препятствует разрушению ГПП-1, вызывая повышение его уровня, который не превышает пределы физиологических колебаний (10–25 пкг/моль/л), чего недостаточно для полного лечебного эффекта, который наблюдается при использовании фармакологических доз ГПП-1.
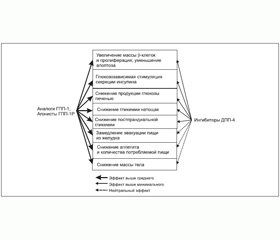
Многоцентровые проспективные исследования показали безопасность и толерантность этих препаратов, вызывающих длительную циркуляцию собственного природного ГПП-1 в крови, что обеспечивает стимуляцию секреции инсулина b-клетками (рис. 1).
Было установлено, что при применении блокаторов ДПП-4 происходит достоверное снижение уровня HbA1c и глюкозы в крови с низким риском развития гипогликемии, но нейтральным влиянием на аппетит и массу тела, что, по-видимому, объясняется недостаточно высокой концентрацией ГПП-1 в периферической крови [18, 19].
В проспективном слепом испытании одного из препаратов — ингибиторов ДПП-4 — линаглиптина длительностью 52 недели с участием 1261 больного СД 2-го типа, плохо поддающихся лечению инсулином (glargine) и разделенных на 2 подгруппы — получающих только Linagliptin или только плацебо, показаны достоверное снижение уровня HbA1c и лучший контроль гликемии в первой подгруппе по сравнению со второй подгруппой [18].
Отличия аналогов ГПП-1 и а-ГПП-1Р от ингибиторов ДПП-4 обусловлены тем, что первые создают фармакологический уровень ГПП-1 в организме, в то время как ингибиторы ДПП-4 препятствуют разрушению эндогенного ГПП-1, что обусловливает более низкий уровень ГПП-1 в крови и, соответственно, более низкую эффективность препаратов (рис. 1) [20]. Так, по данным метаанализа всех клинических исследований препаратов группы инкретинов, средний уровень снижения HbA1c при применении аналогов ГПП-1 и а-ГПП-1Р составил ~ 1 %, а ингибиторов ДПП-4 — от 0,6 до 0,8 % [21]. При прямом сравнении применения Liraglutide и Sitagliptin также была доказана большая эффективность аналога ГПП-1 в отношении снижения HbA1c, постпрандиальной гликемии и веса, а в перекрестных исследованиях (чередование применения исследуемых препаратов у одного и того же пациента) уровень С–пептида натощак, соотношение «проинсулин : инсулин» и индекс HOMA-B были выше у пациентов при применении Liraglutide, нежели во время использования Sitagliptin [22].
Как видно из вышеизложенного, почти во всех цитируемых работах, посвященных исследованию действия препаратов группы инкретинов (аналогов ГПП-1 и а-ГПП-1Р), у больных СД 2-го типа отмечается значительное снижение или, по крайней мере, нейтральное влияние на массу тела (ингибиторы ДПП–4), а, как известно, около 80 % больных СД 2–го типа страдают от ожирения [23, 24].
Вопрос об ассоциации ГПП-1 и ожирения имеет очень важное практическое и теоретическое значение. Согласно современным представлениям, ожирение рассматривается как один из видов системного хронического низкоградиентного (low-grade) воспаления, играющего кардинальную роль в патогенезе СД 2-го типа и отягощающего его течение [25]. В связи с этим, естественно, возникает вопрос: не обусловлен ли хотя бы частично механизм лечебного действия аналогов ГПП-1, а-ГПП-1Р и и-ДПП-4 их воздействием на воспалительный процесс, протекающий в жировой ткани? В пользу такого предположения говорят работы, в которых сообщается, что при их применении происходят активация дифференциации адипоцитов [25] и повышение уровня антивоспалительных антидиабетических цитокинов (ИЛ-1Раг и адипонектина) при снижении уровня воспалительных цитокинов (ИЛ-1, ИЛ-6, ФНО-a и др.) [6]. В связи с этим интересно отметить, что механизм лечебного действия таких сахароснижающих препаратов, как метформин и полиглитазон, при СД 2-го типа сейчас также объясняется их противовоспалительным свойством, так как приводит к снижению уровня провоспалительных цитокинов и повышению антивоспалительных цитокинов, основных маркеров низкоградиентного воспаления, лежащего в основе как ожирения, так и СД 2-го типа [24, 25].
Положительным эффектом терапии аналогами ГПП-1 является, по данным ряда авторов [26], также то, что они значительно снижают риск развития сердечно-сосудистых осложнений, которые, как известно, приводят к смертельному исходу у 80 % больных СД 2-го типа [27].
Препараты группы инкретинов в терапии СД используют как самостоятельно, так и как адъюванты (совместно) при инсулинотерапии или при применении других пероральных сахароснижающих средств — метформина, сульфонилмочевины и глитазонов, особенно при их недостаточной эффективности [13].
Так как в эксперименте было убедительно показано, что аналоги ГПП-1 оказывают положительное действие на панкреатические b-клетки, увеличивая их массу путем повышения пролиферации, и усиливают секрецию инсулина, это позволило предположить их эффективность в лечении СД 1-го типа [28, 29]. При клиническом испытании Liraglutide у больных СД 1-го типа с резидуальной функцией b-клетки было обнаружено, что его использование позволяет значительно уменьшить дозу вводимого инсулина. При этом наблюдается снижение уровня HbA1c и улучшается контроль гликемии [30]. В дальнейшем было показано, что применение Liraglutide эффективно как у больных с резидуальной функцией b-клетки, так и у пациентов с полным ее отсутствием. Такое действие препарата может быть обусловлено как восстановлением функции b-клетки, так и подавлением секреции глюкагона и снижением продукции глюкозы печенью. Подобный положительный фармакологический эффект Liraglutide, а также его безопасность и толерантность при использовании как адъюванта инсулинотерапии были подтверждены и другими авторами [31, 32].
Уменьшение ежедневной дозы инсулина, снижение уровня глюкозы в крови и показателя HbA1c у больных СД 1-го типа описаны и в случаях воздействия ингибитора ДПП-4 Sitagliptin [33].
Таким образом, подытоживая все изложенное, можно прийти к заключению, что появление принципиально нового класса лекарственных препаратов — инкретинов открыло новые возможности в лечении СД и предупреждении развития его осложнений, в том числе случаев, устойчивых к действию инсулинотерапии и других сахароснижающих средств. Достоверно показано, что они безопасны и толерантны, приводят к снижению содержания глюкозы и HbA1c в крови, улучшают гликемический контроль, не способствуют развитию гипогликемии и снижают или оказывают нейтральное воздействие на избыточный вес пациентов, являющийся одним из важнейших осложнений СД 2-го типа. При выборе препарата группы инкретинов (аналоги ГПП-1, а-ГПП-1Р или ингибиторы ДПП-4) необходимо учитывать различие в их эффективности по снижению уровня HbA1c и нормализации гликемии, а также возможности влияния на массу тела. Естественно, в понимании механизмов лечебного действия инкретинов при СД 2-го типа мы находимся только в начале пути. Впереди нас ждет много сюрпризов и неожиданностей.
1. Buse J., Rosenstock J., Sesti G. et al. Liraglutide once a day versus exenatide twice a day for type 2 diabetes: a 26-week randomised, parallel-group, multinational, open-label trial (LEAD-6) // Lancet. — 2009. — V. 374. — P. 39–47.
2. Гарднер Д., Шобек Д. Базисная и клиническая эндокринология (книга первая). — Москва: Бином, 2010. — С. 264–266.
3. Leight S., Eicklmann P., Mayet S. Regulation of peptide hormone release from neuroendocrine cells in the gut at the pancreas // Diabetologia. — 2007. — Vol. 50, suppl. 1. — P. 694.
4. Joanny G., Tellez N., Estiles E. et al. Increased beta cells replication and mass in 95% pancreatectomized rats treated with a DPPIV stabilized GLP-1 analogue // Diabetologia. — 2007. — Vol. 50, suppl. 1. — 0690.
5. Buse J., Nauck M.A., Forst T. Efficacy and safety of exenatide once weekly versus liraglutide in subjects with type 2 diabetes (DURATION-6): a randomization, open-label study // Diabetologia. — 2011. — Vol. 54, suppl. 1. — 75.
6. Zhang Z., Yang G., Li L. The effect of liraglutide on metabolism in Apo-/-mice with RNAi-mediated adiponectin gene inhibition // Diabetologia. — 2010. — Vol. 1, suppl. 1. — 636.
7. Miao Z., Li L., Yang G. Liraglutide attenuated hypoadiponectinaemia-induced deterioration in peripheral and hepatic insulin sensitivity and alterations of gene expression in glucose and lipid metabolism // Diabetologia. — 2011. — Vol. 54, suppl. 1. — 515.
8. Nauck M., Pratley R. et al. Adding Liraglutide to Existing Therapy ratherthan Substituting it for Existing Therapy Produces Greater Improvement in Glycemic Control: Evidence from a Meta-analysis // 69th ADA Scientific Sessions Abstract Book. — 2009. — Poster 549.
9. Sokos G.G., Nikolaidis L.A., Mankad S. et al. Glucagon-Like Peptide-1 Infusion Improves Left Ventricular Ejection Fraction and Functional Status in Patients With Chronic Heart Failure // Journal of Cardiac Failure. — 2006. — Vol. 12. — P. 694–699.
10. Mazzone T., Chait A., Plutzky J. Cardiovascular disease risk in type 2 diabetes mellitus // Lancet. — 2008. — Vol. 24. — P. 1800–1809.
11. Lorber D. GLP-1 Receptor Agonists: Effects on Cardiovascular Risk Reduction // Cardiovascular Therapeutics. — 2013. — Vol. 31(4). — P. 238–249.
12. Matthews D.R., Dejager S., Ahren B. et al. Vildagliptin add-on to metformin produces similar efficacy and reduced hypoglycaemic risk compared with glimepiride, with no weight gain: results from a 2-year study // Diab. Obes. Metab. — 2010. — V. 12. — P. 780–789.
13. Zinman B. et al. Insulin degludec, an ultra-long-acting basal insulin, once a day or three times a week versus insulin glargine once a day in patients with type 2 diabetes: a 16-week, randomised, open-label, phase 2 trial // Lancet. — 2011. — V. 377. — P. 924–931.
14. Russell-Jones D. Current developments in the treatment of diabetes: the incretin therapies // British Journal of Diabetes. — 2010. — Vol. 10. — P. 21–30.
15. Nauck M., Petrie G., Sesti G. et al. The once-weekly human GLP-1 analogue semaglutide provides significant reductions in HbA1c and body weight in patients with type 2 diabetes // Diabetologia. — 2012. — Vol. 55, suppl. 1. — 2.
16. Meier J.J. GLP-1 receptor agonists for individualized treatment of type 2 diabetes mellitus // Nat. Rev. Endocrinol. — 2012. — V. 8(12). — P. 728–42.
17. Diamant M., Gaal L.V., Stranks S. Safety and efficacy of once-weekly Exenatide compared with insulin Glargine titrated to Target in patients with Type 2 Diabetes over 84 weeks // Diabetes Care. — 2012. — V. 35. — P. 683–689.
18. Yki-Järvinen H., Rosenstock J., Durán-Garcia S. et al. Effects of adding linagliptin to basal insulin regimen for inadequately controlled type 2 diabetes: a ≥ 52-week randomized, double-blind study // Diabetes Care. — 2013. — V. 36(12). — P. 3875–3881.
19. Ahrén B., Dimas A.L., Miossec P. et al. Efficacy and safety of lixisenatide once–daily morning or evening injections in type 2 diabetes inadequately controlled on metformin (GetGoal-M) // Diabetes Care. — 2013. — doi: 10.2337/dc12–2006.
20. Cornell S., Dorsey V.J. Diabetes pharmacotherapy in 2012: considerations in medication selection // Postgrad Med. — 2012. — V. 124(4). — P. 84–94.
21. Umpierrez G.E., Meneghini L. Reshaping diabetes care: the fundamental role of dipeptidyl peptidase-4 inhibitors and glucagon-like peptide-1 receptor agonists in clinical practice // Endocr. Pract. — 2013. — V. 19(4). — P. 718–728.
22. Aroda V.R., Henry R.R., Han J. et al. Efficacy of GLP-1 receptor agonists and DPP-4 inhibitors: meta-analysis and systematic review // Clin. Ther. — 2012. — V. 34(6). — P. 1247–1258.
23. Lichiardopol R., Florentiu A., Radoi V. Body composition and the metabolic impact of weight excess in patients with type 1 and type 2 diabetes mellitus // Acta Endocr. (Buc). — 2010. — V. 6(4). — P. 493-506.
24. Grunberger G. Clinical utility of the dipeptidyl peptidase-4 inhibitor linagliptin // Postgrad Med. — 2013. — V. 125(3). — P. 79–90.
25. Зак К.П., Маньковский Б.Н., Мельниченко С.В. и др. Иммунитет больных сахарным диабетом 2-го типа с сопутствующим метаболическим синдромом/ожирением. Сообщение 2. Роль адипоцитов (интерлейкина-6, фактора некроза опухолей альфа, лептина, адипонектина) // Эндокринология. — 2013. — № 1. — С. 65–78.
26. Lewin A., Arvay L., Liu D. et al. Efficacy and tolerability of linagliptin added to a sulfonylurea regimen in patients with inadequately controlled type 2 diabetes mellitus: an 18-week, multicenter, randomized, double–blind, placebo–controlled trial // Clin. Ther. — 2012. — V. 34(9). — P. 1909–1919.
27. Forst T., Lübben G., Hohberg C. Influence of glucose control and improvement of insulin resistance on microvascular blood flow and endothelial function in patients with diabetes mellitus type 2 // Microcirculation. — 2005. — 12(7). — P. 543–50.
28. Fernández-Real J.M., Pickup J.C. Innate immunity, insulin resistance and type 2 diabetes // Diabetologia. — 2012. — V. 55. — P.273–238.
29. Harrison L.B., Mora P.F., Clark G.O., Lingvay I. Type 1 diabetes treatment beyond insulin: role of GLP-1 analogs // J. Investig. Med. — 2013. — V. 61. — P. 40–44.
30. Heller S.R. et al. Liraglutide Is a Safe and Beneficial Adjunct to Insulin in Glycemic Control in Type 1 Diabetes-Diabetologia // EASD. — 2013. — abstr. 3; NCT01536665.
31. Kielgast U., Holst J.J., Madsbad S. Treatment of type 1 diabetic patients with glucagon-like peptide-1 (GLP-1) and GLP-1R agonists // Curr. Diabetes Rev. — 2009. — V. 5(4). — P. 266–275.
32. Klonoff D.C., Buse J.B., Nielsen L.L. et al. Exenatide effects on diabetes, obesity, cardiovascular risk factors and hepatic biomarkers in patients with type 2 diabetes treated for at least 3 years // Curr. Med. Res. Opin. — 2008. — V. 24. — P. 275–286.
33. Pratley А. et al. Liraglutide compared to sitagliptin, both in combination with metformin, in subjects with type 2 diabetes: a 26-week, randomised, parallel-group, open-label trial // Lancet. — 2010. — 375. — Р. 1447–1456.

/115/115.jpg)