Журнал «Травма» Том 15, №4, 2014
Вернуться к номеру
Влияние кальцитонина на репаративную регенерацию костной ткани
Авторы: Поворознюк В.В. - ГУ «Институт геронтологии им. Д.Ф. Чеботарева НАМН Украины», г. Киев; Дедух Н.В. - ГУ «Институт патологии позвоночника и суставов им. проф. М.И. Ситенко НАМН Украины», г. Харьков; Макогончук А.В. - Винницкий национальный медицинский университет им. Н.И. Пирогова
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Исследование проведено на 60 половозрелых самках крыс линии Vistar в возрасте 6 мес. Всем животным под ингаляционным эфирным наркозом был выполнен дырчатый дефект дистального метаэпифиза бедренной кости. Животные были разделены на 3 группы, по 20 животных в каждой: группа А — животные, которым кальцитонин назначался со 2-х суток после операции; группа В — животные, которым кальцитонин назначался с 5-х суток после операции; группа С — контроль, без назначения препарата. Животным групп А и В подкожно вводился кальцитонин в дозе 10 мкг/кг/сут. Из эксперимента животные выводились на 3-и, 7, 14 и 28-е сутки (по 5 животных в каждой подгруппе) путем передозировки эфира. Взятый материал подвергали гистологическому исследованию.
В ходе исследования выяснилось, что лечение кальцитонином животных с травматическим повреждением бедренной кости в метафизарной области на стадии репаративного остеогенеза, охватывающей воспалительный процесс (группа А), неэффективно. Имеет место замедление перестройки отломков материнской кости и снижение репаративного потенциала. Более оптимистический прогноз может быть сделан после введения препарата на стадии пролиферации (группа В), дифференцировки клеток и начала формирования тканевых структур. На 28-е сутки в области травматического повреждения наблюдалась сформированная пластинчатая костная ткань с более высокой плотностью клеточных элементов, чем в группе А и контрольной группе.
Дослідження проведене на 60 статевозрілих самках щурів лінії Vistar віком 6 міс. Усім тваринам під інгаляційним ефірним наркозом був виконаний дірчастий дефект дистального метаепіфізу стегнової кістки. Тварини були розділені на 3 групи, по 20 тварин у кожній: група А — тварини, яким кальцитонін призначався на 2-гу добу після операції; група В — тварини, яким кальцитонін призначався на 5-ту добу після операції; група С — контроль, без призначення препарату. Тваринам груп А і В підшкірно вводився кальцитонін у дозі 10 мкг/кг/добу. З експерименту тварини виводилися на 3-тю, 7-му, 14-ту і 28-му добу (по 5 тварин у кожній підгрупі) шляхом передозування ефіру. Узятий матеріал піддавали гістологічному дослідженню.
У ході дослідження з’ясувалося, що лікування кальцитоніном тварин із травматичним пошкодженням стегнової кістки в метафізарних ділянках на стадії репаративного остеогенезу, що охоплює запальний процес (група А), є неефективним. Мають місце уповільнення перебудови відламків материнської кістки і зниження репаративного потенціалу. Більш оптимістичний прогноз може бути зроблений після введення препарату на стадії проліферації (група В), диференціювання клітин і початку формування тканинних структур. На 28-му добу в області травматичного пошкодження спостерігалася сформована пластинчата кісткова тканина з більш високою щільністю клітинних елементів, ніж в групі А і контрольній групі.
The study was conducted on 60 adult females rats Vistar aged 6 months. All animals were undergone a perforated defect of femur distal metaepiphysis under ether inhalation anesthesia. The animals were divided into 3 groups of 20 animals in each one: group A consisted of the animals being calcitonin administered from the 2nd day after surgery; group B involved the animals being calcitonin administered after the 5th day after the operation; group C was a control one, without the administration of the drug. The animals of groups A and B received calcitonin subcutaneously at a dose of 10 mg/kg per day. The animals were sacrificed on the 3rd and 7th, 14th and 28th day (5 animals in each group) by ether overdosing. The taken material was histologically analyzed.
The study found that calcitonin application in animals with traumatic metaphyseal femur on the reparative osteogenesis stage embracing inflammation (group A) was ineffective. There is a slowing down of the restructuring of the mature bone fragments and reduced reparative potential. More optimistic forecast can be made in the animals injected on the stage of proliferation (group B), cell differentiation and the beginning of tissue structures formation. On the 28th day formed lamellar bone tissue with the higher density of cellular components in traumatic area was observed in comparison with group A and the control one.
регенерация перелома, кальцитонин.
регенерація перелому, кальцитонін.
fracture healing, calcitonin.
Статья опубликована на с. 30-34
Консолидация перелома кости является чрезвычайно важным биологическим процессом. Нарушение процессов репарации переломов приводит к значительным функциональным нарушениям [4, 7]. В идеале консолидация перелома должна привести к образованию костной ткани, идентичной ее состоянию до перелома. К сожалению, сращение перелома кости является довольно длительным многостадийным процессом, на который оказывают влияние множество факторов [10, 17]. Основными действующими лицами этого процесса являются остеобласты и остеокласты. Поэтому препараты, которые стимулируют первых и подавляют вторых, гипотетически должны улучшать регенерацию кости [5, 21]. В большинстве своем данные препараты используются для лечения остеопороза. Удивительно, но в существующей литературе результаты исследований влияния антиостеопоротических средств на процессы образования костной мозоли, особенно клинических, являются ограниченными и противоречивыми [2, 9, 14, 18]. Причем большинство исследований посвящено влиянию остеотропных препаратов на заживление переломов на фоне системного остеопороза [3, 11, 12, 16].
Одним из препаратов, до недавнего времени широко использовавшимся для лечения остеопороза, является кальцитонин лосося. В настоящее время Европейское агентство по контролю за лекарственными средствами (European Medicines Agency — ЕМА) не рекомендует использовать кальцитонин для лечения системного остеопороза, поскольку при длительном его использовании отмечается небольшое (0,7 % при использовании пероральной и 2,4 % при использовании назальной формы) увеличение риска онкологических заболеваний [1]. Комитет по использованию лекарственных средств у человека (The Agency’s Committee for Medicinal Products for Human Use) при данном агентстве рекомендует использование препаратов, содержащих кальцитонин, краткосрочными курсами при болезни Педжета, острой потере костной ткани, связанной с иммобилизацией, и при гиперкальциемии, вызванной злокачественными новообразованиями. Поскольку среднее время, необходимое для формирования костной мозоли, при большинстве переломов составляет 4 недели (оптимальное время безопасного использования кальцитонина согласно рекомендациям CHMP ЕМА), изучение его влияния на репаративный остеогенез является актуальным перспективным направлением.
В литературе данные, касающиеся влияния кальцитонина на регенерацию костной ткани при переломах, являются достаточно противоречивыми. Ряд исследователей не отметили сколь-нибудь значимого влияния кальцитонина на темпы образования костной мозоли [15, 20], в некоторых работах указывается на положительный эффект препарата на регенерацию [13, 22], а в некоторых исследованиях, напротив, наблюдалось ухудшение качественно-прочностных характеристик регенерата [8].
С учетом вышеизложенного целью нашего исследования стало изучение влияния кальцитонина лосося на репаративную регенерацию костной ткани в эксперименте.
Материал и методы
Исследование проведено на 60 половозрелых самках крыс линии Vistar в возрасте 6 мес., содержащихся в стандартных условиях вивария Института геронтологии НАМН Украины. Всем животным под ингаляционным эфирным наркозом был выполнен дырчатый дефект дистального метаэпифиза бедренной кости. Дополнительная внешняя иммобилизация оперированной конечности не применялась. Животные были разделены на 3 группы, по 20 животных в каждой: группа А — животные, которым кальцитонин назначался со 2-х суток после операции; группа В — животные, которым кальцитонин назначался с 5-х суток после операции; группа С — контроль, без назначения препарата.
Для гистологических исследований бедренную кость крысы с участком травматического повреждения фиксировали в 10% растворе нейтрального формалина, декальцинировали в растворе 4% азотной кислоты, обезвоживали в спиртах возрастающей прочности и помещали в целлоидин. Изготавливали гистологически срезы на санном микротоме Reichert, окрашивали их гематоксилином и эозином, а также пикрофуксином по Ван-Гизону. Окрашенные срезы анализировали в микроскопе MICROS, а также в поляризованном свете (Polmy-A). Фотографировали препараты с помощью цифровой фотокамеры Canon EOS–300D под микроскопом Axio Star Plus.
Животным групп А и В подкожно вводился кальцитонин в дозе 10 мкг/кг в сутки. Из эксперимента животные выводились на 3-и, 7, 14 и 28-е сутки (по 5 животных в каждой подгруппе) путем передозировки эфира. Взятый материал подвергали гистологическому исследованию. В исследовании использована классификация стадийности репаративного остеогенеза Т.В. Лаврищевой (1995).
Результаты исследования
I серия эксперимента (группа А)
На 3-и сутки при микроскопическом анализе четко определялась область травматического повреждения. Между концами отломков в области как компактной, так и губчатой кости дистального отдела бедренной кости располагался кровяной сгусток с нитями фибрина, а также отечные полости. Среди нитей фибрина выявлялись элементы крови — единичные нейтрофилы и лимфоциты. В краевых отделах определяются очаги деструктивно измененного костного мозга. В кортексе и костных трабекулах материнской кости, прилежащей к области травматического повреждения, определялись участки с деструктивными нарушениями — трещины, щели, участки без остеоцитов. Костные трабекулы были расслоены. Над участками материнской кости, прилежащей к области травматического повреждения, периост был отечным, с набухшими коллагеновыми волокнами и лизированными клетками.
На 7-е сутки в области травматического повреждения располагалась фиброретикулярная и грануляционная ткань с клетками фибробластического дифферона (рис. 1). Оба типа ткани размещались между кортексом и в области губчатой кости, перемежаясь друг с другом.
/31/31.jpg)
Грануляционная ткань, располагающаяся в поверхностных отделах дефекта, на участках представлена фибробластами различной зрелости, малодифференцированными стромальными клетками, лимфоцитами.
В этой области сохранялись обширные участки нерассосавшегося кровяного сгустка. Синусоиды и сосуды капиллярного типа были полнокровны. Они располагались в основном в глубже лежащей грануляционной ткани. В поверхностных отделах дефекта находилось большое количество клеток с пикнотичными ядрами или лизированных.
В фиброретикулярной ткани наблюдалась низкая плотность остеобластов, в основном преобладали клетки фибробластического дифферона. Единичные сосуды имели узкие просветы. В межтрабекулярных пространствах губчатой кости находились очаги деструктивно измененного костного мозга. Краевые отделы кортекса, прилежащие к области травматического повреждения, были деструктивно изменены, без признаков репаративной перестройки.
На 14-е сутки микроскопически в области костного дефекта, проходящего через кортекс, обнаруживали грануляционную и фиброретикулярную ткань, частично заполняющую эту область. В глубоких отделах травматического повреждения располагались новообразованные костные трабекулы, формирующие крупнопетлистую сеть (рис. 2). Краевые отделы кортекса не спаяны регенератом, периост над областью травматического повреждения не сформирован.
В глубоких отделах дефекта в области губчатой кости располагаются поля фиброретикулярной ткани, в которой повышена плотность фибробластов, и лишь на небольших участках, прилежащих к материнским трабекулам, обнаруживаются скопления остеобластов. Клетки имеют крупное асимметричное ядро и слабобазофильную цитоплазму.
Новообразованная костная ткань в области мозгового канала с высокой плотностью остеоцитов. В регенерате сохраняются полости, заполненные тканевой жидкостью. Кортекс материнской кости, прилежащий к дефекту, без клеток и на значительном протяжении от области травматического повреждения без признаков перестройки. Костные трабекулы губчатой материнской кости на участках без остеоцитов, истончены.
По поверхности материнской кости вблизи дефекта остеогенный слой периоста расширен, и в этой области формируются остеоид и незрелые костные трабекулы.
Регенерат у контрольных нелеченных животных, сформировавшийся в области травматического повреждения, аналогичен таковому у леченых животных. Отличительной особенностью течения процесса регенерации у опытной группы животных по сравнению с контрольной группой является отсутствие признаков перестройки материнской кости, прилежащей к области травматического повреждения. По всей вероятности, этот факт может быть связан с ингибированием биосинтеза паратгормона за счет повышенного уровня экзогенного кальцитонина. Известно, что именно повышение биосинтеза паратгормона на ранних сроках регенерации способствует перестройке костных фрагментов, врастанию в них кровеносных сосудов, что способствует формированию в этих областях очагов репарации [6]. Нарушение баланса кальцитонин — паратгормон может приводить к замедлению перестройки костных фрагментов [19].
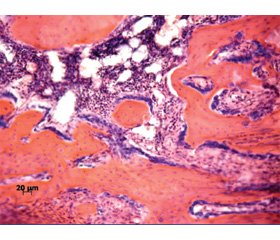
На 28-е сутки после перелома в области травматического повреждения располагалась новообразованная губчатая костная ткань с утолщенными костными трабекулами, между которыми выявлялись очаги фиброретикулярной ткани и островки желтого и красного костного мозга (рис. 3). Плотность остеоцитов на поверхности костных трабекул была низкой.
В области дефекта, проходящего через губчатую кость, костные трабекулы были утолщены. Они располагались изолированно, не формируя плотную сеть.
Фрагменты материнской кости с признаками слабовыраженной перестройки.
Над областью травматического повреждения сформирован периост, представленный узкой полоской коллагеноволокнистой ткани с фибробластами, располагающимися между пучками коллагеновых волокон.
II серия эксперимента (группа В)
У животных, выведенных из эксперимента на 3-и и 7-е сутки после операции, гистологическая картина не отличалась от таковой в группе А.
На 14-е сутки костный дефект был выполнен в основном фиброретикулярной тканью, на участках перемежающейся с островками новообразованной костной ткани.
Фиброретикулярная ткань занимала обширные площади, локализуясь как в виде полей в области травматического повреждения, так и в межтрабекулярных пространствах материнских костных трабекул (рис. 4). В отдельных межтрабекулярных пространствах выявлялись участки деструктивно измененного костного мозга в виде клеточного детрита.
Новообразованные костные трабекулы формируют мелкопетлистую сеть. Они представлены в основном волокнистой костной тканью с высокой плотностью в краевых отделах остеобластов, а на поверхности трабекул — остеоцитов (рис. 4).
Периост над областью дефекта отсутствует. Реактивные изменения в организации периоста проявляются формированием утолщенного остеогенного слоя, состоящего из скоплений остеобластов и незрелой костной ткани.
В материнской кости — кортексе и губчатой кости — имели место слабо выраженные признаки перестройки, заключающиеся во врастании кровеносных сосудов, формирующих островки остеогенеза.
На 28-е сутки при микроскопическом анализе установлено, что в регенерате в области отломков компактной и губчатой кости определялись молодые костные трабекулы, формирующие сеть (рис. 5). Новообразованные костные трабекулы содержали остеобласты и остеоциты, плотность которых на их поверхности была выше, чем в группе А и в контрольной группе. Грубоволокнистая костная ткань располагалась в глубоких отделах губчатой кости, формируя плотные сплетения с материнскими костными трабекулами, прилежащими к области травматического повреждения.
В межтрабекулярных пространствах губчатой кости, прилежащей к области травматического повреждения, находилась ретикулофиброзная ткань с небольшими очагами новообразованного красного костного мозга, капиллярами, венулами и артериолами.
Компактная и губчатая кости, прилежащие к области дефекта, — с признаками репаративной перестройки. В трещины и щели прорастает фиброретикулярная ткань. Кровеносные сосуды обнаруживаются в глубоких отдела дефекта, в губчатой кости регенерата, в периосте.
Периост над дефектом и на расстоянии от области травматического повреждения утолщен за счет формирования фиброзного и остеогенного слоев. Фиброзный слой представлен параллельно расположенными пучками коллагеновых волокон, между которыми находились клетки фибробластического дифферона.
Выводы
Таким образом, лечение миакальцином животных с травматическим повреждением бедренной кости в метафизарной области на стадии репаративного остеогенеза, охватывающей воспалительный процесс (группа А), неэффективно. Имеют место замедление перестройки отломков материнской кости, снижение репаративного потенциала, длительно присутствующий отек в области травматического повреждения. Более оптимистический прогноз может быть сделан после введения препарата на стадии пролиферации (группа В), дифференцировки клеток и начала формирования тканевых структур. На 28-е сутки в области травматического повреждения наблюдалась сформированная пластинчатая костная ткань с более высокой плотностью клеточных элементов, чем в группе А и контрольной группе.
1. Поворознюк В.В., Григорьева Н.В. Медицинский светофор // Боль. Суставы. Позвоночник. — 2012. — 3(07).
2. Aspenberg P. Drugs and fracture repair // Acta Orthop. — 2005. — 76. — 241–248.
3. Augat P., Simon U., Liedert A., Claes L. Mechanics and mechanobiology of fracture heaing in normal and osteoporotic bone // Osteoporos. Int. — 2005. — 16. — S36–S43.
4. Barrios C., Brostrom L.A., Stark A., Walheim G. Healing complications after internal fixation of trochanteric hip fractures: the prognostic values of osteoporosis // J. Orthop. Trauma. — 1993. — 7. — 438–442.
5. Cebosoy O., Tutar E., Kose K.C., Baltaci Y., Bagci C. Effect of strontium ranelate on fracture healing in rat tibia // Joint Bone Spine. — 2007. — 74. — 590–593.
6. Cipriano C.A., Issack P.S., Shindle L., Werner C.M., Helfet D.L., Lane J.M. Recent advances toward the clinical application of PTH (1–34) in fracture healing // HSS J. — 2009. — 5. — 149–153.
7. Cummings S.R., Melton L. Jr. Epidemiology and outcomes of osteoporotic fractures // Lancet. — 2000. — 359. — 1761–1767.
8. Ekeland A., Muhre L., Underdal T. Effects of salmon calcitonin on mechanical properties of healing and intact bone and skin in rats // Acta Orthop. Scand. — 1983. — 54. — 760–767.
9. Fleisch H. Can bisphosphonates be given to patients with fractures? // J. Bone Miner. Res. — 2001. — 16. — 437–440.
10. Frost H.M. The biology of fracture healing. An overview for clinicians. Part I // Clin. Orthop. — 1989. — 248. — 150–162.
11. Goldhahn J., Scheele W.H., Mitlak B.H. et al. Clinical evaluation of medicinal products for acceleration of fracture healing in patients with osteoporosis // Bone. — 2008. — 43. — 343–347.
12. Johnson–Lynn S.E., Francis R., McCaskie A. Osteoporosis treatments and their effect on fracture healing // Curr. Orthop. — 2008. — 2. — 336–340.
13. Kolar J., Babicky A., Blahos J. Influence of 25-hydroxy-calciferol and calcitonin on experimental fractures // Acta Chir. Orthop. Traumatol. — 1979. — 46. — 193–199.
14. Lewiecki E.M. Emerging drugs for postmenopausal osteoporosis // Expert. Opin. Emerg. Drugs. — 2009. — 14. — 129–144.
15. Lyritis G.P., Boscainos P.J. Calcitonin effects on cartilage and fracture healing // J. Musculoskel. Neuron. Interact. — 2001. — 2. — 137–142.
16. Lyritis G.P. Fracture healing and antiosteoporotic treatments // Medicographia. — 2010. — 32. — 79–85.
17. McKibbin B. The biology of fracture healing in long bones // J. Bone Joint Surg. Br. — 1978. — 60B. — 150–162.
18. Meyer R.A. Jr, Tsahakis P.J., Martin D.F., Banks D.M., Harrow M.E., Kiebzak G.M. Age and ovariectomy impair both the normalization of mechanical properties and the accretion of mineral by the fracture callus in rats // J. Orthop. Res. — 2001. — 19. — 428–435.
19. Nozaka K., Miyakoshi N., Kasukawa Y., Maekawa S., Noguchi H., Shimada Y. Intermittent administration of human parathyroid hormone enhances bone formation and union at the site of cancellous bone osteotomy in normal and ovariectomized rats // Bone. — 2008. — 42. — 90–97.
20. Paavolainen P., Taivainen T., Michelsson J.–E., Lalla M., Penttinen R. Calcitonin and fracture healing. An experimental study on rats // J. Orthop. Res. — 1989. — 100–106.
21. Rizzoli R. A new treatment for post-menopausal osteoporosis: strontium ranelate // J. Endocrinol. Invest. — 2005. — 28(suppl. 8). — 50–57.
22. Schatzker J., Chapman M., Ha’Eri G.B., Fornasier V.L. The effect of calcitonin on fracture healing // Clin. Orthop. — 1979. — 141. — 303–306.

/32/32.jpg)
/33/33.jpg)