Международный эндокринологический журнал 6 (62) 2014
Вернуться к номеру
Стан систолічної та діастолічної функції лівого шлуночка у хворих із постінфарктним кардіосклерозом та ожирінням
Авторы: Кравчун П.П. - Харківський національний медичний університет
Рубрики: Кардиология, Эндокринология
Разделы: Клинические исследования
Версия для печати
Серцево-судинні захворювання є однією з головних причин смертності в усьому світі, основний внесок у її структуру робить ішемічна хвороба серця. Одним з основних факторів прогресування ішемічної хвороби серця є ожиріння.
Мета дослідження — провести аналіз стану систолічної та діастолічної функції лівого шлуночка у хворих із постінфарктним кардіосклерозом та ожирінням.
Матеріали та методи. До дослідження ретроспективно включено 76 хворих на ішемічну хворобу серця, які перенесли інфаркт міокарда, із супутнім ожирінням. Групу порівняння становили 80 хворих на ішемічну хворобу серця, які перенесли інфаркт міокарда без ожиріння. Усім хворим проводили загальноклінічні та інструментальні обстеження. Статистичну обробку отриманих даних проведено за допомогою пакета статистичних програм Statistica 8.0, Microsoft Office Exсel 2003.
Результати. Встановлено, що ступінь зниження скоротливості лівого шлуночка є важливим показником виснаження компенсаторних резервів міокарда та істотно впливає на тяжкість клінічних проявів у хворих із постінфарктним кардіосклерозом та ожирінням.
Висновки. Коморбідність ожиріння та постінфарктного ремоделювання потенціює збільшення розмірів серця, дилатацію порожнин серця на тлі зниження інотропної функції міокарда. У більшості пацієнтів із постінфарктним кардіосклерозом та ожирінням діастолічна дисфункція лівого шлуночка проявлялася типом порушення релаксації.
Сердечно-сосудистые заболевания являются одной из главных причин смертности во всем мире, основной вклад в ее структуру принадлежит ишемической болезни сердца. Одним из основных факторов прогрессирования ишемической болезни сердца является ожирение.
Цель исследования — провести анализ состояния систолической и диастолической функции левого желудочка у больных с постинфарктным кардиосклерозом и ожирением.
Материалы и методы. В исследование ретроспективно включено 76 больных ишемической болезнью сердца, перенесших инфаркт миокарда, с сопутствующим ожирением. Группу сравнения составили 80 больных ишемической болезнью сердца, перенесших инфаркт миокарда без ожирения. Всем больным проводили общие клинические и инструментальные обследования. Статистическая обработка полученных данных проведена с помощью пакета статистических программ Statistica 8.0, Microsoft Office Exсel 2003.
Результаты. Установлено, что степень снижения сократимости левого желудочка является важным показателем истощения компенсаторных резервов миокарда и существенно влияет на тяжесть клинических проявлений у больных с пост-инфарктным кардиосклерозом и ожирением.
Выводы. Коморбидность ожирения и постинфарктного ремоделирования потенцирует увеличение размеров сердца, дилатацию полостей сердца на фоне снижения инотропной функции миокарда. У большинства пациентов с постинфарктным кардиосклерозом и ожирением диастолическая дисфункция левого желудочка проявлялась типом нарушения релаксации.
Cardiovascular diseases are one of the major causes of mortality worldwide, the main contribution to its structure belongs to ischemic heart disease. One of the major factors for the progression of ischemic heart disease is obesity.
The objective of the work — to carry out an analysis of the state of left ventricular systolic and diastolic function in patients with postinfarction cardiosclerosis and obesity.
Materials and Methods. The study retrospectively included 76 patients with ischemic heart disease, who had myocardial infarction, with concomitant obesity. Comparison group consisted of 80 patients with ischemic heart disease, who had myocardial infarction, without obesity. All patients underwent general clinical and instrumental examination. Statistical analysis of the data was performed using the statistical software package Statistica 8.0, Microsoft Office Excel 2003.
Results. It is found that the degree of reduction in left ventricular contractility is an important indicator of myocardial compensatory reserves exhaustion and has a significant impact on the severity of clinical manifestations in patients with postinfarction cardiosclerosis and obesity.
Conclusions. Comorbidity of obesity and postinfarction remodeling potentiate the increase of the heart size, dilatation of the heart cavities on the background of inotropic myocardial function reduction. In most patients with postinfarction cardiosclerosis and obesity, left ventricular diastolic dysfunction manifested by a type of relaxation disturbance.
постінфарктний кардіосклероз, ожиріння, систолічна функція, діастолічна функція.
постинфарктный кардиосклероз, ожирение, систолическая функция, диастолическая функция.
postinfarction cardiosclerosis, obesity, systolic function, diastolic function.
Статья опубликована на с. 37-40
Вступ
Серцево-судинні захворювання є однією з головних причин смертності в усьому світі, основний внесок в її структуру робить ішемічна хвороба серця (ІХС). Так, у країнах із високим рівнем доходу від ІХС щорічно помирає 1 млн 420 тисяч осіб [10], а витрати на лікування цього захворювання тільки в США становлять 165,4 млн доларів [4].
За оцінками Американської кардіологічної асоціації (American Heart Association — АНА), у США у 17,6 млн осіб діагностовано ІХС, із них 10,2 млн мають стабільну стенокардію напруження, а 8,5 млн — перенесли гострий інфаркт міокарда (ІМ) [8]. Особливості розвитку систолічної та діастолічної дисфункції при ІМ та в післяінфарктний період зумовлені появою структурно-функціональних змін міокарда, геометрії лівого шлуночка (ЛШ), його ремоделюванням, що значною мірою залежить від наявності факторів ризику.
Основними факторами прогресування та несприятливого завершення ІХС є артеріальна гіпертензія, клапанна хвороба серця, цукровий діабет та ожиріння [11]. Протягом Фремінгемського дослідження доведено, що незалежним фактором серцево-судинної захворюваності та смертності є гіпертрофія лівого шлуночка, яка відіграє важливу роль серед механізмів формування дисфункції міокарда [5]. Вірогідність розвитку серцево-судинної патології в осіб з ожирінням на 50 % більша, ніж в осіб із нормальною масою тіла [9]. Встановлено вірогідний зв’язок надмірної маси тіла та помірного ожиріння зі збільшенням випадків вперше виявленої ІХС [13]. Структурні зміни серця при ожирінні можна поділити на такі основні складові: гіпертрофія ЛШ, зміни структурної побудови серцевої тканини, ожиріння серця, зміни розмірів правого шлуночка та лівого передсердя (ЛП). Багато дослідників установили незалежну асоціацію ожиріння з гіпертрофією ЛШ [2]. Деякі вчені вважають, що збільшення маси ЛШ при ожирінні є пропорційним збільшенню площі поверхні тіла та не є патологічним [6]. Попередні дослідження довели, що при ожирінні має місце дилатація камер серця [1]. За наявності ожиріння товщина стінки ЛШ у більшості випадків переважає ступінь дилатації його порожнини (концентрична гіпертрофія ЛШ). Визначено також більший розмір ЛП у хворих на ожиріння порівняно з групою осіб із нормальною вагою. Механізми, що призводять до збільшення розміру ЛП, ідентичні тим, що зумовлюють гіпертрофію ЛШ: збільшення індексу маси тіла, гіпертензія, об’ємне перевантаження та порушення діастолічного наповнення. Framingham Heart Study серед хворих на ожиріння показало більший ризик виникнення фібриляції передсердь, що пояснювалось саме збільшенням розміру ЛП [14].
Серед патологічних процесів, що впливають на стан серцево-судинної системи, лікування та реабілітацію хворих на постінфарктний кардіосклероз із супутнім ожирінням, слід особу увагу приділяти особливостям ремоделювання міокарда ЛШ серця та його зв’язку з особливостями перебігу захворювання. Такий підхід до проблеми визначає перш за все стратегічні принципи терапевтичних напрямків до лікування хворих на пост-інфарктний кардіосклероз, ожиріння та їх ускладнення. При цьому об’єктом медикаментозного впливу повинна бути позитивна модифікація факторів, що зумовлюють подальший розвиток механізмів атеросклерозу, ІХС, хронічної серцевої недостатності й аритмій.
Звідси висока актуальність визначення основних механізмів розвитку систолічної та діастолічної дисфункції: ремоделювання міокарда, розробки принципів і схем відновлювального лікування в пост-
інфарктному періоді, що засновані на оцінці гемодинамічного стану, корекції ремоделювання в бажаному позитивному напрямку. Цей підхід є визначальним субстратом для корекції гемодинамічного стану, що і стало підґрунтям дослідження.
Мета дослідження — провести аналіз стану систолічної та діастолічної функції лівого шлуночка у хворих із постінфарктним кардіосклерозом та ожирінням.
Матеріали та методи дослідження
До дослідження ретроспективно включено 76 хворих на ІХС, які перенесли ІМ, із супутнім ожирінням. Середній вік обстежених становив 64,87 ± 1,98 року, із них чоловіків було 37 (49 %), жінок — 39 (51 %). У дослідження не залучали хворих із тяжкою супутньою патологією органів дихання, травлення, нирок та осіб з онкологічними захворюваннями і діабетом. Групу порівняння становили 80 хворих на ІХС, які перенесли ІМ, без ожиріння. Середній вік пацієнтів групи порівняння становив 63,47 ± 1,28 року, із них чоловіків було 42 (52,5 %), жінок — 38 (47,5 %). Групи були порівнянні за віком та статтю. До контрольної групи було включено 35 практично здорових осіб. Середній вік практично здорових осіб, які увійшли до контрольної групи, становив 58,23 ± 1,39 року.
Діагноз перенесеного ІМ визначали за критеріями ESC/ACCF/AHA/WHF (2012) [12].
Усім хворим проводили загальноклінічні та інструментальні обстеження. Ехокардіографічні дослідження проводили за стандартною методикою Х. Фейгенбаума на ультразвуковому апараті RADMIR (Ultima PRO 30) (Харків, Україна). У М-режимі визначали такі параметри ЛШ: кінцевий діастолічний розмір (КДР) (см), кінцевий систолічний розмір (КСР) (см), товщину задньої стінки ЛШ (ТЗСЛШ) (см), товщину міжшлуночкової перегородки (ТМШП) (см). Кінцевий діастолічний об’єм (КДО) і систолічний об’єм (КСО) (мл) ЛШ розраховували за методом Simpson (1991), після чого обчислювали фракцію викиду (ФВ) ЛШ (%). Масу міокарда ЛШ (ММЛШ) обчислювали за формулою R. Devereux і співавт.: 1,04 × [(ТМШП + ТЗСЛШ + КДР)3] – [КДР]3 – 13,6. Розрахунок індексу товщини стінки міокарда ЛШ (ІТСМЛШ) проводили за формулою: ІТСМЛШ = (ТЗСМЛШд + ТМШПд) / КДР.
Потім розраховували індекс маси міокарда ЛШ (ІММЛШ) щодо зросту пацієнтів: ІММЛШ (г/м) = ММЛШ / Р, де Р — зріст пацієнтів (м). Також визначали розмір ЛП (см) та аорти (см). Діастолічна функція ЛШ досліджувалася шляхом реєстрації допплерівського трансмітрального діастолічного потоку. Визначали максимальні швидкості раннього (Е) (см/с) і пізнього (А) (см/с) наповнення ЛШ, їх співвідношення (Е/А) (од), час ізоволюметричного розслаблення ЛШ (iVRT) (мс). Структуру діастолічного наповнення ЛШ класифікували відповідно до традиційних критеріїв (Алехин М.Н., Седов В.П., 1996). Псевдонормальний тип трансмітрального діастолічного потоку ідентифікували за допомогою проби Вальсальви.
Статистичну обробку отриманих даних проведено за допомогою пакета статистичних програм Statistica 8.0 (StatSoft Inc, США), Microsoft Office Exсel 2003. Кількісні ознаки при нормальному розподілі були подані у вигляді середнє ± стандартна похибка середнього (М ± m), для порівняння середніх двох вибірок використовували критерій Стьюдента. Для всіх видів аналізу відмінності вважали статистично значимими при р < 0,05.
Результати та їх обговорення
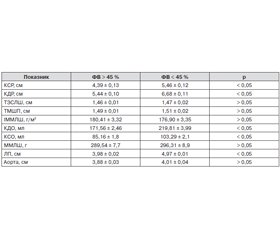
У табл. 1 проаналізовано основні параметри кардіогемодинаміки у хворих із постінфарктним кардіосклерозом та ожирінням залежно від інотропної функції міокарда.
Закономірно, що в групі з систолічною дисфункцією (ФВ < 45 %) мали місце більш значущі порушення морфофункціональних параметрів міокарда, які вірогідно відрізнялися від таких у групі зі збереженою систолічною функцією (ФВ > 45 %). Ці дані поєднувалися з обумовленими в групі з систолічною дисфункцією більш вираженими ознаками збільшення розмірів ЛП на 19,92 % порівняно з групою зі збереженою інотропною функцією ЛШ, ступеня дилатації ЛШ за рахунок збільшення КДО на 21,95 %, КСО на 17,55 %, КДР на 18,56 %, КСР на 19,6 %, вірогідно перевищуючи значення групи пацієнтів зі збереженою систолічною функцією міокарда (р < 0,05). Тобто ступінь зниження скоротливості ЛШ є важливим показником виснаження компенсаторних резервів міокарда та істотно впливає на тяжкість клінічних проявів у хворих із постінфарктним кардіосклерозом та ожирінням.
З метою вивчення особливостей діастолічної функції у пацієнтів із постінфарктним кардіосклерозом та ожирінням проаналізовано параметри трансмітрального кровотоку (табл. 2).
У хворих при поєднанні ожиріння та постінфарктного кардіосклерозу визначено зміни таких показників, як швидкість піків Е і А, співвідношення Е/А, час ізоволюметричного розслаблення (IVRT) та час уповільнення швидкості раннього діастолічного потоку (DT). Швидкість піку Е була вища у хворих першої групи і становила 64,32 ± 3,10 мм/с порівняно з 57,92 ± 2,60 мм/с групи порівняння (р < 0,05). Швидкість піку А мала аналогічну динаміку: 74,11 ± 1,40 мм/с порівняно з 62,28 ± 1,70 мм/с у хворих із супутнім ожирінням та без нього відповідно (р < 0,05). Співвідношення піків Е/А у пацієнтів із постінфарктним кардіосклерозом виявилося менше 1 (р < 0,05), становлячи 0,87 ± 0,03 у хворих з ожирінням та 0,93 ± 0,05 у хворих із нормальною масою тіла, що вказує на уповільнене розслаблення ЛШ. Показник iVRT вірогідно перевищував такий у всіх хворих із постінфарктним кардіосклерозом, найбільш високе його значення було при поєднанні з ожирінням (109,4 ± 2,2), тоді як у хворих другої групи він дорівнював 103,9 ± 1,9 мс (р < 0,05). Визначалися відмінності показника DT, що становив при ожирінні 235,7 ± 8,5 мс, а без нього — 221,4 ± 8,7 мс (р < 0,05). У більшості пацієнтів із постінфарктним кардіосклерозом та ожирінням діастолічна дисфункція ЛШ проявлялася типом порушення релаксації. Про незначне або помірне зниження діастолічної функції ЛШ у пацієнтів з ожирінням свідчить також низка інших досліджень [3, 7].
Висновки
1. Коморбідність ожиріння та постінфарктного ремоделювання потенціює збільшення розмірів лівого передсердя та лівого шлуночка, дилатацію порожнин серця на тлі зниження інотропної функції міокарда.
2. У більшості пацієнтів із постінфарктним кардіосклерозом та ожирінням діастолічна дисфункція лівого шлуночка проявлялася типом порушення релаксації.
1. Нетяженко В.З. Структурные изменения миокарда при хронической сердечной недостаточности ІІ функционального класса на фоне избыточной массы тела и абдоминального ожирения / В.З. Нетяженко, П.П. Бидзиля // Запорожский медицинский журнал. — 2014. — № 2(83). — С. 22-25.
2. Avelar E. Left ventricular hypertrophy in severe obesity: interactions among blood pressure, nocturnal hypoxemia, body mass / E. Avelar, T. Cloward, J.M. Walker et al. // Hypertension. — 2007. — Vol. 49. — P. 34-39.
3. Di Bello V. New echocardiographic techniques in the evaluation of left ventricular function in obesity / V. Di Bello, I. Fabiani, L. Conte et al. // Obesity. — 2013. — № 21(5). — Р. 881-892.
4. Elliott W.J. Incident diabetes in clinical trials of antihypertensive drugs: a network meta-analysis [erratum in Lancet 2007, 369: 1518] / W.J. Elliott, P.M. Meier // Lancet. — 2007. — Vol. 369. — P. 201.
5. Frankel D.S. Resistin, Adiponectin, and Risk of Heart Failure. The Framingham Offspring study / D.S. Frankel, R.S. Vasan, R. D’Agostino et al. // J. Am. Coll. Cardiol. — 2009. — Vol. 53. — P. 754-762.
6. Iacobellis G. Epicardial adipose tissue and insulin resistance in obese subjects / G. Iacobellis, F. Leonetti // J. Clin. Endocrinol. Metab. — 2005. — Vol. 90. — P. 6300-6302.
7. Kosmala W. Use of body weight and insulin resistance to select obese patients for echocardiographic assessment of subclinical left ventricular dysfunction / W. Kosmala, C. Wong, J. Kuliczkowska et al. // Am. J. Cardiol. — 2008. — 1; 101(9). — Р. 1334-1340.
8. Lloyd-Jones D. Heart disease and stroke statistics — 2010 update: A report from the American Heart Association / D. Lloyd-Jones, R.J. Adams, T.M. Brown et al. // Circulation. — 2010. — Vol. 121. — P. e46.
9. Poirier Р. Obesity and Cardiovascular Disease Pathophysiology, Evaluation, and Effect of Weight Loss / P. Poirier, T.D. Giles, G.A. Bray et al. // Arterioscler. Thromb. Vasc. Biol. — 2006. — Vol. 26. — P. 968-976.
10. Roger V.L. AHA Statistical Update. Heart Disease and Stroke Statistics — 2012 Update. A Report From the American Heart Association / V.L. Roger, A.S. Go, D.M. Lloyd-Jones et al. // Circulation. — 2012. — Vol. 125. — P. e2-e220.
11. The risk of heart failure associated with the use of noninsulin blood glucose-lowering drugs: systematic review and meta-analysis of published observational studies / C. Varas-Lorenzo, A.V. Margulis, M. Pladevall et al. // BMC Cardiovasc. Disord. — 2014 Sep 26. — 14(1). — Р. 129.
12. Third universal definition of myocardial infarction [Text] / K. Thygesen, J.S. Alpert, A.S. Jaffe et al. // Circulation. — 2012. — Vol. 126. — P. 2020-2035.
13. Tribouilloy C. Prognosis of heart failure with preserved ejection fraction: a 5 year prospective population-based study / C. Tribouilloy, D. Rusinaru, H. Mahjoub et al. // European Heart Journal. — 2008. — Vol. 29. — P. 339-347.
14. Wang T.J. Obesity and the risk of new-onset atrial fi brillation / T.J. Wang, H. Parise, D. Levy, R.B. Sr D’Agostino, P.A. Wolf et al. // J. Am. Med. Assoc. — 2004. — Vol. 292. — P. 2471-2477.
1. Netyazhenko VZ, Bydzylya PP Strukturnye yzmenenyya myokarda pry khronycheskoy serdechnoy nedostatochnosty II funktsyonal'noho klassa na fone yzbytochnoy massy tela y abdomynal'noho ozhyrenyya. Zaporozhskyy medytsynskyy zhurnal 2014;2 (83):22–25.
2. Avelar E, Cloward TV, Walker JM, Farney RJ, Strong M, Pendleton RC, Segerson N, Adams TD, Gress RE, Hunt SC, Litwin SE. Left ventricular hypertrophy in severe obesity: interactions among blood pressure, nocturnal hypoxemia, and body mass. Hypertension. 2007;49:34 –39. doi: 10.1161/01.HYP.0000251711.92482.14.
3. Di Bello V, Fabiani I, Conte L, Barletta V, Grazia Delle Donne M, Cuono C, Leo LA, Dini FL, Marzilli M, Pinchera A, Santini F New echocardiographic techniques in the evaluation of left ventricular function in obesity. Obesity 2013;21(5):881–892. DOI: 10.1002/oby.20071.
4. Elliott WJ, Meier PM Incident diabetes in clinical trials of antihypertensive drugs: a network meta-analysis. [erratum in Lancet 369:1518, 2007] Lancet 2007;369:201.
5. Frankel DS, Vasan RS, D’Agostino RB, Sr, et al. Resistin, adiponectin, and risk of heart failure the Framingham offspring study. J Am Coll Cardiol. 2009;53:754–762. doi: 10.1016/j.ahj.2011.09.029.
6. Iacobellis G, Leonetti F. Epicardial adipose tissue and insulin resistance in obese subjects. J Clin Endocrinol Metab 2005; 90 (11): 6300–6302. http://dx.doi.org/10.1210/jc.2005-1087.
7. Kosmala W, Wong C, Kuliczkowska J, Leano R, Przewlocka-Kosmala M, Marwick TH. Use of body weight and insulin resistance to select obese patients for echocardiographic assessment of subclinical left ventricular dysfunction. Am J Cardiol 2008; 101: 1334–1340. doi: 10.1016/j.amjcard.2007.12.034.
8. Lloyd-Jones D., Adams R. J., Brown T. M. et al. Heart disease and stroke statistics – 2010 update: A report from the American Heart Association. Circulation 2010;121:e46. doi: 10.1161/CIRCULATIONAHA.109.192667. Epub 2009 Dec 17.
9. Poirier P, Giles TD, Bray GA, Hong Y, Stern JS, Pi-Sunyer FX, Eckel RH. Obesity and Cardiovascular Disease Pathophysiology, Evaluation, and Effect of Weight Loss. Arterioscler. Thromb. Vasc. Biol. 2006; 26:968–976.
10.Roger V. L., Go A. S., Lloyd-Jones D. M. et al. AHA Statistical Update. Heart Disease and Stroke Statistics – 2012 Update. A Report From the American Heart Association. Circulation 2012;125:e2–e220. doi: 10.1161/CIR.0b013e31823ac046.
11.Varas-Lorenzo C., Margulis A. V., Pladevall M. et al. The risk of heart failure associated with the use of noninsulin blood glucose-lowering drugs: systematic review and meta-analysis of published observational studies. BMC Cardiovasc Disord 2014;Sep 26;14(1):129.
12. Thygesen K., Alpert J. S., Jaffe A. S. et al. Third universal definition of myocardial infarction [Text]. Circulation 2012;126:2020–2035. doi: 10.1161/CIR.0b013e31826e1058.
13. Tribouilloy C., Rusinaru D., Mahjoub H. et al. Prognosis of heart failure with preserved ejection fraction: a 5 year prospective population-based study. European Heart Journal 2008;29:339–347.
14. Wang T.J., Parise H., Levy D., Sr D’Agostino R.B., Wolf P.A. et al. Obesity and the risk of new-onset atrial fi brillation. J. Am. Med. Assoc. 2004;292:2471–2477.

/39/39.jpg)