Журнал «Медицина неотложных состояний» 6 (61) 2014
Вернуться к номеру
ESPEN. Что нового?
Авторы: Наталия Куприненко
Рубрики: Медицина неотложных состояний
Разделы: Медицинские форумы
Версия для печати
Статья опубликована на с. 48-52
По материалам 36-го конгресса Европейского общества
по энтеральному и парентеральному питанию (ESPEN)
«Клиническое питание и метаболизм»
5–9 сентября 2014 года в Женеве (Швейцария) состоялся 36-й конгресс Европейского общества по парентеральному и энтеральному питанию (ESPEN) «Клиническое питание и метаболизм». Это крупномасштабное научное мероприятие посетили делегаты от Украинского общества клинического питания, которые поставили перед собой цель по возвращении в Украину ознакомить своих коллег с самой свежей информацией в области клинического питания. В связи с этим Украинским обществом клинического питания (Українська спілка парентерального та ентерального харчування — УСПЕХ) 20 сентября в Киеве была организована и проведена научно-практическая конференция «ESPEN. Что нового?»
Неспособность врача обеспечить питание больного должна расцениваться как решение уморить его голодом. Решение, для которого в большинстве случаев было бы трудно подобрать оправдание.
Arvid Wretlind
Мероприятие открыл руководитель научно-исследовательского отделения анестезиологии и интенсивной терапии Национального института рака д.м.н. И.И. Лесной (г. Киев) докладом о состоянии вопроса клинического питания в Украине и в Европе на сегодняшний день.
/48/48.jpg) Он сообщил, что в конце 2013 года в 22 онкодиспансерах Украины был проведен скрининг состояния дел по нутритивной поддержке пациентов. Задачей этого исследования стала оценка уровня диагностики и адекватности назначения клинического питания онкологическим пациентам. Были проанализированы карты пациентов, перенесших операции по поводу различных онкологических заболеваний. Основное внимание уделялось следующим вопросам:
Он сообщил, что в конце 2013 года в 22 онкодиспансерах Украины был проведен скрининг состояния дел по нутритивной поддержке пациентов. Задачей этого исследования стала оценка уровня диагностики и адекватности назначения клинического питания онкологическим пациентам. Были проанализированы карты пациентов, перенесших операции по поводу различных онкологических заболеваний. Основное внимание уделялось следующим вопросам:
1. Проводятся ли исследования, позволяющие оценить нутритивный статус пациента?
2. Рассчитываются ли белковые и энергетические потребности для каждого пациента?
3. Какие методы доставки клинического питания используются в рутинной практике для удовлетворения потребностей пациента в белке и энергии?
Ни в одном онкодиспансере не проводится предварительная оценка нутритивного статуса пациентов при поступлении. Поскольку оценка дефицита висцеральных белков производится на основе исследования содержания сывороточного альбумина, трансферрина и абсолютного числа лимфоцитов, анализировалось наличие этих обследований у пациентов. Было установлено, что уровень альбумина определялся только у 25 % пациентов, определение общего белка, которое не является специфичным, проводилось в 100 % случаев, в то время как уровень трансферрина не исследовался вообще.
Белковые и энергетические потребности пациентов рассчитывались эмпирическим путем или не рассчитывались вообще. Формула Гаррисона — Бенедикта для расчета базовых энергетических потребностей использовалась только у двоих пациентов.
На полном энтеральном питании (ЭП) находилось 21,4 % пациентов, на полном парентеральном питании (ПП) — 16,6 %, смешанное питание получали 35,7 % пациентов, перорально принимали пищу 7,1 % пациентов, и 19 % пациентов вообще не получали питания за время пребывания в ОРИТ. При назначении парентерального питания 33 % пациентов назначалось питание «три в одном», 5 % — модульные системы (аминокислоты, глюкоза и жировые эмульсии), 9,5 % пациентов получали только аминокислоты и 9,5 % пациентов — аминокислоты + глюкозу.
В результате проведенного анализа карт онкологических пациентов ОРИТ были сделаны выводы о том, что в Украине не проводится скрининг нутритивного статуса пациента при поступлении в стационар и во время лечения; не используются стандарты оценки нутритивного статуса, принятые в Европе; редко проводится необходимый расчет энергетических и белковых потребностей; часто отсутствует понимание целей нутритивной поддержки. В отношении развития клинического питания Украина находится сейчас на том же этапе, который Европа прошла 10–15 лет назад.
Таким образом, ситуация с состоянием клинического питания требует существенного улучшения. Проведение постоянного системного аудита по вопросам организации клинического питания не только в ОРИТ, но и в хирургических стационарах, актуализация и практическое обучение врачей основам клинического питания способны изменить текущую ситуацию.
В то же время в Европе, где ежегодно оперируется 5 % населения, согласно данным, представленным на конгрессе ESPEN-2014 профессором O. Ljungqvist (Швеция), ситуация с клиническим питанием выглядит гораздо лучше, чем в Украине, но не является идеальной. Так, в результате анализа анкет, оценивающих различные аспекты нутритивной поддержки в Дании, Швеции и Норвегии, установлено, что 25 % врачей не смогли оценить необходимость в нутритивной поддержке, 39 % врачей не знали методик выявления больных с недостаточным питанием, 53 % врачей не смогли рассчитать потребности больного в энергетических компонентах, 66 % не знали национальных рекомендаций по клиническому питанию, и 28 % врачей ответили, что недостаточное питание может привести к осложнениям и более длительной госпитализации. По данным Американского общества по парентеральному и энтеральному питанию (АSPEN), за последние 20 лет наблюдается увеличение в 2,5 раза частоты случаев использования полного парентерального питания у больных в госпиталях США, однако общая ситуация с применением клинического питания все еще остается не на должном уровне. Так, например, данные исследования M.R. Corkins et al. (2010) показали, что среди госпитализированных пациентов, имеющих недостаточный нутритивный статус, только 5,2 % получали энтеральное питание, 8,9 % — парентеральное и 0,7 % — полное парентеральное питание. При этом в очередной раз была доказана прямая зависимость между недостаточностью питания и продолжительностью лечения, а также затратами на лечение.
Важность нутритивной поддержки пациентов в периоперационном периоде достоверно доказана в мультицентровом исследовании с участием 2772 больных, находящихся на искусственной вентиляции легких (ИВЛ) в 167 ОРИТ в 37 странах мира (C. Alberda et al., 2009). В нем продемонстрировано, что увеличение суточного калоража до необходимого в расчете на индекс массы тела (ИМТ) снижает уровень смертности пациентов в течение 60 дней после операции на 50 %.
Вторая лекция д.м.н. И.И. Лесного продемонстрировала непосредственное влияние нутритивного статуса на результаты лечения и качество жизни онкологических больных.
Степень выраженности нутритивной недостаточности у онкологических пациентов колеблется от 46 до 88 %, в зависимости от локализации опухоли. По данным исследования H. Jager-Wittenaar et al., показатели качества жизни, когнитивный статус и выраженность боли у пациентов с нутритивной недостаточностью были достоверно хуже, чем у пациентов с нормальным нутритивным статусом.
Кроме того, у онкологических больных имеет место угнетение иммунной системы, которое усугубляется недостаточностью питания. Результаты исследования R.K. Chandra продемонстрировали, что недостаточное получение белково-углеводного питания приводит к значительным нарушениям клеточно-опосредованного иммунитета, функции фагоцитов, секреции IgA и продукции цитокинов.
В ряде исследований показано влияние снижения массы тела на возникновение острой и поздней токсичности у пациентов, получающих химиотерапию. Например, в работе F. Meyer et al. (2012) продемонстрировано, что снижение массы тела (ИМТ < 25) и недостаточный уровень белка являются независимыми предикторами развития тяжелой поздней токсичности у пациентов с опухолями головы и шеи. В другом исследовании (Capuano G. et al., 2008) у этой же категории пациентов снижение массы тела более чем на 20 % коррелировало с прерыванием лечения, инфекционными осложнениями, ранней смертностью, частотой повторного поступления в больницу и выживаемостью.
Немаловажным является вопрос о влиянии нутритивной поддержки на рост опухоли. В метаанализе ряда клинических исследований, посвященных этой теме, F. Bozetti и V. Mori (2009) обратили внимание, что, если нутритивная поддержка обеспечивала менее 25 ккал/кг/сут, увеличенный рост опухоли выявляли в 4 из 5 исследований, тогда как при обеспечении от 25 до 35 ккал/кг/сут увеличенный рост опухоли выявляли гораздо реже (в 2 из 6 исследований).
Все вышеуказанное свидетельствует в пользу необходимости нутритивной поддержки онкологических пациентов, однако она должна выполняться правильно.
При назначении клинического питания необходим точный расчет дозы с учетом состояния пациента, его возраста и дополнительных факторов (сопутствующая патология, наличие и характер операции), правильный выбор препарата, введение его с правильной скоростью (соответствующей скорости утилизации нутриентов), введение в адекватном соотношении белков, жиров и углеводов. При выполнении расчетов необходимо учитывать, что на утилизацию 1 г азота должно приходиться не менее 120–140 ккал небелковой энергии. Показаниями к назначению нутритивной терапии онкологическим больным являются снижение массы тела более чем на 10 %, уровень альбумина менее 35 г/л, трансферрина — менее 2 г/л, преальбумина — менее 0,2 г/л.
Согласно рекомендациям ESPEN, добавление к липидной эмульсии w–3 жирных кислот (ЖК) рыбьего жира — EPA (эйкозапентаеновая кислота) и DHA (докозагексаеновая кислота) — оказывает выраженное положительное действие на клеточные мембраны и течение воспалительного процесса, снижает продолжительность пребывания пациентов с критическими состояниями в стационаре (уровень доказательности В). w-3-ЖК способствуют снижению выброса провоспалительных производных арахидоновой кислоты — тромбоксана, лейкотриенов, простагландинов, а также интерлейкинов–1 и –6, фактора некроза опухоли, уменьшают выброс провоспалительных простагландинов мононуклеарами, усиливают противоопухолевый эффект химиопрепаратов, вызывают подавление пролиферации мукозальных клеток прямой кишки.
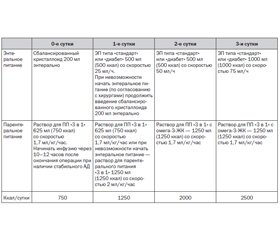
И.И. Лесной представил разработанную в Национальном институте рака схему клинического питания онкопациентов в постоперационном периоде (табл. 1), выделив показания к назначению клинического питания: снижение массы тела более 5 % за последние 6 месяцев, ИМТ < 19 кг/м2, дефицит массы тела более 10 % от идеальной, гипопротеинемия менее 60 г/л или гипоальбуминемия менее 30 г/л, наличие сопутствующей патологии (сахарный диабет, хроническая органная недостаточность).
Предоперационная нутритивная поддержка должна проводиться не менее 7, но и не более 14 суток, в течение этого времени необходим мониторинг альбумина, лимфоцитов, ИМТ, экскреции азота с мочой.
Оптимальным вариантом клинического питания в первые несколько суток пребывания пациента в ОРИТ является комбинация ЭП и ПП для достижения суточной потребности в энергии и белке. Экономическая и клиническая целесообразность и эффективность этой концепции подтверждены в клинических исследованиях. В исследовании S. Gordon Doig (2009) с участием 1372 больных из 31 центра Австралии и Новой Зеландии раннее ПП в дополнение к ЭП снижало смертность больных в ОРИТ, сокращало время лечения в ОРИТ, улучшало качество жизни, а также значительно снижало общую стоимость лечения в ОРИТ (на 3150 $ на 1 больного).
Таким образом, адекватная нутритивная поддержка является эффективным методом лечения онкологических больных, способствующим улучшению клинических исходов при соблюдении всех необходимых правил проведения клинического питания.
/50/50.jpg) Доклад профессора С.А. Дуброва (Национальный медицинский университет им. А.А. Богомольца, г. Киев) был посвящен современной стратегии ведения пациентов в периоперационном периоде, основанной на применении мультимодальных протоколов улучшения восстановления после оперативных вмешательств ERAS, направленных на максимально быстрое восстановление пациентов для поддержки функций органов на предоперационном уровне и уменьшение стрессового ответа вследствие операции. Основные положения ERAS имеют мощную доказательную базу и включают в себя работу мультидисциплинарной команды медиков, проведение профилактики тромбоза глубоких вен, тошноты и рвоты, оптимизацию пред- и постоперационной нутритивной поддержки пациента, профилактику кишечной непроходимости (назначение прокинетиков), отказ от предоперационной подготовки кишечника, от постановки назогастрального зонда, от премедикации, использование анестетиков короткого действия, эпидуральной анестезии, пероральных нестероидных противовоспалительных средств (НПВП), отказ от наркотических анальгетиков, удаление дренажей в ранние сроки, контроль инфузии, раннюю мобилизацию. Протоколы ERAS стали важным направлением периоперационного менеджмента пациентов после колоректальных, сосудистых, торакальных операций и после радикальной цистэктомии. Тем не менее они бросают вызов традиционной хирургической доктрине, поэтому, несмотря на достаточную доказательную базу эффективности использования ERAS, внедрение их в клиническую практику происходит очень медленно.
Доклад профессора С.А. Дуброва (Национальный медицинский университет им. А.А. Богомольца, г. Киев) был посвящен современной стратегии ведения пациентов в периоперационном периоде, основанной на применении мультимодальных протоколов улучшения восстановления после оперативных вмешательств ERAS, направленных на максимально быстрое восстановление пациентов для поддержки функций органов на предоперационном уровне и уменьшение стрессового ответа вследствие операции. Основные положения ERAS имеют мощную доказательную базу и включают в себя работу мультидисциплинарной команды медиков, проведение профилактики тромбоза глубоких вен, тошноты и рвоты, оптимизацию пред- и постоперационной нутритивной поддержки пациента, профилактику кишечной непроходимости (назначение прокинетиков), отказ от предоперационной подготовки кишечника, от постановки назогастрального зонда, от премедикации, использование анестетиков короткого действия, эпидуральной анестезии, пероральных нестероидных противовоспалительных средств (НПВП), отказ от наркотических анальгетиков, удаление дренажей в ранние сроки, контроль инфузии, раннюю мобилизацию. Протоколы ERAS стали важным направлением периоперационного менеджмента пациентов после колоректальных, сосудистых, торакальных операций и после радикальной цистэктомии. Тем не менее они бросают вызов традиционной хирургической доктрине, поэтому, несмотря на достаточную доказательную базу эффективности использования ERAS, внедрение их в клиническую практику происходит очень медленно.
Одним из ключевых положений протоколов ERAS является нутритивная поддержка пациентов в периоперационном периоде, поскольку частота нутритивной недостаточности у них колеблется от 27 до 88 % (ESPEN 2000, 2006). В ответ на повреждение тканей, гиповолемию и гипоксию во время хирургического вмешательства в организме стимулируется гипоталамо-гипофизарно-надпочечниковая система. В свою очередь, усиленный синтез адренокортикотропного гормона (АКТГ) и кортизола приводит к катаболизму белков, уменьшению массы тела, слабости мышц и быстрой потере азота, развиваются относительная недостаточность инсулина и периферическая инсулинорезистентность — фактор риска развития послеоперационных осложнений. Регламентированные протоколами ERAS применение эпидуральной анестезии, углеводное питание в предоперационном периоде (в виде жидкостей для питья), контроль болевого синдрома и назначение раннего послеоперационного питания как раз направлены на уменьшение периферической инсулинорезистентности. По данным O. Ljungqvist (2012), применение нутритивной поддержки в рамках протоколов ERAS позволяет сохранить нормальную чувствительность тканей к инсулину в пред- и интраоперационном периоде и в значительной степени уменьшает инсулинорезистентность в пост–операционном периоде по сравнению с применением традиционной хирургической доктрины.
Как известно, одним из самых распространенных осложнений абдоминальной хирургии является кишечная непроходимость. Для профилактики этого осложнения протоколы ERAS рекомендуют проведение эпидуральной анестезии, минимизацию инвазивности при проведении оперативного вмешательства, избежание гиперинфузии жидкости и раннее энтеральное питание.
В заключение доклада профессор С.А. Дубров представил перечень протоколов ERAS, которые в настоящее время имеются в свободном доступе в Интернете, подчеркнув, что их применение в клинической практике ведет к потенциальному увеличению использования ресурсов для более быстрого восстановления пациента при сокращении финансовых затрат как клиники, так и самого больного.
/51/51.jpg) Наиболее значимые моменты, на которых делался акцент на конгрессе ESPEN-2014, представила профессор кафедры анестезиологии, интенсивной терапии и медицины неотложных состояний ФПО ГУ «Днепропетровская медицинская академия МЗ Украины», д.м.н. Е.Ю. Сорокина.
Наиболее значимые моменты, на которых делался акцент на конгрессе ESPEN-2014, представила профессор кафедры анестезиологии, интенсивной терапии и медицины неотложных состояний ФПО ГУ «Днепропетровская медицинская академия МЗ Украины», д.м.н. Е.Ю. Сорокина.
Профессор Е.Ю. Сорокина отметила многочисленность докладов, посвященных медицинским последствиям нутритивной недостаточности, прежде всего нарушениям со стороны ЖКТ, системы иммунитета и скелетной мускулатуры. На конгрессе обсуждалась возможность более широкого внедрения в клиническую практику протоколов ERAS, которые позволяют на 30 % увеличить оборот койки, хирургическую активность и сократить послеоперационные осложнения на 50 %. Акцентировалось внимание на необходимости полного обеспечения потребностей пациентов в белке и энергии (оптимальный уровень белка для пациентов от 1,3 до 2,5 г/кг, энергии — 25–35 ккал/кг с учетом уровня гиперкатаболизма), таких особенностях метаболического ответа у пациентов ОРИТ и отделений хирургии, как усиление катаболизма белка, ранняя потеря мышечной массы (в течение первой недели заболевания) и быстрое истощение пластических и энергетических ресурсов организма (инсулинорезистентность, гиперлактатемия). Для поддержания основных физиологических функций пациента, корректировки метаболизма одним из чрезвычайно важных моментов является обеспечение нутритивной поддержки.
Достаточно много исследований было посвящено проблеме оптимизации методов клинического питания для улучшения результатов лечения. В исследовании Heidegger et al. было продемонстрировано (с использованием непрямой калориметрии), что если пациент получает только энтеральное питание, то к 4-му дню его энергетические и белковые потребности удовлетворяются только на 60 %. Дополнительное введение парентерального питания для 100% возмещения затрат пациента достоверно снижает частоту нозокомиальных инфекций, расход антибактериальных препаратов и длительность ИВЛ. Концепцию проведения комбинированного, или смешанного (энтерального в сочетании с дополнительным парентеральным), питания следует рассматривать в качестве стратегии по улучшению клинического исхода пациентов, для восполнения потребностей которых только энтерального питания недостаточно. Ежедневное введение сбалансированных смесей аминокислот от 1,5 г/кг идеальной массы тела в сутки достоверно способствует ограничению белковых потерь пациента. Оптимальное количество глюкозы должно составлять от 3 до 5 г/кг в сутки. Внутривенные жировые эмульсии (ЖЭ) назначаются в дозе от 0,7 до 1,5 г/кг в течение 12–24 часов. Наиболее оптимальным считается введение жировых эмульсий, обогащенных w-3 жирными кислотами (метаанализ L. Pradelli et al.). ЖЭ, обогащенные w-3 ЖК, безопасны и хорошо переносятся. Послеоперационное парентеральное введение w-3 обогащенных ЖЭ оказывает позитивное влияние на послеоперационный воспалительный ответ и может быть использовано в стандартном послеоперационном уходе, когда есть показания для ПП. Применение ЖЭ, обогащенных w-3 ЖК, обеспечивает преимущества, связанные со статистически и клинически значимым снижением уровня инфекционной заболеваемости, уменьшением длительности пребывания в ОРИТ, улучшением газообмена в легких, снижением маркеров воспаления, улучшением функции печени, антиоксидантного статуса, уменьшением нарушений функции почек и оптимизацией содержания жирных кислот в фосфолипидах плазмы и мембранах клеток.
/52/52.jpg) Доклад д.м.н. А.П. Мазура (ГУ «Национальный институт хирургии и трансплантологии им. А.А. Шалимова НАМН Украины») был посвящен современным европейским тенденциям по нутритивной поддержке пациентов с морбидным ожирением (МО). Данная тема достаточно актуальна в мире, так как на международном уровне ожирение признано эпидемией.
Доклад д.м.н. А.П. Мазура (ГУ «Национальный институт хирургии и трансплантологии им. А.А. Шалимова НАМН Украины») был посвящен современным европейским тенденциям по нутритивной поддержке пациентов с морбидным ожирением (МО). Данная тема достаточно актуальна в мире, так как на международном уровне ожирение признано эпидемией.
При проведении оперативных вмешательств у больных с ожирением в ответ на стресс развивается такой же метаболический ответ, как и у пациентов с нормальной массой тела, — быстрый катаболизм белка, увеличение скорости окисления всех нутриентов и мышечная деградация, то есть пациенты с морбидным ожирением, как и пациенты с нормальной или низкой массой тела, подвержены риску истощения. В связи с этим пациенты с МО, особенно с ИМТ ≥ 35, в периоперационном периоде нуждаются в нутритивной поддержке, однако расчет потребностей таких пациентов имеет свои особенности. Для всех степеней ожирения энергетические потребности следует рассчитывать с 60–70% коррекцией по калориям или из расчета 11–14 ккал/кг/сут (на реальную массу тела) или 22–25 ккал/кг/сут (на идеальную массу тела). Потребности в белке определяются из расчета 2 г/кг идеальной массы тела для пациентов с МО I и II степени (ИМТ 30–40 кг/м2) и 2,5 г/кг идеальной массы тела для пациентов с МО III степени (ИМТ более 40 кг/м2). Не стоит забывать о правилах оптимального усвоения пластического материала, т.е. для оптимального синтеза белка мы должны обеспечить 120–140 ккал небелковой энергии на каждый вводимый грамм азота (что соответствует 6,25 г белка). Для расчета энергетических потребностей пациентов с МО в критическом состоянии наиболее приемлемы формулы Ireton — Jones (1992) и Penn — State (1998). Клиническое питание этой категории пациентов должно быть начато в течение первых 36 часов.
Таким образом, нутритивная поддержка является неотъемлемой составляющей современной концепции лечения пациентов в критическом состоянии, а также пациентов в периоперационном периоде. Четкое соблюдение всех принципов применения клинического питания позволит не только улучшить результаты лечения, минимизировав осложнения и сократив сроки пребывания пациента в ОРИТ и стационаре, но и значительно уменьшить финансовые затраты, связанные с ведением данной категории пациентов.

/50/50_2.jpg)