Журнал «Медицина неотложных состояний» 6 (61) 2014
Вернуться к номеру
Характер морфологических изменений в стенках бронхов, влияющий на риск возникновения послеоперационной несостоятельности культи бронха
Авторы: Бойко В.В. - Харьковский национальный медицинский университет; Институт общей и неотложной хирургии им. В.Т. Зайцева НАМН Украины; Смоляник К.Н. - Харьковский национальный медицинский университет; Козин Ю.И. - Институт общей и неотложной хирургии им. В.Т. Зайцева НАМН Украины; Наумова О.В. - Харьковский национальный медицинский университет
Рубрики: Медицина неотложных состояний, Хирургия
Разделы: Клинические исследования
Версия для печати
Развитие несостоятельности культи бронха (НКБ) после резекции легкого остается актуальной проблемой в торакальной хирургии. По литературным данным, это послеоперационное осложнение встречается в 3–15 % случаев и не имеет тенденции к существенному снижению. После пульмонэктомии несостоятельность культи главного бронха может достигать 25 % с летальностью до 70 %.
Целью исследования явилось изучение характера морфологических изменений бронхиальной стенки в зоне резекции в зависимости от сопутствующей патологии.
Комплексному морфологическому исследованию были подвергнуты резецированные легкие или доли легких больных, оперированных в клиниках города Харькова и ГУ «ИОНХ имени В.Т. Зайцева НАМНУ» (г. Харьков, Украина) за период с 2000 по 2009 г., которым выполнена резекция легкого или пульмонэктомия. Больные были распределены на 3 группы. Критерием распределения больных на группы была сопутствующая патология:
— I группа — 12 больных без сопутствующей патологии (группа сравнения);
— II группа — 12 больных с сопутствующим хроническим бронхитом;
— III группа — 12 больных с сопутствующим системным атеросклерозом.
При однотипной легочной патологии, а также видах и объемах оперативных вмешательств сопутствующая патология, особенно при отсутствии предоперационной ее коррекции, существенно влияет на частоту послеоперационных осложнений, увеличивая риск несостоятельности культи бронха с 8,3 до 16,6 % случаев.
При хронических воспалительных и особенно сосудистых склеротических изменениях в бронхиальных стенках дегенеративно-деструктивные изменения обусловлены хронической гипоксией на фоне дисциркуляторных нарушений, локального гиперкоагуляционного синдрома, ишемической атрофии, гиперколлагеноза и прогрессирующим склерозом наружной адвентиционной оболочки стенок бронхов.
При наличии у подлежащих хирургическому лечению (лоб-, билоб-, пульмонэктомия) больных хронического бронхита или выраженного атеросклеротического поражения сосудистого русла необходима не только адекватная санация бронхиального дерева и сосудисто-тромболитическая подготовка к операции, но и разработка новых, достаточно герметизирующих бронхиальное дерево способов резекции и обработки культи бронха.
Розвиток неспроможності кукси бронха (НКБ) після резекції легені залишається актуальною проблемою в торакальній хірургії. За літературними даними, це післяопераційне ускладнення зустрічається в 3–15 % випадків і не має тенденції до суттєвого зниження. Після пульмонектомії неспроможність кукси головного бронха може досягати 25 % з летальністю до 70 %.
Метою дослідження було вивчення характеру морфологічних змін бронхіальної стінки в зоні резекції залежно від супутньої патології.
Комплексному морфологічному дослідженню були піддані резековані легені або частки легень хворих, оперованих у клініках міста Харкова та ДУ «ІЗНХ імені В.Т. Зайцева НАМНУ» (м. Харків, Україна) за період з 2000 по 2009 р., яким виконана резекція легені або пульмонектомія. Хворі були розподілені на 3 групи. Критерієм розподілу хворих на групи була супутня патологія:
— I група — 12 хворих без супутньої патології (група порівняння);
— II група — 12 хворих із супутнім хронічним бронхітом;
— III група — 12 хворих із супутнім системним атеросклерозом.
При однотипній легеневій патології, а також видах та обсягах оперативних втручань супутня патологія, особливо за відсутності передопераційної її корекції, істотно впливає на частоту післяопераційних ускладнень, збільшуючи ризик неспроможності кукси бронха з 8,3 до 16,6 % випадків.
При хронічних запальних і особливо судинних склеротичних змінах у бронхіальних стінках дегенеративно-деструктивні зміни обумовлені хронічною гіпоксією на тлі дисциркуляторних порушень, локального гіперкоагуляційного синдрому, ішемічної атрофії, гіперколагенозу і прогресуючим склерозом зовнішньої адвентиційної оболонки стінок бронхів.
За наявності у хворих, які підлягають хірургічному лікуванню (лоб-, білоб-, пульмонектомія), хронічного бронхіту або вираженого атеросклеротичного ураження судинного русла необхідна не тільки адекватна санація бронхіального дерева та судинно-тромболітична підготовка до операції, але й розробка нових, достатньо герметизуючих бронхіальне дерево способів резекції та обробки кукси бронха.
Development of bronchial stump dehiscence (BSD) after lung resection remains an urgent problem in thoracic surgery. According to published data, this postoperative complication occurs in 3–15 % of cases and has no tendency to a significant reduction. Main bronchus stump dehiscence after pneumonectomy can reach 25 % with mortality up to 70 %.
Aim of this study was to investigate the nature of the morphological changes in the bronchial wall resection zone depending on comorbidity.
Resected lungs or lung lobes of patients who underwent lung resection or pneumonectomy in clinics of Kharkiv and in State institution «Institute of General and Emergency Surgery named after V.G. Zaytsev of National Academy of Medical Sciences of Ukraine (Kharkiv) for the period from 2000 to 2009, were subjected to a comprehensive morphological study. Patients were divided into 3 groups. The criterion for the distribution of patients into groups was concomitant pathology:
— I group — 12 patients without comorbidity (comparison group);
— II group — 12 patients with concomitant chronic bronchitis;
— III group — 12 patients with concomitant systemic atherosclerosis.
Concomitant pathology, especially in the absence of its preoperative correction, with the same type of lung disease and the types and extent of surgery, significantly influences the incidence of postoperative complications, increasing the risk of bronchial stump dehiscence from 8.3 to 16.6 % of cases.
Degenerative-destructive changes in chronic inflammatory and especially vascular sclerotic changes in the bronchial walls are caused by chronic hypoxia on the background of discirculatory violations, local hypercoagulation syndrome, ischemic atrophy, hypercollagenosis and progressive sclerosis of outer adventitious membrane of bronchial walls.
If patients amenable to surgery (lob-, bilob-, pneumonectomy) have chronic bronchitis or severe atherosclerotic lesions of the vascular bed, there is a need for not only adequate sanitation of the bronchial tree and vascular thrombolytic preparation for surgery, but also the development of new methods for resection and treatment of bronchial stump, which enough seal bronchial tree.
резекция легкого, сопутствующая патология, морфологические изменения.
резекція легені, супутня патологія, морфологічні зміни.
lung resection, concomitant pathology, morphological changes.
Статья опубликована на с. 113-20
Введение
Развитие несостоятельности культи бронха (НКБ) после резекции легкого остается актуальной проблемой в торакальной хирургии. По литературным данным, это послеоперационное осложнение встречается в 3–15 % случаев и не имеет тенденции к существенному снижению. После пульмонэктомии несостоятельность культи главного бронха может достигать 25 % с летальностью до 70 %.
Изучая данную проблему на современном этапе развития торакальной хирургии, многие авторы приходят к выводу, что проблема НКБ больше биологическая, чем техническая. В связи с этим наличие сопутствующей патологии, которая оказывает влияние на предоперационное состояние бронхиальной стенки, а именно на ее репаративные способности, приобретает огромное значение [1, 2].
Целью исследования явилось изучение характера морфологических изменений бронхиальной стенки в зоне резекции в зависимости от сопутствующей патологии.
Материал и методы
Комплексному гистологическому и гистохимическому исследованию были подвергнуты резецированные легкие или доли легких больных, оперированных в клиниках города Харькова и ГУ «ИОНХ имени В.Т. Зайцева НАМНУ» (г. Харьков, Украина) за период с 2000 по 2009 г., которым выполнена резекция легкого или пульмонэктомия. Больные были распределены на 3 группы. Критерием распределения больных на группы была сопутствующая патология:
— I группа — 12 больных без сопутствующей патологии (группа сравнения);
— II группа — 12 больных с сопутствующим хроническим бронхитом;
— III группа — 12 больных с сопутствующим системным атеросклерозом.
Оперативные вмешательства у больных были выполнены во всех группах по поводу периферических доброкачественных и злокачественных новообразований легких с минимальным влиянием основного заболевания на состояние бронхиальной стенки. Культя бронха во время резекции легкого обрабатывалась механическим швом при помощи сшивающего аппарата УКЛ-40 с дополнительным укреплением отдельными узловыми швами.
Как видно из табл. 1, больные равномерно распределены по основному диагнозу и объему операции во всех группах.
Материалом для морфологического исследования послужили резецированные легкие или доли легких больных из всех исследуемых групп. Материал фиксировали в 10% нейтральном формалине, после чего кусочки бронхов иссекались непосредственно в зоне резекции с прилегающими тканями толщиной около 0,004 м. Материал подвергали спиртовой проводке и парафиновой заливке, изготавливали срезы толщиной 5–6 мкм. Обзорные препараты, окрашенные гематоксилином и эозином, использовались для общей оценки состояния исследуемых тканей. Окрашивание препаратов пикрофуксином по методу ван Гизона использовалось для выявления соединительнотканных структур. Гистологические и гистохимические методики выполнялись по прописям, изложенным в руководствах по гистологической технике и гистохимии [3, 4].
Результаты исследования и их обсуждение
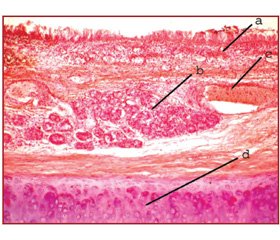
Группа I (без сопутствующей патологии). При микроскопическом исследовании препаратов удаленного легкого или доли легкого в хорошо выраженном просвете бронхов крупного калибра содержится небольшое количество эозинофильной слизи с примесью десквамированных клеток бронхиального эпителия. Слизистая оболочка неравномерно складчатая, выстлана многорядным реснитчатым эпителием с умеренно эозинофильной цитоплазмой, мелкими округлыми базально расположенными ядрами, с наличием бокаловидных клеток. Базальная мембрана эпителия тонкая, непрерывная. Собственная пластинка слизистой оболочки представлена продольно расположенными тонкими соединительнотканными волокнами, которые при окраске пикрофуксином по ван Гизону окрашиваются в кирпично-красный цвет. Между волокнами заложены сосуды капиллярного типа (разветвления легочной артерии, бронхиальных артерий, легочных и бронхиальных вен) с тонкой умеренно фуксинофильной стенкой, хорошо выраженными просветами, содержащими умеренное количество форменных элементов крови. Сосуды выстланы удлиненной формы эндотелиоцитами со слабобазофильной цитоплазмой и округлым или овальным базофильным ядром. Преимущественно периваскулярно визуализируются немногочисленные фибробласты, лимфоциты, единичные макрофаги. Изредка встречаются мелкие лимфатические узелки. Мышечная пластинка слизистой оболочки бронхов состоит из 3–5 рядов гладкомышечных клеток с несколько вытянутыми слабобазофильными ядрами и эозинофильной цитоплазмой.
В подслизистой соединительнотканной основе бронхов определяются пучки продольно ориентированных фуксинофильных соединительнотканных волокон и пластинки гиалинового хряща, формирующие фиброзно-хрящевой слой. По периферии пластинок гиалинового хряща содержится большое количество хондробластов, в центральных отделах — хондроцитов, часть последних — с пикнотически сморщенными ядрами (рис. 1).
/115/115.jpg)
В участках подслизистой основы, лишенных гиалинового хряща, заложены группы бронхиальных желез, выстланных крупными эпителиоцитами со светлой, в части клеток оптически пустой цитоплазмой и овальным базофильным ядром. Выводные протоки желез проникают в слизистый слой и открываются на поверхности реснитчатого эпителия (рис. 2). В мелких артериальных и венозных сосудах подслизистой основы содержится умеренное количество форменных элементов крови. Стенка сосудов тонкая, умеренно фуксинофильная, выстлана эндотелиоцитами с округлым базофильным ядром и слабобазофильной цитоплазмой, лежащими на непрерывной базальной мембране. В средней оболочке сосудов обнаруживаются гладкие мышечные клетки с вытянутыми базофильными ядрами и слабоэозинофильной цитоплазмой (рис. 3). Кое-где визуализируются лимфатические узелки.
Наружная адвентициальная оболочка стенки бронхов представлена волокнистой соединительной тканью, волокна которой при окраске пикрофуксином по ван Гизону окрашиваются в кирпично-красный цвет. Между волокнами определяются немногочисленные фибробласты, лимфоциты, макрофаги, тканевые базофилы.
В перибронхиальной жировой ткани заложены умеренно кровенаполненные сосуды — вены и артерии мышечного типа с четким делением стенки на внутренний, средний и наружный слои, выстланные уплощенными эндотелиоцитами с округлым базофильным ядром и слабобазофильной цитоплазмой. Здесь же встречаются интрамуральные нервные ганглии, покрытые умеренно фуксинофильной соединительнотканной капсулой, прослойки которой проникают в паренхиму узла. Расположенные между ними ганглиозные клетки — с несколько набухшей слабоэозинофильной цитоплазмой и овальным или вытянутым базофильным ядром с неравномерным расположением хроматина.
В прилегающей легочной ткани просветы альвеол хорошо выражены, свободны от содержимого, в просвете некоторых альвеол встречаются альвеолярные макрофаги. Единичные альвеолы с расширенными просветами. Внутренняя поверхность альвеол выстлана эпителиоцитами, среди которых встречаются альвеолярные макрофаги. Базальная мембрана эпителия тонкая, умеренно фуксинофильная. Альвеолы разделены межальвеолярными перегородками, в которых при окраске по ван Гизону определяются тонкие фуксинофильные соединительнотканные волокна, между которыми визуализируются лимфоциты, макрофаги, тканевые базофилы, единичные нейтрофилы. Многочисленные умеренно кровенаполненные кровеносные капилляры межальвеолярных перегородок прилежат к базальной мембране альвеолярного эпителия, выстланы эндотелиоцитами с округлым базофильным ядром и слабобазофильной цитоплазмой. Вокруг сосудов встречаются мелкие скопления лимфоидной ткани.
При микроскопическом изучении морфофункциональных компонентов легких их гистологическая картина структурно и гистохимически приближается к нормальному строению изучаемого органа, что позволяет рассматривать исследуемую группу как правильно подобранную в качестве группы сравнения.
Группа II (с сопутствующим хроническим бронхитом). В препаратах удаленного легкого или доли легкого больных из исследуемой группы микроскопически в части наблюдений просвет бронхов равномерно сужен, в части неравномерно выражен вследствие деформации стенки. В просвете бронхов содержится умеренное количество слизисто-гнойного экссудата с примесью десквамированных эпителиоцитов. Слизистый слой истонченный, неравномерно складчатый. В реснитчатом многорядном эпителии, выстилающем стенку бронха, снижено количество рядов клеток. Эпителиоциты с мелкими округлыми базально расположенными ядрами, умеренно –эозинофильной цитоплазмой. Количество бокаловидных клеток увеличено. В одном наблюдении призматический эпителий очагово замещен многослойным плоским эпителием. Очагово слизистая оболочка лишена эпителиальной выстилки с деструкцией подлежащей базальной мембраны. Вне описанных очагов фуксинофильная базальная мембрана эпителия утолщена, непрерывна. Собственная пластинка слизистого слоя истончена, склерозирована, диффузно инфильтрирована лимфоцитами, гистиоцитами, нейтрофилами. В большинстве наблюдений воспалительная клеточная инфильтрация распространяется на всю стенку бронха до перибронхиальной клетчатки и переходит на легочную ткань. В половине наблюдений в слизистой оболочке очагово наблюдается разрастание грануляционной ткани, выступающей в просвет бронха в виде полипов (рис. 4). Стенка сосудов собственной пластинки утолщена, фуксинофильна, просветы расширены, избыточно кровенаполнены. Выстилающий сосуды эндотелий очагово десквамирован, очагово пролиферирован. Эндотелиоциты со слабобазофильной цитоплазмой и округлым базофильным ядром, выступающим в просвет сосуда. Мышечная пластинка слизистой оболочки представлена 2–3 рядами гладкомышечных клеток, склерозирована.
В подслизистом слое избыточно развит фиброзный слой, представленный грубыми пучками интенсивно фуксинофильных продольно расположенных коллагеновых волокон. В участках гиалинового хряща количество хондробластов уменьшено, большинство хондроцитов с дистрофическими и некробиотическими изменениями, кариопикнозом. Бронхиальные железы встречаются в виде отдельных групп с кистовидно расширенными просветами (рис. 5). Сосуды подслизистой основы полнокровны, с очагами десквамации и пролиферации эндотелия. Просветы венозных сосудов расширены вследствие снижения тонуса сосудистой стенки. Стенка артериол утолщена, фуксинофильна. Лимфатические узелки собственной пластинки и подслизистого слоя гиперплазированы.
Наружная адвентициальная оболочка стенки бронхов утолщена за счет избыточного развития грубых пучков коллагеновых волокон, интенсивно фуксинофильных при окраске по ван Гизону. Между волокнистыми структурами определяются многочисленные фибробласты и фиброциты (рис. 5). Перибронхиальная клетчатка с избыточным развитием коллагеновых волокон, с полнокровием расширенных вен, склерозом стенки артерий, очаговой десквамацией и пролиферацией эндотелия и сужением их просвета, изредка наличием тромбов. Интрамуральные нервные ганглии перибронхиальной клетчатки с утолщенной фуксинофильной соединительнотканной капсулой. Ганглиозные клетки с набухшей цитоплазмой; центральным, иногда тотальным хроматолизисом и пролиферацией глиальных клеток-сателлитов. Иногда отмечается сморщивание нервных клеток и их ядер.
В прилегающей легочной ткани межальвеолярные перегородки утолщены, фиброзированы, с диффузной воспалительно-клеточной инфильтрацией (рис. 6). Очагово перегородки альвеол истончены, их просветы эмфизематозно вздуты. Эпителий альвеол очагово десквамирован, с наличием в просвете альвеолярных макрофагов, глыбок гемосидерина. Кровеносные сосуды межальвеолярных перегородок со сниженным тонусом, расширены, полнокровны, с мелкоочаговыми периваскулярными кровоизлияниями, скоплениями гемосидерина. Эндотелий сосудов очагово десквамирован и пролиферирован, изредка с наличием тромбов (рис. 6).
/117/117.jpg)
Данные микроскопического исследования препаратов удаленных легких или долей легких больных из изучаемой группы показали, что в условиях хронического воспаления в стенке бронха и прилегающих тканях развиваются дистрофические, атрофические, дисрегенераторные и деструктивные изменения (метаплазия призматического эпителия, наличие язвенных дефектов и полиповидных разрастаний слизистой оболочки, гиперплазия и кистовидное превращение бронхиальных желез), дисциркуляторные процессы (венозное полнокровие сосудов бронха и окружающих тканей, наличие тромбов в сосудах перибронхиальной ткани), выраженные склеротические процессы в соединительной ткани и стенке сосудов с нарушением васкуляризации стенки бронха. Выявленные патологические процессы обусловливают значительное ухудшение местных условий регенерации тканей бронха и способствуют в послеоперационном периоде формированию несостоятельности культи бронха.
Группа III (с сопутствующим системным атеросклерозом). Микроскопически в препаратах удаленного легкого или доли легкого больных из исследуемой группы просветы бронхов хорошо выражены, содержат умеренное количество эозинофильной слизи со слущенными клетками реснитчатого эпителия. Слизистая оболочка несколько истонченная, неравномерно складчатая, количество рядов реснитчатого эпителия уменьшено по сравнению с группой сравнения, очагово он десквамирован. Эпителиоциты с мелкими округлыми базально расположенными ядрами, умеренно эозинофильной цитоплазмой. Базальная мембрана эпителия при окраске по ван Гизону интенсивно фуксинофильная, неравномерно утолщенная, непрерывная. Собственная пластинка слизистой оболочки сужена, продольно расположенные фуксинофильные коллагеновые волокна ее несколько утолщены, складываются в пучки. Сосуды капиллярного типа собственной пластинки полнокровны, с утолщенной фуксинофильной стенкой, неравномерно выраженными просветами. Выстилающий сосуды эндотелий очагово десквамирован, эндотелиоциты со слабобазофильной цитоплазмой и округлым или овальным базофильным ядром, выступающим в просвет сосуда. Между пучками коллагеновых волокон и очагово вокруг сосудов встречаются лимфоциты, многочисленные фибробласты, единичные макрофаги. Изредка визуализируются мелкие лимфатические узелки. Мышечная пластинка слизистой оболочки бронхов истончена, состоит из 2–3 рядов гладкомышечных клеток с несколько вытянутыми слабобазофильными ядрами и эозинофильной цитоплазмой.
В подслизистой соединительнотканной основе пучки продольно ориентированных коллагеновых волокон фиброзно-хрящевого слоя утолщены, интенсивно фуксинофильны, тесно прилежат друг к другу (рис. 7).
/118/118.jpg)
В пластинках гиалинового хряща снижено количество хондробластов, большое количество хондроцитов с пикнотическими ядрами. Количество групп бронхиальных желез в стенке бронха уменьшено, с разрастанием на их месте соединительной ткани, в группах сохранившихся желез их количество увеличено, протоки их расширены (рис. 8). Венозные сосуды со сниженным тонусом, расширены, полнокровны, артериолы с несколько утолщенной фуксинофильной стенкой. Сосуды выстланы эндотелиоцитами с округлым базофильным ядром и слабобазофильной цитоплазмой. Отмечается очаговая десквамация эндотелия. Изредка встречаются лимфатические узелки.
Коллагеновые волокна наружной адвентициальной оболочки стенки бронхов интенсивно фуксинофильные, складываются в утолщенные плотные волокна со значительным количеством фибробластов между ними. В перибронхиальной клетчатке определяются расширенные полнокровные венозные сосуды, артерии мышечного типа с избыточным развитием фуксинофильных коллагеновых волокон во всех слоях стенки и сужением просвета, очаговой десквамацией эндотелия; интрамуральные нервные ганглии, покрытые несколько утолщенной фуксинофильной соединительнотканной капсулой. Ганглиозные клетки характеризуются набуханием цитоплазмы; центральным, иногда тотальным хроматолизисом и пролиферацией глиальных клеток-сателлитов. Иногда отмечается сморщивание нервных клеток и пикноз ядер (рис. 9).
В прилегающей легочной ткани выражены просветы альвеол, с наличием в просвете альвеолярных макрофагов, глыбок гемосидерина. Внутренняя поверхность альвеол выстлана эпителиоцитами, среди которых встречаются альвеолярные макрофаги. Межальвеолярные перегородки утолщены, с избыточным развитием фуксинофильных коллагеновых волокон, с наличием между ними фибробластов, многочисленных лимфоцитов с примесью макрофагов, тканевых базофилов, нейтрофилов. Встречаются группы альвеол с эмфизематозно расширенными просветами и истонченными перегородками. Кровеносные капилляры межальвеолярных перегородок со сниженным тонусом, расширены, полнокровны, с мелкоочаговыми периваскулярными кровоизлияниями, скоплениями гемосидерина. Вокруг сосудов определяются мелкие скопления лимфоидной ткани.
При микроскопическом изучении препаратов удаленных легких или долей легких больных из исследуемой группы во всех слоях стенки бронха, перибронхиальной клетчатке и прилегающей легочной ткани выявляются дисциркуляторные, дистрофические, склеротические и атрофические изменения ее структурных компонентов, что обусловлено хронической гипоксией, развивающейся вследствие атеросклеротического поражения сосудов. Можно предположить, что выявленные патологические изменения тканей способствовали торможению и ухудшению репаративного процесса в культе бронха с развитием ее несостоятельности в послеоперационном периоде.
Были проанализированы результаты хирургического лечения в группах с сопутствующей патологией и без нее. Приведенные выше данные (табл. 2) говорят о том, что наиболее неблагоприятно на заживлении культи бронха сказывается наличие в качестве сопутствующей патологии системного атеросклероза.
Выводы
1. При однотипной легочной патологии, а также видах и объемах оперативных вмешательств сопутствующая патология, особенно при отсутствии предоперационной ее коррекции, существенно влияет на частоту послеоперационных осложнений, увеличивая риск несостоятельности культи бронха с 8,3 до 16,6 % случаев.
2. При хронических воспалительных и особенно сосудистых склеротических изменениях в бронхиальных стенках дегенеративно-деструктивные изменения обусловлены хронической гипоксией на фоне дисциркуляторных нарушений, локального гиперкоагуляционного синдрома, ишемической атрофии, гиперколлагеноза и прогрессирующим склерозом наружной адвентиционной оболочки стенок бронхов.
3. При наличии у подлежащих хирургическому лечению (лоб-, билоб-, пульмонэктомия) больных хронического бронхита или выраженного атеросклеротического поражения сосудистого русла необходима не только адекватная санация бронхиального дерева и сосудисто-тромболитическая подготовка к операции, но и разработка новых, достаточно герметизирующих бронхиальное дерево способов резекции и обработки культи бронха.
1. Бисенков Л.Н. Эндоскопическое лечение бронхиальных свищей подслизистыми инъекциями / Л.Н. Бисенков, Р.Ш. Биходжин // Вестник хирургии им. И.И. Грекова. — 2005. — Т. 164, № 1. — С. 38-41.
2. Гнойные заболевания легких и плевры / В.В. Бойко, А.К. Флорикян, Ю.В. Авдосьев [и др.] / Под. ред. В.В. Бойко, А.К. Флорикяна. — Х.: Прапор, 2007. — 576 с.
3. Лилли Р. Патогистологическая техника и практическая гистохимия / Р. Лили. — М.: Мир, 1960. — 648 с.
4. Пирс Э. Гистохимия (теоретическая и прикладная) / Э. Пирс — М.: Иностранная литература, 1962. — 962 с.

/114/114.jpg)
/115/115_2.jpg)
/116/116.jpg)
/118/118_2.jpg)
/119/119.jpg)