Международный эндокринологический журнал 2 (66) 2015
Вернуться к номеру
Уміст діабетасоційованих автоантитіл до острівцевих автоантигенів (IA-2A, GADA, IAA) і рівень різних видів цитокінів у дітей та підлітків на доклінічній і ранній клінічній стадіях розвитку цукрового діабету 1-го типу
Авторы: Попова В.В. — ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
У статті наведені дані щодо імунологічних механізмів розвитку цукрового діабету 1-го типу (ЦД-1) на доклінічній і ранній клінічній стадіях формування захворювання на підставі дослідження особливостей патогенезу ЦД-1, моніторингу процесів автоімунної деструкції інсулінпродукуючих ß-клітин за визначенням умісту діабетасоційованих автоантитіл (ДААт) (частота та динаміка титрів) та вивчення особливостей секреції цитокінів на доклінічному етапі розвитку ЦД-1 у дітей та підлітків. Висвітлення нових підходів до доклінічної діагностики ЦД-1 дозволило окреслити групу маркерпозитивних дітей з обтяженою спадковістю та прогнозованим ризиком розвитку захворювання. Обстежено 450 практично здорових нормоглікемічних дітей та підлітків віком від 7 до 15 років. Виявлено, що в 94 (26,7 %) із 366 дітей з обтяженою спадковістю за не менше ніж дворазового визначення в них ДААт спостерігався підвищений їх титр, переважно GADA і IA-2A; у 49 (52,1 %) із них у період від 6 міс. до 12 років (30,9 ± 3,2 міс.) маніфестував клінічний дебют ЦД-1. Із 272 (73,3 %) ДААт-негативних дітей за цей же період ЦД-1 розвинувся в однієї дитини, тобто в 0,8 %. Визначено формулу поєднаної виявлення та значень одночасно підвищених титрів ДААт до острівцевих автоантигенів, а саме IA-2A + GADA, що є предиктором як тривалості доклінічної стадії розвитку ЦД-1, так і швидкості дебюту. Встановлено також порушення продукції цитокінів (підвищення рівня прозапальних цитокінів ІЛ-1α, ІЛ-6 і ФНП-α, ІЛ-8 і ІЛ-16 при одночасному зниженні концентрації ІЛ-4 в плазмі крові) як ключового чинника патогенезу ЦД-1, що зумовлює як швидкість дебюту ЦД-1, так і агресивність його перебігу.
В статье приводятся данные об иммунологических механизмах развития сахарного диабета 1-го типа (СД-1) на доклинической и ранней клинической стадиях формирования заболевания на основании исследования особенностей патогенеза заболевания, мониторинга процессов аутоиммунной деструкции инсулинпродуцирующих β-клеток по определению содержания диабетассоциированных аутоантител (ДААт) (частота встречаемости и динамика титров), изучения особенностей секреции цитокинов на доклиническом этапе развития СД-1 у детей и подростков. Освещение новых подходов к доклинической диагностике СД-1 позволило определить группу маркерпозитивных детей с отягощенной наследственностью и прогнозируемым риском развития заболевания. Обследовано 450 практически здоровых нормогликемических детей и подростков в возрасте от 7 до 15 лет. Выявлено, что у 94 (26,7 %) из 366 детей с отягощенной наследственностью при не менее чем двукратном определении у них ДААт наблюдался повышенный их титр, преимущественно GADA и IA-2A; у 49 (52,1 %) из них в период от 6 мес. до 12 лет (30,9 ± 3,2 мес.) манифестировал клинический дебют СД-1. Из 272 (73,3%) ДААт-отрицательных детей за этот же период СД-1 развился у одного ребенка, то есть в 0,8 % случаев. Определена формула сочетанной встречаемости и значений одновременно повышенных титров ДААт к островковым аутоантигенам, а именно IA-2A + GADA, что является предиктором как продолжительности доклинической стадии развития СД-1, так и скорости дебюта. Установлено также нарушение продукции цитокинов (повышение уровня провоспалительных цитокинов ИЛ-1α, ИЛ-6 и ФНО-α, ИЛ-8 и ИЛ-16 при одновременном снижении концентрации ИЛ-4 в плазме крови) как ключевых факторов патогенеза СД-1, обусловливающих как скорость дебюта СД-1, так и агрессивность его течения.
The article provides the data on the immunological mechanisms of type 1 diabetes mellitus (T1DM) on the preclinical and early clinical stages of disease formation on the basis of studying the features of T1DM pathogenesis, monitoring the process of autoimmune destruction of insulin-producing β-cells by determining the content of diabetes-associated auto-antibodies (the incidence and titers dynamics), the study of the characteristics of cytokine secretion on the pre-clinical stage of T1DM development in children and adolescents. Introduction of new approaches to pre-clinical diagnosis of T1DM allowed determine the group of marker-positive children with burdened heredity and predictable risk of disease development. The study involved 450 healthy normoglycemic children and adolescents aged from 7 to 15 years old. It was revealed that 94 (26.7 %) of 366 children with burdened hereditary by at least two-fold determination of DAAb had an increased DAAb titer, mainly GADA and IA-2A, the clinical debut of T1DM manifested in 49 (52.1 %) of them from 6 months to 12 years (30.9 ± 3.2 months). T1DM developed in the same period in a child, that was 0.8 % of the 272 (73.3 %) DAAb-negative children. There was determined a formula of combined incidence and values of simultaneously elevated DAAb titers to islet autoantigens, namely IA-2A + GADA, which are predictor of the duration of T1DM pre-clinical stage and debut occurrence. It has been also established a disturbance of cytokine production (increased level of pro-inflammatory cytokines IL-1α, IL-6 and FNO-α, IL-8 and IL-16 while reduced concentration of IL-4 in blood plasma) as a key factor in the T1DM pathogenesis that causes the debut occurrence, and aggressiveness of its course.
цукровий діабет 1-го типу, діти та підлітки, діабетасоційовані автоантитіла, автоантитіла до декарбоксилази глутамінової кислоти, автоантитіла до протеїну тирозинфосфатази (IA-2A), цитокіни ІЛ-1α, ІЛ-4, ІЛ-6, ФНП-α, ІФН-γ, ІЛ-8, ІЛ-16.
сахарный диабет 1-го типа, дети и подростки, диабетассоциированные аутоантитела, аутоантитела к декарбоксилазе глутаминовой кислоты, аутоантитела к протеину тирозинфосфатазы (ІA-2A), цитокины ИЛ-1α, ИЛ-4, ИЛ-6, ФНО-α, ИФН-γ, ИЛ-8, ИЛ-16.
type 1 diabetes mellitus, children and adolescents, diabetes-associated auto-antibodies, auto-antibodies to glutamic acid decarboxylase, auto-antibodies to tyrosine phosphatase protein (IA-2A), cytokines IL-1α, IL-4, IL-6, TNF-α, IFN-γ, IL-8 and IL-16.
Статья опубликована на с. 138-146
Вступ
Актуальність вивчення цукрового діабету 1-го типу (ЦД-1) як найгострішої медико-соціальної проблеми, що відноситься до пріоритетів національних програм охорони здоров’я практично всіх країн світу, призвела до зростання кількості фундаментальних і прикладних досліджень його патогенезу [3–5, 8, 31, 35, 36]. Перше місце в цих дослідженнях належить ідентифікації імунологічних маркерів схильності до ЦД-1, тобто діабетасоційованих автоантитіл (ДААт) до острівців Лангерганса (ОЛ) [6, 14, 20, 25, 26, 28]. Визначення ДААт стало невід’ємним клінічним інструментом для предикції можливого розвитку ЦД-1 у практично ще здорової людини, більш поглибленого дослідження прихованих імунологічних механізмів у латентний доклінічний період, що призводять до маніфестації ЦД-1 у людини, та скринінгу для відбору пацієнтів до групи ризику задовго до розвитку в них захворювання. Значною віхою в розкритті патогенезу ЦД-1 стало також відкриття численних гормоноподібних імунорегуляторів — цитокінів, завдяки чому виникла можливість з’ясування складних механізмів, що запускають патологічні процеси та призводять зрештою до деструкції клітин. Широке впровадження дослідження ДААт у практику клінічної ендокринології й стандартизація методів їх визначення згідно з протоколами ВООЗ зумовили створення національних багатоцентрових довгострокових програм щодо вивчення механізмів доклінічного розвитку ЦД-1. До недавнього часу в Україні не проводили проспективних досліджень з ідентифікації пацієнтів, позитивних за вмістом діабетасоційованих автоантитіл, на латентній стадії формування захворювання в дітей та підлітків з обтяженою спадковістю за ЦД-1, аналогічних багатоцентровим міжнародним програмам. Спрямування вектора нашого дослідження обумовлене також тим, що дані наукової літератури, які доступні на сьогодні, в основному висвітлюють аналіз аналогічних показників імунітету в дітей з діагнозом як уперше виявленого, так і тривалого ЦД-1, тоді як інформація про стан імунних механізмів у доклінічний прихований період розвитку ЦД-1 украй обмежена й суперечлива. Усе викладене вище зумовило актуальність дослідження клініко-імунологічних аспектів розвитку ЦД-1 та доклінічної діагностики захворювання в дітей та підлітків.
Мета — виявлення клініко-імунологічних механізмів патогенезу цукрового діабету 1-го типу на доклінічній та ранній клінічній стадіях його розвитку й розробка нових підходів до доклінічної діагностики захворювання в дітей та підлітків.
Матеріали і методи
Оцінка ступеня компенсації порушеного вуглеводного обміну за розвитку ЦД-1 здійснювалася відповідно до рекомендацій (ISPAD, 2007). Для оцінки вуглеводного обміну визначали рівень глюкози в плазмі венозної крові натще за допомогою глюкозооксидазного методу в акредитованій лабораторії. Рівень глікемії в капілярній крові або в плазмі крові (ПК) з вени оцінювали глюкозооксидазним методом чи за допомогою глюкометра «Supreme Petit», застосовуючи тестові смужки фірми «Hypoguard Supreme». Якщо глікемію натще вимірювали в сироватці цільної крові, то відповідну концентрацію глюкози в ПК обчислювали за рівнянням: Гпн = Гкн х 1,11 ммоль/л, де Гпн — концентрація глюкози в плазмі натще, Гкн — концентрація глюкози в капілярній крові натще. Межі рівня глюкози в капілярній крові натще за цією методикою становили 3,6–5,5 ммоль/л. Для виключення або підтвердження порушеної толерантності до вуглеводів у всіх обстежуваних був виконаний пероральний тест на толерантність до глюкози згідно з методикою, наведеною в наказі № 582 МОЗ України від 15.12.2003 р. При оцінці результатів толерантність до глюкози вважали нормальною, якщо рівень глюкози в плазмі венозної крові натще був меншим за 6,1 ммоль/л, а через 2 год після навантаження глюкозою — меншим за 7,8 ммоль/л. Якщо рівень глюкози натще не перевищував 6,1 ммоль/л, але через 2 год знаходився в межах 7,8–11,1 ммоль/л, то стан класифікували як порушення толерантності до глюкози. Для оцінки компенсації вуглеводного обміну в дітей та підлітків, хворих на ЦД-1, і констатації наявності метаболічних маркерів доклінічної стадії ЦД-1 досліджували рівень глікованого гемоглобіну (HbA1c) в крові. Уміст HbAlc визначався на фотоколориметрі ВТs–330 за допомогою набору «Глікований гемоглобін» фірми «Lachema» (Чехія). З метою виявлення наявності автоімунного процесу в підшлунковій залозі використовували радіоімунологічний метод для визначення ДААт: GADA, ІА-2А і IAA. Кількісне визначення концентрацій ДААт у крові виконували, керуючись інструкцією виробника, із використанням спеціальних наборів для дослідження їхнього вмісту («Immunotech», Чехія, і «CIS Bio International», Франція) на γ-лічильнику «Beckman Gamma 5500B» (США). Нормальний рівень автоантитіл — GADА і ІА-2A був меншим за 1 Од/мл, а рівень автоантитіл — ІАА був меншим за 5,5 од/мл. Концентрацію різних видів цитокінів (ІЛ-1α, ІЛ-β, ІЛ-4, ІЛ-6, ІЛ-10, ФНП-α, ІФН-γ) та хемокінів (ІЛ-8 і ІЛ-16) в ПК вивчали імуноферментним методом ELISA з використанням спектрофотометра Star fax 3200 фірми «Star» (США) та набору реактивів фірми «Diaclone» (Франція). Статистичний аналіз даних здійснювали на підставі пакетів прикладних програм Microsoft Excel та SPSS 11 (SPSS Inc., USA) з використанням параметричних і непараметричних методів статистичного аналізу. За умови нормального розподілення даних вони наведені у вигляді як середніх арифметичних значень із стандартним відхиленням від середньої арифметичної величини (M ± σ), так і середніх значень та їхньої стандартної помилки (M ± m), при відсутності нормального розподілу даних у ряді наведено показники медіани (Ме). Для порівняння двох груп за кількісними нормально розподіленими ознаками застосовували t-критерій Стьюдента. Вірогідними вважали відмінності при рівні вірогідності р < 0,05. Усі статистичні розрахунки виконували при рівні значущості 95 %, р = 0,05. При аналізі непараметричних якісних порядкових ознак порівнювали частки за кожним із показників у двох групах пацієнтів із використанням критерію Манна — Уїтні U, а також відсотка. Взаємозв’язок між двома ознаками оцінювався за допомогою кореляційного аналізу з обчисленням коефіцієнта Пірсона r у випадках лінійного зв’язку кількісних ознак та з обчисленням коефіцієнта рангової кореляції Спірмена rs у випадках нелінійного зв’язку кількісних ознак. Критичний рівень значущості для перевірки статистичних гіпотез при порівнянні груп приймався такий, що становив 0,05.
Результати і їх обговорення
Протягом 12 років у рамках Державної програми «Цукровий діабет» обстежено 450 дітей і підлітків обох статей у віковому діапазоні від 7 до 15 років (середній вік — 12,34 ± 0,82 року). З числа обстежених 450 практично здорових дітей 366 (81,3 %) — основна група — діти та підлітки з нормоглікемією, які мали родичів, хворих на ЦД-1, першого ступеня спорідненості (батьки). Ця група дітей за результатами виконаного радіоімунологічного дослідження на наявність одночасно підвищеного титру ДААт, а саме IAA, ІА-2A і GADA, була поділена на дві великі підгрупи. ДААт-позитивну становили 94 (26,7 %) дітей; необхідним критерієм включення до неї була обов’язкова наявність за дворазового визначення одночасно підвищеного титру не менше двох видів ДААт до антигенів ОЛ, переважно GADA і ІА-2A. ДААт-негативну групу складали 272 (74,3 %) пацієнти з нормальним рівнем глікемії й з відсутністю одночасно підвищеного титру ДААт при дворазовому обстеженні на початку проспективного спостереження. Ще одна група з’явилася як логічне хронологічне завершення автоімунного процесу в групі ДААт-позитивних (ДААт+) дітей — група дітей з дебютом ЦД-1. Її склали 49 дітей (52,1 %), які поступово впродовж від 6 міс. до 12 років (у середньому 30,9 ± 3,2 міс.) змінили свій нормоглікемічний ДААт-позитивний статус практично здорових дітей на статус пацієнтів із клінічним дебютом ЦД-1. 84 практично здорових нормоглікемічних дітей (18,7%) склали контрольну групу (рис. 1).
Найвища частота виявлення всіх трьох видів ДААт була діагностована в групі дітей ДААт+: IAA — у 87 дітей (92,56 %), GADA — у 79 дітей (84,6 %), ІА-2A — у 72 (76,59 %). У групі дітей ДААт+ з клінічним дебютом IAA були виявлені у 42 осіб (85,71 %), GADA — у 39 (79,59 %), ІА-2A — у 35 (71,43 %). Оскільки одним із критеріїв включення дітей із спадковою обтяженістю щодо ЦД-1 в групі ДААт+ була наявність поєднаного підвищення не менше двох видів ДААт при дворазовому обстеженні, нами були визначені середні значення початкових і фінальних (переддебютних) рівнів титрів ДААт (IAA, GADA і ІА-2A) у дітей в доклінічний період розвитку ЦД-1. Було показано, що найвищі значення титрів автоантитіл ІА-2А — 18,96 ± 1,95 Од/мл, GADА — 17,26 ± 1,95 Од/мл, IAA — 14,82 ± 1,372 Од/мл порівняно з аналогічними показниками в групі ДААт-позитивних дітей на ранній стадії розвитку ЦД-1 (ІА-2А — 6,83 ± 0,88 Од/мл (p < 0,001), GADА — 12,46 ± 1,36 Од/мл (p < 0,001), IAA — 9,04 ± 0,77 Од/мл (p < 0,001)) і у дітей з клінічним дебютом ЦД-1 (ІА-2А — 12,65 ± 1,40 Од/мл (p < 0,001), GADА — 13,69 ± 1,023 Од/мл (p < 0,001) і IAA — 11,05 ± 1,20 Од/мл (p < 0,05)) ми отримали в групі ДААт-позитивних дітей на пізній доклінічній стадії розвитку ЦД-1, що передувала в хронологічному аспекті клінічному дебюту ЦД-1 (рис. 2).
/140/140_2.jpg)
Була визначена проспективна патогенетична пріоритетність підвищених титрів ІА-2A і GADA порівняно з умістом IAA на доклінічній і ранній клінічній стадіях розвитку ЦД-1 у ДААт+-дітей та підлітків. Максимально вірогідно підвищені титри IAA, GADA і ІА-2A порівняно з титрами в дітей ДААт+ на ранній стадії розвитку ЦД-1 і в дітей з клінічним дебютом ЦД-1 відзначалися в групі ДААт+-дітей на пізній латентній стадії розвитку ЦД-1, наближеної за часом до клінічного дебюту ЦД-1 [11, 15, 33, 37]. Знижена частота детекції ДААт і нижчі значення їхніх рівнів, зареєстровані нами в дітей з уперше виявленим ЦД-1, порівняно з групою ДААт+-дітей на пізніх доклінічних стадіях розвитку підтверджує завершення автоімунної деструкції десенсибілізуючих автоантигенів і, як результат, зниження раніше підвищених титрів ДААт, що знаходить своє підтвердження в останніх публікаціях [9, 20, 24, 27].
Поєднане виявлення й значення одночасно підвищених титрів діабетасоційованих автоантитіл до острівцевих автоантигенів (ІА-2A, GADA і IAA) у різні періоди формування й розвитку ЦД-1 у дітей та підлітків
Як відомо, необхідною і домінантною умовою включення обстежених дітей та підлітків із спадковою обтяженістю щодо ЦД-1 в групу ДААт+-дітей була наявність дворазового одночасного підвищення титрів не менше двох видів діабетасоційованих автоантитіл до острівцевих автоантигенів. Нами було встановлено формулу одночасного поєднаного підвищення титрів двох із досліджених трьох видів діабетасоційованих автоантитіл. Було встановлено, що при включенні в групу ДААт+-дітей у обстежених дітей як на початку (у 55 дітей (58,51 %)), так і у фіналі (у 58 дітей (61,7 %)) проспективного дослідження найчастіше реєструвалося поєднане одночасне підвищення титрів автоантитіл ІА-2A і GADA порівняно з комбінаціями одномоментного підвищення рівнів автоантитіл GADA і IAA (у 49 дітей (52,12 %) на початку й у 54 дітей (57,45 %) на пізньому етапі обстеження) та автоантитіл ІА-2A і IAA (у 43 дітей (45,75 %) на початку й у 45 дітей (47,87 %) у фіналі дослідження) (рис. 3). Комбінація всіх трьох видів ДААт спостерігалася в 39 дітей (41,45 %) на початку обстеження й у 41 дитини (43,62 %) на пізньому етапі дослідження (рис. 3).
/141/141.jpg)
При включенні в групу ДААт+ в обстежених дітей як на початковій (у 29 дітей (59,18 %)), так і у фінальній (у 31 дитини (63,27 %)) доклінічній стадіях розвитку ЦД-1 найчастіше реєструвалося поєднане одночасне підвищення титрів автоантитіл ІА-2A і GADA порівняно з комбінаціями одномоментного підвищення рівнів автоантитіл GADA і IAA (у 25 дітей (51,02 %) на ранній і у 27 дітей (55,10 %) на пізній доклінічній стадії розвитку ЦД-1) та автоантитіл ІА-2A і IAA (у 23 дітей (46,93 %) на початку і у 24 дітей (48,98 %) у фіналі доклінічної стадії формування захворювання) (рис. 4). Підвищення всіх трьох видів ДААт відзначалося в 19 дітей (38,77 %) на початку доклінічної стадії розвитку ЦД-1 і в 21 дитини (42,85 %) на пізньому етапі латентної фази формування захворювання, що також вказує на неминучість прогресування автоімунного процесу. Отже, було встановлено превалюючу комбінацію одночасного підвищення двох видів ДААт — ІА-2A + GADA, що відіграє, безумовно, одну з головних ролей в патогенезі ініціації процесу автоімунної агресії. Необхідно відзначити, що в складових цієї комбінації ДААт — ІА-2A + GADA —були виявлені максимально високі рівні їхнього підвищення (18,96 ± 1,79 і 17,26 ± 1,23 Од/мл відповідно (p < 0,005)) на пізній доклінічній стадії розвитку ЦД-1, коли висота й напруженість процесів автодеструкції досягала свого піку (рис. 4).
Отже, ми виявили, що превалювання комбінації тандемно-одномоментного підвищення титрів автоантитіл (ІА-2A + GADA) має патогенетично пріоритетне значення в період еволюції латентної стадії ЦД-1, що співзвучне з даними інших авторів [8, 32, 33, 37].
Визначення тривалості доклінічної стадії розвитку ЦД-1 за значеннями одночасно підвищених титрів ДААт — ІА-2A та GADA
Ми визначали прогностичну значущість комбінації одночасно підвищених титрів ІА-2A і GADA як головного маркера, що передбачає маніфестацію ЦД-1 і вірогідно прогнозує тривалість доклінічної стадії розвитку захворювання. При аналізі часу клінічного дебюту ЦД-1 в 49 ДААт+-пацієнтів ми встановили, що в 27 дітей (55,1 %) клінічний дебют захворювання відбувся протягом перших трьох років із моменту першого визначення підвищених титрів ДААт; у 17 пацієнтів (34,69 %) маніфестація захворювання була зареєстрована в терміни від 3 до 5 років після включення пацієнтів у групу ДААт+-дітей і у 5 дітей (10,21 %) діагноз уперше виявленого ЦД-1 виставлявся через 5 років після первинної одночасної детекції високих значень ІА-2A і GADA в крові (рис. 5).
/142/142.jpg)
При аналізі комбінації й значень титрів у групі ДААт+-дітей з мінімальною тривалістю доклінічної стадії ЦД-1 до трьох років було визначено вірогідне превалювання тандемної комбінації ІА-2A і GADA з підвищеними титрами як на ранній (відповідно 7,57 ± 1,14 і 14,897 ± 2,44 Од/мл), так і на фінальній стадії доклінічного періоду розвитку ЦД-1 (відповідно 19,11 ± 2,48 і 18,096 ± 2,71 Од/мл) порівняно з аналогічними показниками в групі пацієнтів з дебютом ЦД-1 (ІА-2A 13,34 ± 1,96 Од/мл і GADA 16,49 ± 2,58 Од/мл).
Максимальні значення підвищених титрів ІА-2A і GADA визначалися як на початку, так і у фіналі доклінічної стадії розвитку ЦД-1 у групі ДААт+-дітей, у яких маніфестація захворювання наставала протягом перших трьох років після встановлення ДААт-позитивного статусу, що дозволяє досить точно прогнозувати час клінічного дебюту ЦД-1 в ДААт+-дітей.
Отримані дані підтверджуються результатами інших авторів, які показують, що предикторами клінічного дебюту ЦД-1 є ДААт — ІА-2A і GADA, які визначаються в максимальних титрах протягом трьох років до маніфестації захворювання [2].
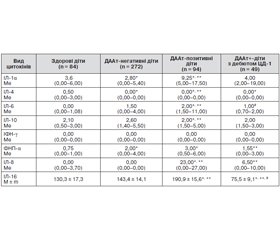
Рівень різних видів цитокінів (IЛ-1, IЛ-4, IЛ-6, IЛ-10, IФН-γ, ФНП-α, IЛ-8, IЛ-16) у крові дітей на доклінічній і ранній клінічній стадіях розвитку ЦД-1
В дослідженні рівня ІЛ-1α в ПК ДААт+-дітей було виявлено, що медіана його вмісту (9,25; 5,00–17,5 пг/мл) (табл. 1) більш ніж удвічі перевищувала аналогічний показник у ДААт-негативних дітей і дітей контрольної групи. У пацієнтів із дебютом ЦД-1 Ме вмісту ІЛ-1α у ПК була також дещо підвищеною, але не до такого ступеня, як у ДААт+-дітей. Уміст ІЛ-1β у сироватці ПК в усіх чотирьох обстежуваних групах дітей практично не визначався. Більш значне підвищення рівня циркулюючого ІЛ-1α на доклінічній стадії порівняно з клінічною стадією ЦД-1, можливо, пояснюється тим, що на латентній стадії відбувається найактивніший автоімунний процес в ОЛ. При подальшій деструкції більшості бета-клітин автоімунний процес поступово стихає, що й знаходить своє віддзеркалення у вигляді зниження рівня ІЛ-1β в багатьох пацієнтів із уже дебютованим ЦД-1. M.J. Hussain і співавт. [13] при визначенні вмісту ІЛ-1α у дітей з уперше виявленим ЦД-1 спостерігали значне підвищення його рівня в ПК. Вищий уміст ІЛ-1α відзначався також у предіабетичний період в однояйцевих близнюків. Крім того, у дітей, хворих на діабет, і їхніх сибсів було виражене зниження продукції ІЛ-1a мононуклеарами ПК після їхньої стимуляції мітогенами in vitro. При ЦД-1 з тривалим перебігом і при ЦД-2 подібних змін не спостерігалося. Дещо несподіваним було те, що ІЛ-1α, який має найбільш виражену цитотоксичну дію на ОЛ in vitro, зовсім не виявлявся в ПК обстежуваних.
Наші дослідження рівнів ІЛ-1α і ІЛ-1β у дітей з обтяженою спадковістю в доклінічний і ранній клінічний періоди розвитку ЦД-1 підтверджують дані M.J. Hussain [13] про те, що на латентній і клінічній стадії ЦД-1 є вірогідне підвищення рівня саме ІЛ-1α, а не ІЛ-1β у ПК. Ця думка підтверджується останніми публікаціями [30], які виявили подібні зміни рівня ІЛ-1α і ІЛ-1β у ПК здорових і хворих на ЦД-1 дітей.
Уміст цитокіну ІЛ-4 в ПК в дітей контрольної групи перебував у межах від 0 до 7,7 пг/мл (Ме 0,50; 00–3,00 пг/мл) (табл. 1).
На відміну від ДААт- у ДААт+-дітей уміст ІЛ-4 в ПК не визначався (медіана 0; 0,00–0,00 пг/мл), що складало високу вірогідну різницю щодо групи ДААт-негативних дітей (p < 0,001). ДААт+-діти з клінічним дебютом ЦД-1 мали тенденцію до незначного підвищення концентрації ІЛ-4 (від 0,3 до 0,5 пг/мл порівняно з групою здорових дітей), що, мабуть, є віддзеркаленням того, що незважаючи на те що активність автоімунного процесу в ОЛ вже у багатьох пацієнтів знижується, оскільки більшість бета-клітин зруйнована, у частини ДААт+-дітей імунологічні механізми відновлення порушеного імунного гомеостазу, ймовірно, ще зберігаються. Отримані нами дані є підтвердженням погляду й інших авторів [23], що ІЛ-4 в організмі людини виконує захисну роль, беручи участь у механізмах, що перешкоджають розвитку ЦД-1. Протилежно до прозапальних цитокінів, уміст яких на різних етапах перебігу автоімунного процесу підвищений, рівень ІЛ-4 різко знижений і часто реєструється загальне його зменшення, практично за нульових значень. Отже, практична відсутність цитокіну ІЛ-4 в циркуляції у ДААт+-дітей може служити маркером, який вказує на ймовірність швидкого розвитку клінічного дебюту захворювання і дає підстави робити висновок щодо наявності доклінічної стадії розвитку ЦД-1.
Рівень прозапального цитокіну ІЛ-6 у більшості ДААт+-дітей (табл. 1) був більш підвищеним (від 1,0 до 174,0 пг/мл) у ПК порівняно з ДААт-негативними і дітьми контрольної групи, що збігається з літературними даними [30]. Причому в 10 ДААт+-дітей рівень ІЛ-6 у ПК досягав значних величин (від 11,00 до 174,00 пг/мл), а в трьох із них з особливо високим рівнем ІЛ-6 в ПК (18,0; 22,0 і 174,0 пг/мл) з часом був діагностований клінічний дебют ЦД-1 з агресивнішим перебігом, ніж в інших дітей з ЦД-1. Важливо також підкреслити, що в трьох дітей з ЦД-1, у яких рівень ІЛ-6 у ПК був досить високим (84,0–95,0 пг/мл), через 5–7 років з’явилися ускладнення запального характеру. Отже, отримані дані демонструють, що пік рівня ІЛ-6 у циркуляції виявлявся на латентній стадії задовго до виникнення клінічних ознак захворювання, що є віддзеркаленням максимальної напруженості автоімунного процесу в ОЛ і підтверджується роботами низки авторів [18, 38].
Ме вмісту ІЛ-10 в ПК в усіх обстежуваних групах дітей значно не відрізняється, хоча й дещо нижча у здорових, ДААт-негативних і дітей із ЦД-1 щодо ДААт+. Проте в трьох ДААт+-дітей рівень цього цитокіну в циркуляції коливався від 5,0 до 11,0 пг/мл, а в трьох хворих на ЦД-1 — від 5,0 до 8,5 пг/мл. У той же час було показано, що мононуклеари, виділені з ПК хворих на ЦД-1, секретують меншу кількість ІЛ-10, ніж мононуклеари здорових осіб, і що при інкубації ІЛ-10 з ОЛ людини in vitrо він має здатність захищати ОЛ від деструктивної дії прозапальних цитокінів [16].
Вірогідних змін умісту ІФН-γ в ПК ДААт+-дітей і хворих на ЦД-1 виявлено не було. У всіх чотирьох обстежуваних групах дітей Ме вмісту ІФН-γ у ПК дорівнювала нулю. Можна припустити, що локальне підвищення вмісту ІФН-γ в ОЛ не виключає одночасного зниження його концентрації в ПК. Підвищення вмісту ІФН-γ в ПК, яке спостерігали в окремих дітей на доклінічній стадії і в дебюті ЦД-1, може бути зумовлене не лише автоімунним процесом в ОЛ, але й іншими причинами, зокрема маніфестним і раннім розвитком ускладнень ЦД-1.
Показано, що Ме вмісту цитокіну ФНП-α в ПК у ДААт+-дітей значно перевищує таку в ДААт-негативних і дітей контрольної групи. У дітей із уже маніфестованим ЦД-1 спостерігали зниження медіани вмісту ФНП-α порівняно з ДААт+-дітьми. Отримані результати вказують на те, що для багатьох дітей з доклінічною стадією ЦД-1 є характерним підвищений рівень ФНП-α в ПК, що відображає ступінь агресивності автоімунної деструкції бета-клітин в ОЛ на доклінічній стадії розвитку ЦД-1. У частини дітей з уже розвинутим захворюванням зниження рівня ФНП-α у ПК пояснюється зменшенням автоімунної агресії [34].
При дослідженні прозапального aльфа-хемокіну ІЛ-8 було виявлено виражене підвищення його вмісту в ПК у ДААт+-дітей. Спостерігається найвищий вміст у ПК не тільки хемоатрактанту ІЛ-8, а й таких суто прозапальних цитокінів, як ІЛ-6 і ФНП-α на латентній стадії розвитку ЦД-1. Це дозволяє передбачити, що ІЛ-8 бере участь у міграції автореактивних клітин на найбільш ранніх етапах розвитку автоімунного процесу задовго до клінічної маніфестації захворювання, що сприяє міграції автореактивних лімфоцитів із крові у вогнище запалення, тобто ще в практично здорової дитини. При завершенні деструкції бета-клітин відбувається зниження рівня ІЛ-8 у циркуляції.
При вже розвинутому ЦД-1 середній вміст ІЛ-16 у ПК був зниженим. Отримані результати дозволяють вважати, що на латентній стадії розвитку ЦД-1, тобто в період найактивнішого руйнування бета-клітин, ІЛ-16, подібно до інших видів хемокінів, сприяє міграції автореактивних Т-клітин в ОЛ, де вони завдяки прозапальним цитокінам здійснюють деструкцію й апоптоз інсулінпродукуючих клітин. Коли інтенсивність автоімунного процесу слабшає, концентрація ІЛ-16 у ПК зменшується до рівня, нижчого від норми, і, відповідно, хемотаксис ефекторних мононуклеарів в ОЛ послаблюється або припиняється. Отже, нами вперше показано, що ІЛ-16, подібно до інших видів типових хемокінів, бере активну участь у найбільш ранній стадії розвитку автоімунного процесу в ОЛ, забезпечуючи вогнище запалення антигензалежними клітинами. При затуханні запального процесу рівень ІЛ-16 у ПК знижується, оскільки зникає необхідність у його стимулюючому високому вмісті в циркуляції крові у зв’язку з тотальною загибеллю більшості бета-клітин.
Проведене нами дослідження показало, що в багатьох нормоглікемічних дітей з обтяженою спадковістю в доклінічний період розвитку ЦД-1 фіксується чітке підвищення в ПК таких прозапальних цитокінів, як ІЛ-1a, ІЛ-6 і ФНП-α, що є маркерами запалення й зниження рівня антизапального цитокіну ІЛ-4. У тих дітей, у яких ЦД-1 вже клінічно маніфестував, спостерігався подібний дисбаланс умісту цитокінів у ПК, проте ступінь його вираженості був менш значущим. Рівень цитокінів і хемокінів у ПК дітей, хворих на ЦД-1, різний залежно від динаміки розвитку захворювання. У доклінічний період, коли дитина ще практично здорова, відбувається найбільш значне порушення рівня цитокінів, що відображає пік автоімунної агресії, який затихає при руйнуванні більшості бета-клітин, що призводить до гіпоінсулінемії і, отже, є віддзеркаленням найвищого ступеня інтенсивності автоімунного процесу, який у результаті завершується тотальною деструкцією бета-клітин. Виявлені зміни з боку прозапальних цитокінів узгоджуються з динамікою рівня хемоатрактантів ІЛ-8 і ІЛ-16, що здійснюють міграцію автореактивних клітин із циркуляції в ОЛ, тобто відзначається різке підвищення вмісту ІЛ-8, ІЛ-16 в латентний період розвитку ЦД-1 і зниження концентрації хемоатрактантів при маніфестації захворювання, що підтверджується роботами й інших авторів, зокрема M. Baggiolini [7], який показав, що зростання рівня хемокінів відбувається лише на доклінічній стадії розвит–ку ЦД-1.
Кореляційний аналіз свідчить про прямий взаємозв’язок між підвищеними рівнями GADA і ІЛ-1α (rs = 0,982; p < 0,005), ІА-2A і ІЛ-1α (rs = 0,937; p < 0,001), GADA і ІЛ-6 (rs = 0,938; p < 0,005), ІА-2A і ІЛ-6 (rs = 0,911; p < 0,005). Отримані дані підтверджують ключову роль ІЛ-1a як одного з головних медіаторів, що призводить до загибелі бета-клітин шляхом некрозу та апоптозу, а також значення ІЛ-6 як прозапального цитокіну, високі концентрації якого свідчать про його участь у гострофазових реакціях як маркера запалення, що також вказує на його участь в автоімунному патогенезі ЦД-1. Виявлено також прямий кореляційний зв’язок між GADA і ІЛ-10 (rs = 0,738; p < 0,005), ІА-2A і ІЛ-10 (rs = 0,811; p < 0,001), GADA і ФНП-α (rs = 0,862; p < 0,005), ІА-2A і ФНП-α (rs = 0,837; p < 0,005), що вказує на участь цих цитокінів у процесах автоімунного апоптозу як індукторів апоптозу бета-клітин підшлункової залози за розвитку ЦД-1. Визначено також прямий кореляційний зв’язок між GADA і ІЛ-8 (rs = 0,798; p < 0z,005), ІА-2A і ІЛ-8 (rs = 0,879; p < 0,001), GADA і ІЛ-16 (rs = 0,862; p < 0,005), ІА-2A і ІЛ-16 (rs = 0,837; p < 0,005), що підтверджує роль цих цитокінів як вагомих хемоатрактантів, які займають свою деструктивну нішу в автоімунному запаленні.
Отримані результати дозволяють зробити висновок, що на доклінічній стадії розвитку ЦД-1 відзначається наявність активного як автоімунного, так і запального процесів, що підтверджується підвищеною продукцією прозапальних цитокінів. Кореляційний аналіз залежності між умістом підвищених титрів GADA і ІА-2A та рівнем цитокінів (ІЛ-1a, ІЛ-6, ІЛ-10, ФНП-α, ІЛ-8, ІЛ-16) продемонстрував наявність взаємозв’язку між досліджуваними параметрами, тим самим указуючи на їх сумісну та синергічну участь у механізмах патогенезу ЦД-1, а також дозволив повніше охарактеризувати імунний статус ДААт+-дітей на доклінічній стадії розвитку захворювання.
Висновки
1. Виявлено, що в 94 (26,7 %) із 366 дітей з обтяженою спадковістю за не менше ніж дворазового ви–значення наявності в них діабетасоційованих автоантитіл спостерігався підвищений титр ДААт, переважно GADA і ІА-2A; у 49 (52,1 %) із них у період від 6 міс. до 12 років (30,9 ± 3,2 міс.) маніфестував клінічний дебют ЦД-1.
2. Установлено, що найбільш значимими маркерами розвитку ЦД-1 є антитіла до протеїну тирозинфосфатази та антитіла до декарбоксилази глутамінової кислоти, що підтверджується як превалюючим підвищенням титру ІА-2A і GADA, так і домінантним виявленням їх одночасного збільшення.
3. У дітей із швидшою клінічною маніфестацією ЦД-1 і тривалістю доклінічної стадії розвитку цього захворювання менше трьох років виявляється превалювання значень підвищених титрів ІА-2A і GADA як на ранній, так і на фінальній стадіях доклінічного періоду розвитку ЦД-1 порівняно з аналогічними показниками в пацієнтів із тривалістю доклінічної стадії ЦД-1 від 3 до 5 років і в дітей із уперше виявленим ЦД-1, у яких латентна стадія розвитку захворювання тривала понад 5 років.
4. Аналіз часу маніфестації ЦД-1 у 49 пацієнтів із наявністю підвищених титрів ДААт установив у 55,1 % із них клінічний дебют ЦД-1, що відбувся протягом 3 років із моменту першого визначення підвищених титрів ДААт; у 34,69 % виникнення захворювання було діагностоване в терміни від 3 до 5 років після включення пацієнтів у групу ДААт+-дітей і в 10,21 % уперше виявлений ЦД-1 діагностували через 5 років після первинної детекції одночасно підвищених титрів двох із трьох видів досліджуваних ДААт у крові пацієнтів.
5. Розвитку ЦД-1 у ДААт+-дітей передує підвищення рівня прозапальних цитокінів ІЛ-1α, ІЛ-6 і ФНП-α, хемокінів ІЛ-8 і хемоатрактанту ІЛ-16, що позитивно корелює з підвищеними титрами ІА-2A і GADA, при одночасному зниженні концентрації ІЛ-4 у ПК. Ці зміни показників імунітету були менш вираженими після клінічного дебюту захворювання, що підтверджує патогенетично ключову роль цитокінів у доклінічному періоді патогенезу ЦД-1.
1. Зак К.П., Попова В.В. Цитокины и сахарный диабет 1-го типа у человека (обзор с включением собственных данных) // Укр. мед. часопис. — 2006. — № 1 (51). — C. 78–89.
2. A longitudinal study of GAD65 and ICA512 autoantibodies during the progression to type 1 diabetes in Diabetes Prevention Trial — Type 1 (DPT–1) participants / Sosenko J.M., Skyler J.S., Palmer J.P. // Diabetes Care. — 2011. — Vol. 34, № 11. — P. 2435–2437.
3. Atkinson M.A. The pathogenesis and natural history of type 1 diabetes // Cold Spring Harb. Perspect. Med. — 2012; 2:a007641
4. Atkinson M.A. Thirty years of investigating the autoimmune basis for type 1 diabetes: Why can’t we prevent or reverse this disease // Diabetes. — 2005. — Vol. 54, № 5. — P. 1253–1263.
5. Atkinson M.A. Type 1 diabetes / M.A. Atkinson, G.S. Eisenbarth, A.W. Michels // Lancet. — 2014. — Vol. 383, № 9911. — P. 69–82.
6. Autoantibodies in diabetes / C. Pihoker, L.K. Gilliam, Ch.S. Hampe, Å. Lernmark // Diabetes. — 2005. — Vol. 54, Suppl. 2. — P. S52–S61.
7. Baggiolini M. Chemokines in pathology and medicine // J. Intern. Med. — 2001. — Vol. 250. — P. 9100–9104.
8. Battaglia M., Atkinson M.A. The streetlight effect in Type 1 diabetes // Diabetes. — 2015. — Vol. 64. — P. 1081–1090.
9. Bingley P.J. Interactions of age, islet cell antibodies, insulin autoantibodies, and first-phase insulin response in predicting risk of progression to IDDM in ICA + relatives. The ICARUS Data Set // Diabetes. — 1996. — Vol. 45. — P. 1720–1728.
10. Cytokines and β-cell biology: from concept to clinical translation / M.Y. Donath, J. Storling, L.A. Berchtold et al. // Endocr. Rev. — 2008. — Vol. 29. — P. 334–350.
11. Early seroconversion and rapidly increasing autoantibody concentrations predict prepubertal manifestation of type 1 diabetes in children at genetic risk / V. Parikka, K. Näntö-Salonen, M. Saarinen et al. // Diabetologia. — 2012. — Vol. 55, № 7. — P. 1926–1936.
12. Effect of anti-inflammatory cytokines on insulin-producing cells / E. Gurgel-Convey, K.L. A. Soura, M. Elsner, S. Lensen // Diabetologia. — 2007. — Vol. 47, Suppl. 1. — P. 460.
13. Elevated serum levels of macrophage-derived cytokines precede and accompany the onset of IDDM / M.J. Hussain, M. Peakman, H. Gallati et al. // Diabetologia. — 1996. — Vol. 39, № 1. — P. 60–69.
14. Evidence that HLA class I and II associations with type 1 diabetes, autoantibodies to GAD and autoantibodies to IA-2, are distinct / J.M.M. Howson, H. Stevens, D.J. Smyth et al. // Diabetes. — 2011. — Vol. 60, № 10. — P. 2635–2644.
15. GAD autoantibody affinity in schoolchildren from the general population / Ch. Bender, M. Schlosser, U. Christen et al. // Diabetologia. — 2014. — Vol. 57. — P. 1911–1918.
16. High levels of circulating interleukin-10 in diabetic nephropathy patients / J. Mysliwska, K. Zorena, E. Semetkowska-Jurkiewicz et al. // Eur. Cytokine Netw. — 2005. — Vol. 16, № 2. — P. 117–122.
17. IFN–γ low production capacity in type 1 diabetes mellitus patients at onset of disease / M.A. Avanzini, L. Ciardelli, E. Lenta et al. // Exp. Clin. Endocrinol. Diabetes. — 2005. — Vol. 113, № 6. — P. 1–5.
18. Inflammatory cytokine, growth factor and counter-regulatory responses to exercise in children with type 1 diabetes and healthy controls / P.R. Galassetti, K. Iwanaga, M. Crisostomo et al. // Pediatr. Diabetes. — 2006. — Vol. 7, № 1. — P. 16–24.
19. Kolb H. An immune origin of type 2 diabetes? / H. Kolb, T. Mandrup-Poulsen // Diabetologia. — 2005. — Vol. 48, № 6. — P. 1038–1050.
20. Lebastchi J. Immunologic and metabolic biomarkers of β-cell destruction in the diagnosis of type 1 diabetes / J. Lebastchi, K.C. Herold // Cold Spring Harb. Perspect. Med. — 2012; 2:a007708.
21. Lo Hui-Chen. The relationship among serum cytokines, chemokine, nitric oxide, and leptin in children with type 1 diabetes mellitus / Hui-Chen Lo, Su-Chen Lin, Yu-Mei Wang // Clin. Biochem. — 2004. — Vol. 37, № 8. — P. 666–672.
22. Mediators of inflammation in children with type 1 diabetes mellitus: cytokines in type 1 diabetic children / A.B. Erbagci, M. Tarakcioglu, Y. Coskun et al. // Clin. Biochem. — 2001. — Vol. 34, № 8. — P. 645–650.
23. Multiple immuno-regulatory defects in type 1 diabetes / A. Kukreja, G. Cost, J. Marker et al. // J. Clin. Invest. — 2002. — Vol. 109, № 1. — P. 131–140.
24. Pancreatic islet autoantibodies as predictors of type 1 diabetes in the Diabetes Prevention Trial — Type 1 / R.T. Orban, J.M. Sosenko, D. Cuthbertson et al. // Diabetes Care. — 2009. — Vol. 32. — P. 2269–2274.
25. Pietropaolo M. Humoral autoimmunity in type 1 diabetes: prediction, significance, and detection of distinct disease subtypes / M. Pietropaolo, R. Towns, G.S. Eisenbarth // Cold Spring Harb. Perspect. Med. — 2012; 2:a012831.
26. Predictive characteristics of diabetes-associated autoantibodies among children with HLA-conferred disease susceptibility in the general population / H.T.A. Siljander, S. Simell, A. Hekkala et al. // Diabetes. — 2009. — Vol. 58. — P. 2835–2842.
27. Primer: immunity and autoimmunity / M. Pietropaolo, J.M. Surhigh, P.W. Nelson, G.S. Eisenbarth // Diabetes. — 2008. — Vol. 57. — P. 2872–2882.
28. Progression from single to multiple islet autoantibodies often occurs soon after seroconversion: implications for early screening / R. Chmiel, E.Z. Giannopoulou, Ch. Winkler et al. // Diabetologia. — 2015. — Vol. 58, № 2. — P. 411–413.
29. Regulatory vs. inflammatory cytokine T-cell responses to mutated insulin peptides in healthy and type 1 diabetic subjects / M. Nakayamaa, K. McDaniela, L. Fitzgerald-Millera et al. // PNAS. — 2015. — Vol. 112, № 14. — P. 4429–4434.
30. Role of immune dysfunction in pathogenesis of type 1 diabetes mellitus in children / Jin-Shui He, Pu-Song Xie, Dao-Shu Luo et al. // Asian Pacific J. Tropical Medicine. — 2014. — P. 823–826.
31. Schneider D.A. Potential viral pathogenic mechanism in human type 1 diabetes / D.A. Schneider, M.G. von Herrath // Diabetologia. — 2014. — Vol. 57. — P. 2009–2018.
32. Seroconversion to multiple islet autoantibodies and risk of progression to diabetes in children / A.G. Ziegler, M. Rewers, O. Simell et al. // JAMA. — 2013. — Vol. 309, № 23. — P. 2473–2479.
33. Serum titres of anti-glutamic acid decarboxylase-65 and anti-IA-2 autoantibodies are associated with different immuno-regulatory milieu in newly diagnosed type 1 diabetes patients / M.A.L. Gabbay, M.N. Sato, A.J.S. Duarte, S.A. Dib // Clin. Exp. Immunol. — 2012. — Vol. 168, № 1. — P. 60–67.
34. Serum IL-1β, IL-2, and IL-6 in insulin-dependent diabetic children / Y. Dogan, S. Akarsu, B. Ustundag et al. // Hindawi Publishing Corporation Mediators of Inflammation. — 2006. — Vol., Article ID 59206. — P. 1–6.
35. Sherry N.A. Natural history of β-cell function in type 1 diabetes / N.A. Sherry, E.B. Tsai, K.C. Herold // Diabetes. — 2005. — Vol. 54, Suppl. 2. — P. S32–S39.
36. Standards of medical care in diabetes — 2015 // Diabetes care. — 2015. — Vol. 38, Suppl. 1. — S1–S90.
37. The prediction of type 1 diabetes by multiple autoantibody levels and their incorporation into an autoantibody risk score in relatives of type 1 diabetic patients / J.M. Sosenko, J.S. Skyler, J.P. Palmer et al. // Diabetes Care. — 2013. — Vol. 36, № 9. — P. 2615–2620.
38. Type 1 diabetes is associated with increased cyclooxygenase — and cytokine-mediated inflammation / S. Basu, A. Larsson, J. Vessby et al. // Diabetes Care. — 2005. — Vol. 28, № 6. — P. 1371–1375.

/140/140.jpg)
/143/143.jpg)