Журнал «» 3 (41) 2015
Вернуться к номеру
Цитопротекція міокарда в лікуванні хворих на ішемічну хворобу серця
Авторы: Нетяженко В.З., Нетяженко Н.В., Мальчевська Т.Й. - Національний медичний університет імені О.О. Богомольця, м. Київ
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Позитивний вплив метаболічної терапії в комплексному лікуванні хворих на ішемічну хворобу серця — стабільну стенокардію напруження ІІ–ІІІ ФК — проявлявся покращанням перебігу захворювання, збільшенням толерантності до фізичного навантаження, зменшенням електричної нестабільності міокарда й нітрогліцеринового порогу.
Позитивное влияние метаболической терапии в комплексном лечении больных ишемической болезнью сердца — стабильной стенокардией напряжения ІІ–ІІІ ФК — проявлялось улучшением течения заболевания, увеличением толерантности к физической нагрузке, уменьшением электрической нестабильности миокарда и нитроглицеринового порога.
Metabolic therapy as a component of a complex treatment of patients with ischemic heart disease — stable effort angina II–III FC — has a positive effect, namely it improves disease course, enhances tolerance to physical load, decreases myocardial electrical instability and nitroglycerin threshold.
ішемічна хвороба серця, стабільна стенокардія напруження, метаболічна терапія, Тіотриазолін.
ишемическая болезнь сердца, стабильная стенокардия напряжения, метаболическая терапия, Тиотриазолин.
ischemic heart disease, stable effort angina, metabolic therapy, Tiotriazolinum.
Статья опубликована на с. 40-50
Тривалий час лікування ішемічної хвороби серця (ІХС) з позицій покращання кардіогемодинаміки базувалося на використанні традиційних лікарських засобів, патогенетична дія яких була спрямована на зниження потреби міокарда в кисні або на збільшення надходження кисню до кардіоміоцита. Впливаючи на гемодинамічні параметри, вони ефективно запобігали нападам стенокардії, але фактично не захищали кардіо–міоцит від ішемії. Свого часу L. Opiе визнав, що серце є більше ніж насос, воно є органом, який потребує енергії для метаболізму, й ідеальним у лікуванні ішемії є використання метаболічної терапії. Не впливаючи на коронарну й системну гемодинаміку, метаболічна терапія відтоді забезпечила собі широке застосування. Загалом цитопротекція за рахунок дії на процеси утворення, транспорту й утилізації енергії має на меті запобігання загибелі, руйнації структури й функції кардіоміоцита в умовах ішемії та реперфузії.
Клітинний ацидоз, порушення іонної рівноваги, зменшення синтезу АТФ призводять спочатку до діастолічної, а потім і до систолічної дисфункції міокарда, електрофізіологічних зрушень (зміни зубця Т і сегмента ST на ЕКГ) і лише згодом до виникнення болів у грудній клітці. Така послідовність змін отримала назву «ішемічний каскад». Очевидно, що стенокардія являє собою його кінцевий етап, по суті, верхівку айсберга, в основі якого лежать виниклі через порушення перфузії зміни метаболізму міокарда. Отже, зміни метаболізму кардіоміоцитів при ішемії можуть розглядатися як точка медикаментозної дії, зокрема за допомогою препаратів, здатних безпосередньо діяти на клітинний метаболізм.
Останніми десятиліттями були синтезовані й упроваджені в медичну практику кардіопротектори, які успішно усували порушення клітинного метаболізму та функціонального стану мембран кардіоміоцитів, тим самим стримуючи необоротність цих змін. На сьогодні метаболічна терапія зайняла повноправне місце в схемах лікування серцево–судинної патології, ввійшовши в міжнародні рекомендації [7, 23, 25]. Незаперечливі докази фармакологічного захисту міокарда при синдромі ішемії–реперфузії знайшли своє відображення в рекомендаціях Європейського товариства кардіологів (ЄТК) (2006, 2013) у вигляді призначення метаболічної терапії хворим на стабільну стенокардію. Зазначено, що за умови недостатнього контролю над стенокардією або при непереносимості препаратів І лінії як додаткові засоби слід по можливості застосовувати метаболічні препарати (триметазидин, ранолазин) у хворих із стабільною стенокардією для зменшення вираженості симптомів і проявів ішемії, хоча і з низьким рівнем доказовості (клас ІІb, В) [23]. Метаболічна терапія в комплексному підході стала одним із напрямків у лікуванні коронарогенної серцевої недостатності через доведену інгібіцію фіброзу міокарда, зокрема, триметазидином [7].
Найбільш уразливими до гіпоксії вважаються кардіоміоцити, нейрони, меншою мірою гепатоцити.
Арсенал медикаментозних засобів із визнаною метаболічною дією з року в рік поповнюється. Зокрема, у кардіологічній практиці широкого застосування набули препарати з метаболічною дією, серед яких такі визнані, як триметазидин, ранолазин, Тіотриазолін, L–карнітин, мілдронат (мельдоній), мексикор, кверцетин, кардонат, а в неврологічній — актовегін, мексидол, ноотропіл, інстенон із притаманною для них найбільшою тропністю до міокарда чи нервової тканини [20–22].
Серед напрямків метаболічної терапії домінуючими залишаються оптимізація утворення й витрати енергії та нормалізація балансу між інтенсивністю вільнорадикального окислення й антиоксидативними процесами. Оксидативний стрес пов’язують із процесами вільнорадикального окислення з утворенням активних форм кисню й інших продуктів окислення з одночасною інгібіцією антиоксидантних процесів, порушенням окислення жирних кислот у мітохондріях, що врешті–решт веде до енергетичного дефіциту. На сьогодні відомо, що більшість захворювань серцево–судинної системи пов’язана з оксидативним стресом.
Основні цитопротективні ефекти метаболічної терапії спрямовані на стабілізацію клітинної мембрани, антиоксидантну дію й зменшення потреб у споживанні кисню. Особливості клінічної оцінки дії цитопротекторів у клінічній практиці пов’язані з відсутністю суб’єктивного разового ефекту. Досить складно як лікарю, так і пацієнту адекватно оцінити той чи інший метаболічний препарат з огляду на те, що вони при–ймаються зазвичай в складі комбінованої терапії і не впливають на такі традиційні показники гемодинаміки, як артеріальний тиск (АТ), частота серцевих скорочень (ЧСС).
Ідея використання для лікування ІХС антиангінальних препаратів із метаболічним механізмом дії не нова. Ще в 1914 р. Budingen спробував застосувати внутрішньовенно глюкозу для лікування хворих на тяжку стенокардію, фактично ставши автором метаболічного підходу до лікування ІХС. Але спроби використання з цією метою засобів типу рибоксину, кокарбоксилази, АТФ були безуспішні. Відсутність доказової бази щодо їх застосування не означає, що метаболічна терапія не має права на існування. Більшість метаболічних засобів пройшли порівняльні дослідження й підтвердили свою клінічну ефективність.
Традиційно виникнення метаболічного підходу в лікуванні ІХС пов’язують із глюкозо–інсуліно–калієвою сумішшю (ГІК), яку в 1962 році Demitros Sodi–Pallaris вперше застосував у нерандомізованому дослідженні. ГІК, позитивно впливаючи на ЕКГ–динаміку при гострому інфаркті міокарда (ІМ), покращувала раннє виживання таких хворих і на той час знайшла своє широке застосування в кардіології як поляризуюча суміш, прославивши ім’я її автора [18]. Дослідження більше стосувались гострого коронарного синдрому і використання кардіоцитопротекторів. Правомірність даного підходу була продемонстрована в багатоцентровому дослідженні DIGAMI, у якому застосування глюкозо–інсуліно–калієвої суміші у хворих на інфаркт міокарда і цукровий діабет дозволило впродовж першого року спостереження досягнути відносного зниження ризику смерті на 29 %. Так, у дослідженні DIGAMI виправдалось очікування щодо ефективності ГІК при гострому коронарному синдромі й цукровому діабеті; у дослідженні CEDIM II при застосуванні у 400 хворих з ІМ L–карнітину в дозі 9 г/добу впродовж 5 діб, а в подальшому 5 г/добу впродовж 6 місяців доведена більша ефективність від раннього застосування й нівелювання ефекту при подальшому прийомі препарату. Метааналіз 13 клінічних досліджень у 2013 році щодо вторинної профілактики за участю 3500 хворих із перенесеним ІМ виявив зменшення смертності на 27 % при застосуванні L–карнітину. Мінімально ефективною виявилась доза 2 г/добу, найбільш ефективною — 6–9 г/добу.
У наступних дослідженнях було продемонстровано, що ГІК, як і нікотинова кислота, знижуючи вивільнення вільних жирних кислот (ВЖК) адипоцитами в зоні ішемізованого міокарда і блокуючи їх окислення, значно активує окислення глюкози. Саме такий фармакологічний підхід став найбільш поширеним у метаболічній терапії ІХС та стабільної стенокардії напруження, ось чому оптимальним ефектом метаболічної терапії вважають покращання утилізації кисню міокардом в умовах ішемії [7, 8, 14, 16–18]. Хоча не було виявлено впливу застосування триметазидину в парентеральній формі на кінцеві точки у 20 000 хворих на ІМ, проте було відзначено зменшення життєвозагрозливих аритмій [20–23]. Менш доказовою виявилась база в Тіотриазоліну, проте його широке використання з 80–х років як гепато– і кардіопротектора й порівняльні дослідження із триметазидином довели клінічну ефективність цього засобу при різних формах ІХС.
Позитивними рисами метаболічних засобів є повна відсутність небажаних гемодинамічних впливів, добра переносимість усіма віковими групами, спрямованість впливу на глибинні метаболічні механізми розвитку ішемії й кардіоцитопротекції. Хоча Європейське медичне агентство в прес–релізі рекомендує лікарям, зокрема, не призначати триметазидин при запамороченні, дзвоні у вухах, порушеннях зору, також є певні обмеження при підвищеній рухливості, зокрема у пацієнтів із паркінсонізмом, синдромі рухливих ніг, порушеннях координації, тяжкій нирковій недостатності.
Раціональне утворення й використання енергії є ключовим моментом у розвитку серцевої патології, а метаболічна терапія підвищує стійкість тканин до гіпоксії й наслідків реперфузії. Ішемічні й реперфузійні синдроми, як часті супутники ІХС, та власне ішемія міокарда характеризуються недостатнім забезпеченням тканин киснем, виснаженням запасів АТФ і креатинфосфату в кардіоміоциті, переключенням гліколізу з аеробного на анаеробний шлях, підсиленням внутрішньоклітинного ацидозу, дисфункцією іонних насосних каналів, підвищенням рівня натрію, кальцію, зниженням вмісту калію в цитоплазмі кардіоміоцитів [2]. Вільнорадикальне окислення та інші агресивні чинники, як маркери оксидативного стресу, не лише пошкоджують клітинну мембрану кардіоміоцита, але й ініціюють клітинний апоптоз як вияв запрограмованої смерті клітин [7, 14, 15, 17, 18, 20]. Порушення процесів мікроциркуляції, ендотеліальна дисфункція в результаті прискореної деградації NO, активація системи фагоцитуючих мононуклеарів, Т–лімфоцитів і лейкоцитів, тобто імунного й системного запалення, з активацією індукторів клітинного апоптозу й наступним ремоделюванням лівого шлуночка — ось той неповний перелік багатогранності ішемічних проявів, ішемічної кардіоміопатії.
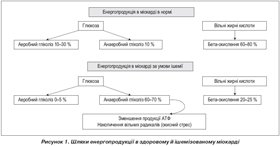
Зважаючи на енергопродукцію в міокарді за звичайних умов і в умовах ішемії слід відзначити принципові особливості енергетичного метаболізму в здоровому й ішемізованому міокарді. Так, за умов нормоксії синтез АТФ як головного субстрату енергетичного метаболізму реалізується через динамічно урівноважені цикли катаболізму глюкози і ВЖК. На частку жирних кислот (пальмітинова, стеаринова) припадає 60–80 % синтезу АТФ, у той час як гліколітичний шлях синтезу АТФ становить 20–30 % від енергозабезпечення.
Для порівняння: з 1 молекули пальмітинової кислоти синтезується 134 молекули АТФ, а зі стеаринової — 147, у той час як з 1 молекули глюкози — 32 молекули АТФ. У здоровому міокарді енергозабезпечення здійснюється за рахунок аеробного /42/b-42.jpg) -–окислення ВЖК із подальшим відщепленням ацетил–КоА за більшої потреби в кисні. Для утворення тієї ж кількості АТФ із ВЖК необхідно на 17 % більше кисню, ніж при окисленні глюкози. У реакції циклу трикарбонових кислот катаболізм ліпідів і глюкози здійснюється за загальновизнаним шляхом, проте обумовлює конкуренцію за здатність окислення [5].
-–окислення ВЖК із подальшим відщепленням ацетил–КоА за більшої потреби в кисні. Для утворення тієї ж кількості АТФ із ВЖК необхідно на 17 % більше кисню, ніж при окисленні глюкози. У реакції циклу трикарбонових кислот катаболізм ліпідів і глюкози здійснюється за загальновизнаним шляхом, проте обумовлює конкуренцію за здатність окислення [5].
Енергія АТФ важлива:
— для забезпечення скоротливої здатності міокарда й транспорту іонів Na+, K+, Ca2+ через сарколеми й мітохондріальні мембрани (75–80 %);
— збереження об’єму мітохондрій, ресинтезу глікогену, активування циклу Кребса (20–25 %).
Глюкоза є не менш важливим енергетичним субстратом і в умовах дефіциту кисню здатна пригнічувати окислення ВЖК. Найбільша частка глюкози, вступаючи в реакції окислення, утворюється з глікогену, її енергетичного резерву за ішемії. Запаси глікогену в міокарді становлять не більше ніж 1 % від загального об’єму клітин. Метаболізм глюкози здійснюється двома шляхами — аеробного й анаеробного гліколізу.
Аеробний гліколіз: у разі окислювального фосфорилювання в піруватдегідрогеназному циклі трикарбонових кислот у мітохондріях утворюється піруват, який синтезує менше ніж 10 % кількості АТФ, що під впливом ферменту піруватдегідрогенази конвертується в ацетил–КоА. У подальшому окислення 2 молів пірувату супроводжується синтезом 30 молекул АТФ й інгібується надлишком ацетил–КоА і ВЖК. З точки зору кількості синтезованої енергії аеробний гліколіз є більш продуктивним.
Анаеробний гліколіз: у цитозолі кардіоміоцита метаболізм глюкози здійснюється без участі кисню. Анаеробний шлях включає схожі шляхи перетворення глюкози в піруват. Але за відсутності або при дефіциті в клітині кисню піровиноградна кислота зазнає відновлення до молочної кислоти. Такий механізм є менш енергетично вигідним, проте він відіграє неабияку роль при виникненні ішемії міокарда.
Щодо енергетичного метаболізму за умов ішемії міо-карда, то при гіпоперфузії порушується утворення енергії й зменшуються її резерви, внутрішньомітохондріально в кардіоміоциті накопичується велика кількість недоокислених жирних кислот із руйнівною дією на клітинні мембрани.
Серед пошкоджуючих механізмів:
— інгібування утилізації глюкози під час ішемії й реперфузії;
— роз’єднаність окислення в електронно–транспортному ланцюгу мітохондрій;
— порушення властивостей мембран із виходом ферментів, зокрема КФК;
— пригнічення функції мітохондрій і швидкості продукції АТФ;
— підвищення проникності мембран для іонів Са2+, що супроводжується збільшенням бета–адренергічної відповіді міокарда.
За умов ішемії в кардіоміоцитах не відбувається адекватного синтезу креатинфосфату й АТФ, концентрація останнього прогресивно й швидко знижується, активується анаеробний гліколіз, при якому з пірувату синтезується лактат і всього 2 молекули АТФ. Анаеробний гліколіз не в змозі покрити енергетичну потребу кардіоміоцита, оскільки забезпечує синтез не більше ніж 50 % від необхідного АТФ. Надлишок лактату, що надходить до клітини, є надійною ознакою ішемії.
В умовах ішемії активація гліколітичних шляхів утворення АТФ набуває першочергового значення. За енергодефіциту кардіоміоцити починають використовувати глюкозу з ендогенного глікогену, оскільки вона вже фосфорильована (на відміну від екзогенної глюкози, яка транспортується в клітину), і її утилізація не потребує затрат АТФ для початкової активації. Проте запаси глікогену в кардіоміоцитах вичерпуються досить швидко, через що виникає необхідність активації резервних шляхів утворення АТФ.
Короткочасно підтримувати енергетичний стан серця в умовах обмеженої доставки кисню може розпад 1 молекули глюкози на 2 молекули пірувату при фосфогліцераткіназній і піруваткіназній реакціях, у результаті яких АДФ фосфорилюється до АТФ.
Отже, особливістю клітинного метаболізму при ішемії міокарда є використання ендо– й екзогенного пірувату, який активно поглинається міокардом із крові. Внутрішньомітохондріальний перенос пірувату за участі піруватдегідрогенази, активність якої вважається рушійним фактором у гліколітичному шляху утворення енергії, трансформується в ацетил–КоА [24, 25]. З 1 молекули глюкози при трансформації в піруват утворюються 2 молекули АТФ, а при наступному окисленні пірувату в циклі трикарбонових кислот — 34 молекули АТФ. При ішемії переключається метаболізм кардіоміоцита на використання жирних кислот замість окислення інших субстратів, зокрема глюкози. Проте це вимагає на 15 % більших витрат молекулярного кисню, і киснева вартість окислення глюкози є дещо нижчою за окислення жирних кислот. Через це в умовах ішемії більшу перевагу має шлях окислення глюкози, що дозволяє ефективно використовувати залишковий кисень.
Отже, в умовах ішемії уповільнюється робота дихального ланцюга циклу Кребса, поступово зменшується утворення ацетил–КоА, знижується швидкість окислення не лише глюкози, а й жирних кислот. Накопичення недоокислених жирних кислот сприяє розвитку ацидозу, перевантаженню клітин кальцієм і натрієм, що неминуче порушує розслаблення кардіоміоцита й у подальшому його скоротливість.
Раніше проведені дослідження встановили, що аеробний метаболізм припиняється при уповільненні коронарного кровотоку менше за 0,56 мл/хв/кг маси міокарда. При поглибленні ішемії єдиним можливим механізмом синтезу АТФ стає анаеробний гліколіз з утворенням АТФ і лактату. Під впливом лактатдегідрогенази молочна кислота може окислятися знову, утворюючи піруват, який і бере участь у подальших перетвореннях. Надлишок молочної кислоти формує тканинний лактат–ацидоз, який, впливаючи на окислювальне фосфорилювання, викликає перевантаження кардіоміоцитів Са2+. Лактат–ацидоз, активуючи фосфоліпазу А2, обумовлює пошкодження мембранних структур й ініціює процеси перекисного окислення ліпідів. Надлишок лактату зрушує рівновагу в бік ацидозу, що активує периферичні больові рецептори сегментів С7–Т4 спинного мозку, викликаючи розвиток ангінозних болів. Формується гіпоксичний тип метаболізму. Ось чому зниження внутрішньоклітинного лактату через трансформацію в піруват є ключовим моментом у метаболічній терапії. Отже, одним з основних завдань метаболічної терапії є гальмування окислення ВЖК і переключення метаболізму кардіоміоцита на окислення глюкози з більш ефективним використанням залишкового кисню [10–13].
З урахуванням різнобічності патогенетичних механізмів формування, прогресування ІХС, а також розмаїття механізмів захисту міокарда класифікація медикаментозних засобів із кардіопротективними властивостями є дещо умовною. Так, серед широко–вживаних груп препаратів із кардіопротективним ефектом виділяють засоби прямої дії, які безпосередньо зменшують вираженість впливу патогенних факторів на кардіоміоцит, та непрямої дії, які знижують навантаження на серцевий м’яз. Ефект прямих кардіопротекторів обумовлений місцевим впливом на метаболізм безпосередньо в кардіоміоцитах, стабілізацією клітинних мембран, розширенням коронарних судин і центральним впливом на активність нервових центрів, що регулюють судинний тонус [18, 23]. До кардіо–протекторів із прямою дією належить і Тіотриазолін, вітчизняний препарат, який є класичним антиоксидантом. Впливаючи на енергетичні процеси міокарда, він зменшує потребу міокарда в кисні, недостатня кількість якого є основною патофізіологічною детермінантою ішемії міокарда. Окрім того, він стабілізує мембрану кардіоміоцитів, справляє антиаритмічний ефект, має виражену анаболічну здатність.
За умов гіпоперфузії міокарда Тіотриазолін ефективно вирівнює дисбаланс у системі аденінових нуклеотидів АТФ — АДФ — АМФ, запобігає швидкому виснаженню енергетичних ресурсів клітин та переходу їх метаболізму на енергетично менш вигідний анаеробний шлях окислення глюкози.
Знижений вміст креатинфосфокінази при лікуванні хворих на стабільну стенокардію відображає його позитивний вплив на енергетичний обмін і стабілізацію мембран кардіоміоцитів. За умов тканинної гіпоксії Тіотриазолін ефективно корегує зміни в циклі Кребса. За здатністю знижувати рівень молочної, а також підвищувати вміст піровиноградної і яблучної кислот Тіотриазолін втричі переважає пірацетам.
Експериментально встановлена здатність Тіотриазоліну зменшувати на 42 % зону ішемії й некрозу міо–карда, що статистично достовірно було вищим за застосування карнітину хлориду як визнаного антиоксиданту, і це позитивно впливало на показники ішемічного пошкодження міокарда.
Кардіопротективний ефект Тіотриазоліну реалізувався через вплив на біоенергетичний обмін ішемізованого міокарда, що супроводжувалося зростанням рівня ендогенного глікогену й зменшенням рівня ВЖК, що було відтворено на тваринних моделях.
Останнім часом показано, що антиангінозна дія притаманна метаболічним препаратам триметазидину, ранолазину, L–карнітину і вітчизняному препарату Тіотриазоліну.
Численні роботи присвячені вивченню препарату Тіотриазолін у хворих із різними формами ІХС, зокрема стабільною стенокардією. Аналіз досліджень показав, що препарат включали в комплекс метаболічної терапії при лікуванні хворих із стабільною стенокардією І–IV ФК і з вираженими ЕКГ–ознаками ішемії, постінфарктним кардіосклерозом, у тому числі в осіб похилого віку. Якщо триметазидин суттєво не впливав на показники кардіогемодинаміки, статистично достовірно не змінював рівень систолічного артеріального тиску й частоту серцевих скорочень, то при лікуванні Тіотриазоліном хворих із постінфарктним кардіосклерозом було встановлено покращання як систолічної, так і діастолічної функції лівого шлуночка [3, 5, 9, 15, 19]. Установлено, що комплексна терапія хворих із пост–інфарктною стенокардією з використанням нітросорбіду, фенігідину й Тіотриазоліну позитивно впливає на внутрішньосерцеву гемодинаміку не лише завдяки зниженню переднавантаження (нітросорбід), постнавантаження (фенігідин), але й за рахунок підвищення інотропної функції серця, кардіопротекторної дії Тіотриазоліну як засобу метаболічної корекції ішемізованого міокарда. Хронічне порушення перфузії тканин міокарда, пов’язане з атеросклеротичним ураженням коронарних судин, що обумовлює метаболічний енергодефіцит, є тією мішенню, на яку спрямована дія Тіотриазоліну як метаболічного засобу.
У роботах, присвячених застосуванню Тіотриазоліну у хворих на ІХС незалежно від функціонального класу стенокардії в поєднанні із гіпертонічною хворобою, показано сприятливий вплив препарату на перебіг захворювання. Відзначені зменшення вираженості больового синдрому й відновлення серцевого ритму в цієї групи хворих. У хворих зі стенокардією знижувалася кількість ангінозних нападів, збільшувалась толерантність до фізичних навантажень і зменшувалась гіперліпідемія [7, 9, 12].
Установлено, що клінічний ефект Тіотриазоліну обумовлений протиішемічними, антиоксидантними, мембраностабілізуючими й імуномодулюючими властивостями. Тіотриазолін підсилює компенсаторну активацію анаеробного гліколізу, зменшує пригнічення процесів окислення в циклі Кребса зі збереженням внутрішньоклітинного АТФ. Препарат активує антиоксидантну систему й гальмує процеси окислення ліпідів в ішемізованих ділянках міокарда, зменшує чутливість міокарда до катехоламінів, запобігає прогресуванню погіршення скоротливої здатності серця, стабілізує й зменшує зони некрозу й ішемії міокарда. Антиоксидантний ефект реалізується завдяки наявній в структурі молекули іона сірки, через реактивацію антирадикальних ферментів супероксиддисмутази, глутатіонпероксидази, каталази; завдяки зниженню рівня малонового альдегіду й дієнових кон’югат, вільних радикалів, що зменшує оксидативний стрес і процеси вільнорадикального окислення. У хворих на ІХС як додаткову терапію Тіотриазолін призначають при гострому ІМ, стенокардії напруження і спокою, постінфарктному кардіосклерозі, аритміях.
Позитивною стороною описаних препаратів є їх метаболічна нейтральність і спрямованість на глибинні метаболічні механізми розвитку ішемії, виражена кардіоцитопротекція. Препарати метаболічної дії, впливаючи на синтез та утилізацію енергетичних процесів, збільшують стійкість тканин до гіпоксії й наслідків реперфузії, а також при серцевій недостатності ішемічного генезу [6]. Подібно до Тіотриазоліну, триметазидин, як один із поширених метаболічних препаратів у кардіологічній практиці, також інгібує окислення жирних кислот; його дія реалізується пригніченням у міокарді метаболізму ВЖК, які вимагають для утворення такої ж кількості АТФ на 17 % більше кисню, ніж окислення глюкози, і за рахунок селективного інгібування 3–-кетоацил–-КоА–-тіолази — ферменту, відповідального за /42/b-42.jpg) –окислення жирних кислот. На відміну від Тіотриазоліну дія триметазидину проявляється лише при хронічних формах ІХС, у той час як при гострому ІМ вираженого впливу він не справляє. Його ефект настає не відразу, а з часом, який так необхідний для пристосування й стабілізації метаболізму. Триметазидин збільшує окислення пірувату й гліколітичну продукціїю АТФ, гальмує накопичення лактату й розвиток ацидозу, пригнічуючи вільнорадикальне окислення. Подібно до триметазидину інший метаболічний препарат ранолазин, дериват піперазину, також є інгібітором окислення жирних кислот, хоча його біохімічна мішень поки ще не встановлена й на українському фармацевтичному ринку він дотепер не зареєстрований. Препарат зменшує частоту нападів стенокардії, підвищує толерантність до фізичного навантаження. Його антиішемічний ефект обумовлений обмеженим використанням як енергетичного субстрату вільних жирних кислот і підвищенням використання глюкози. Це призводить до утворення більшої кількості АТФ на кожен моль спожитого кисню. Проте ранолазин нездатний справляти антиангінальний ефект за умов монотерапії, через що застосовується у хворих на ІХС поряд із –адреноблокаторами і блокаторами кальцієвих каналів.
–окислення жирних кислот. На відміну від Тіотриазоліну дія триметазидину проявляється лише при хронічних формах ІХС, у той час як при гострому ІМ вираженого впливу він не справляє. Його ефект настає не відразу, а з часом, який так необхідний для пристосування й стабілізації метаболізму. Триметазидин збільшує окислення пірувату й гліколітичну продукціїю АТФ, гальмує накопичення лактату й розвиток ацидозу, пригнічуючи вільнорадикальне окислення. Подібно до триметазидину інший метаболічний препарат ранолазин, дериват піперазину, також є інгібітором окислення жирних кислот, хоча його біохімічна мішень поки ще не встановлена й на українському фармацевтичному ринку він дотепер не зареєстрований. Препарат зменшує частоту нападів стенокардії, підвищує толерантність до фізичного навантаження. Його антиішемічний ефект обумовлений обмеженим використанням як енергетичного субстрату вільних жирних кислот і підвищенням використання глюкози. Це призводить до утворення більшої кількості АТФ на кожен моль спожитого кисню. Проте ранолазин нездатний справляти антиангінальний ефект за умов монотерапії, через що застосовується у хворих на ІХС поряд із –адреноблокаторами і блокаторами кальцієвих каналів.
Попередні дослідження, проведені нами, базувались на екстраполяції механізму дії Тіотриазоліну щодо інших кардіопротекторів, зокрема триметазидину, який розглядався як еталонний кардіопротектор і був внесений ЄТК до рекомендацій з лікування стабільної стенокардії (2006, 2013). Поряд із цим Тіотриазолін, як і триметазидин, є препаратом метаболічної дії, що нормалізує порушення енергетичного обміну. Відомо, що Тіотриазолін за умов гіпоксії зменшує зону некрозу й ступінь деструктивних змін у міокарді та має виражений антиоксидантний ефект [10–13, 20–22].
Завдяки унікальній структурі молекули Тіотриазолін має властивості як прямого, так і непрямого кардіо–протектора, тобто діє безпосередньо як метаболічний препарат, нормалізуючи енергетичні процеси в кардіо–міоциті, й опосередковано — проявляє антиагрегантний та метаболічний ефекти, знижуючи тим самим навантаження на міокард [19].
Показники ефективності метаболічної терапії:
— збільшення тривалості виконуваного навантаження при проведенні тредміл–тесту до появи депресії сегмента ST ≥ 1 мм до закінчення курсу лікування;
— зменшення частоти і вираженості ангінозних нападів;
— збільшення толерантності до фізичних навантажень;
— зменшення кількості епізодів ішемії та кількості прийнятих таблеток нітрогліцерину за тиждень (нітрогліцериновий поріг) до закінчення курсу лікування;
— зменшення кількості епізодів ішемії та сумарної тривалості епізодів ішемії за добу за даними добового моніторування ЕКГ.
Основною метою дослідження була оцінка ефективності, переносимості препарату Тіотриазолін виробництва ПАТ «Галичфарм», Україна, у пацієнтів з ІХС, стабільною стенокардією напруження ІІ–ІІІ ФК в ін’єкційній формі 25 мг/мл для внутрішньом’язового введення впродовж двох тижнів за різних дозових режимів — 50 та 200 мг/добу при курсовому застосуванні в складі комплексної терапії порівняно зі стандартною терапією.
Завдання дослідження: доведення ефективності препарату Тіотриазолін у вигляді розчину для ін’єкцій, 25 мг/мл (виробництво ПАТ «Галичфарм», Україна), у добовій дозі 200 мг порівняно з добовою дозою 50 мг у пацієнтів з ІХС, стабільною стенокардію напруження ІІ–ІІІ функціонального класу. Клінічне дослідження проводилося як відкрите, порівняльне, рандомізоване й виконувалося відповідно до вимог, що висуваються Державним фармакологічним центром МОЗ України.
Матеріали і методи дослідження
У дослідження був залучений 101 хворий; у зв’язку із тим, що один пацієнт із контрольної групи відкликав інформовану згоду до завершення дослідження, в аналіз було включено 100 хворих (56 чоловіків та 44 жінки віком 40–70 років; середній вік 61,1 ± 1,9 року) на ІХС, стабільну стенокардію напруження ІІ–ІІІ ФК. Хворі були розділені на 3 групи. Контрольна група включала 24 пацієнтів, які отримували стандартну терапію /42/b-42.jpg) -–адреноблокаторами, антагоністами кальцію, інгібіторами ангіотензинперетворюючого ферменту, блокаторами рецепторів ангіотензину, статинами, антитромбоцитарними препаратами. Першу основну групу становили 40 хворих, які отримували, окрім стандартної терапії, Тіотриазолін по 2 мл розчину внутрішньом’язово 1 раз на добу (добова доза 50 мг). Друга основна група включала 36 хворих, які на фоні стандартної терапії отримували по 4 мл розчину Тіотриазоліну внутрішньом’язово двічі на добу, що становило 200 мг добової дози.
-–адреноблокаторами, антагоністами кальцію, інгібіторами ангіотензинперетворюючого ферменту, блокаторами рецепторів ангіотензину, статинами, антитромбоцитарними препаратами. Першу основну групу становили 40 хворих, які отримували, окрім стандартної терапії, Тіотриазолін по 2 мл розчину внутрішньом’язово 1 раз на добу (добова доза 50 мг). Друга основна група включала 36 хворих, які на фоні стандартної терапії отримували по 4 мл розчину Тіотриазоліну внутрішньом’язово двічі на добу, що становило 200 мг добової дози.
Усі три групи за віком, ІМТ, супутніми і перенесеними захворюваннями статистично не відрізнялися. Етапи обстеження хворих наведено в табл. 3.
Статистична обробка результатів проводилася згідно із затвердженим планом статистичного аналізу. Методи описової статистики: кількісні — n, середнє арифметичне, медіана, стандартне відхилення, мінімальні та максимальні значення; категоріальні — частота та частка у відсотках. Для оцінки значущості кількісних показників застосовували двофакторний дисперсійний аналіз за змішаною моделлю з визначенням нормальності розподілу за допомогою критерію Шапіро — Уїлка (у разі ненормального розподілу проводився аналіз у рангах) із наступним застосуванням конт–растного аналізу для фактору часу. Для категоріальних показників — критерій хі–квадрат Пірсона або точний критерій Фішера. Оцінка значущості між групами проводилась за допомогою парного t–критерію Стьюдента або Манна — Уїтні, залежно від нормальності розподілу даних, оціненого за допомогою критерію Шапіро — Уїлка. Рівень значущості для критерію Шапіро — Уїлка бів прийнятий рівним 0,01, для інших критеріїв — 0,05.
Критерії ефективності оцінювалися на підставі: зменшення числа епізодів болів за типом стенокардії, зменшення потреби в нітрогліцерині (на підставі даних щоденника пацієнта) та збільшення толерантності до фізичного навантаження за даними тредміл–тесту (за протоколом R. Bruce). Критерії переносимості оцінювалися на підставі вітальних даних, даних ЕКТ та лабораторних показників.
Результати досліджень та їх обговорення
Під час клінічних досліджень доведена безпечність використання Тіотриазоліну в добовій дозі як 50 мг, так і 200 мг; використання його доцільно у пацієнтів із стабільною стенокардією напруження ІІ–ІІІ ФК на фоні сучасної базисної терапії, що включає використання нітратів, /42/b-42.jpg) -адреноблокаторів, антагоністів кальцію, антитромбоцитарних препаратів, інгібіторів АПФ, БРА, статинів. Ефективність препаратів оцінювалась за результатами проведеного подвійного тредміл–тесту перед лікуванням та після 14 діб лікування. Порівнюючи ефективність терапії, ми виявили достовірну різницю між групами. Препарати однаково позитивно впливали на перебіг ІХС, стабільної стенокардії напруження ІІ–ІІІ ФК. На фоні лікування Тіотриазоліном на ЕКГ було зареєстровано достовірно меншу частоту шлуночкових екстрасистол як прояв зменшення електричної нестабільності міокарда.
-адреноблокаторів, антагоністів кальцію, антитромбоцитарних препаратів, інгібіторів АПФ, БРА, статинів. Ефективність препаратів оцінювалась за результатами проведеного подвійного тредміл–тесту перед лікуванням та після 14 діб лікування. Порівнюючи ефективність терапії, ми виявили достовірну різницю між групами. Препарати однаково позитивно впливали на перебіг ІХС, стабільної стенокардії напруження ІІ–ІІІ ФК. На фоні лікування Тіотриазоліном на ЕКГ було зареєстровано достовірно меншу частоту шлуночкових екстрасистол як прояв зменшення електричної нестабільності міокарда.
За даними проведених тредміл–тестів на початку лікування та після 14–ї доби було виявлено значне достовірне збільшення тривалості фізичного навантаження до появи ангінозного болю; більшою мірою це проявлялось при внутрішньом’язовому введенні 200 мг/добу Тіотриазоліну. До того ж достовірно збільшився час фізичного навантаження до появи стійкої депресії сегмента ST в обох групах, що свідчить про поліпшення як електрофізіологічних властивостей міокарда, так і його антиішемічної стійкості. Тривалість виконаного фізичного навантаження при проведенні навантажувального тредміл–тесту після закінчення курсу лікування статистично більш значимо зростала при застосуванні Тіотриазоліну в добовій дозі 50 мг (р = 0,011) і в добовій дозі 200 мг (р < 0,001) порівняно із стандартною терапією стабільної стенокардії напруження II–III ФК. Медіана змін тривалості фізичного навантаження при проведенні тредміл–тесту становила в першій основній групі 0,71 хв, у другій основній групі — 1,05 хв, у той час як у контрольній групі — 0,33 хв. Графічно зміни тривалості виконуваного фізичного навантаження при проведенні тредміл–тесту наведено на рис. 2, 3.
Отже, на підставі отриманих результатів можна констатувати:
1. Зростання тривалості виконуваного фізичного навантаження при проведенні тредміл–тесту в першій основній групі було статистично значимо більшим, ніж у контрольній групі (р = 0,011).
2. Зростання тривалості виконуваного фізичного навантаження при проведенні тредміл–тесту в другій основній групі було статистично значимо більшим, ніж у контрольній групі (р = 0,001).
3. Доведена перевищуюча ефективність в основних групах (перша та друга) порівняно зі стандартною терапією (контрольна група) щодо зміни тривалості виконуваного фізичного навантаження при проведенні тредміл–тесту.
Для доведення перевищуючої клінічної ефективності препарату Тіотриазолін, розчин для ін’єкцій, 25 мг/мл (ПАТ «Галичфарм», Україна), у добовій дозі 200 мг порівняно із добовою дозою 50 мг при курсовому застосуванні в комплексній терапії у пацієнтів з ІХС, стабільною стенокардією напруження II–III ФК було виконано порівняння першої та другої основної групи щодо зміни тривалості фізичного навантаження.
Оскільки перша та друга основні групи були початково однорідними, а також з огляду на те, що дані першої основної групи були розподілені ненормально, для порівняння груп було застосовано критерій Манна — Уїтні (табл. 4).
/47/47-2.jpg)
На підставі отриманих результатів можна констатувати, що зростання тривалості виконуваного фізичного навантаження при проведенні тредміл–тесту в другій основній групі було статистично значимо більшим, ніж у першій основній групі (р = 0,008). Це свідчить про перевищуючу ефективність застосування препарату Тіотриазолін, розчин для ін’єкцій, 25 мг/мл, у добовій дозі 200 мг порівняно із добовою дозою 50 мг при курсовому застосуванні в комплексній терапії у пацієнтів з ІХС, стабільною стенокардією напруження II–III ФК.
На тлі застосування Тіотриазоліну відмічено покращення перебігу стабільної стенокардії напруження ІІ–ІІІ ФК, проявом чого було достовірне зменшення кількості нападів стенокардії. На фоні проведеного лікування Тіотриазоліном відмічено зниження більше ніж на 50 % нападів стенокардії в першій основній групі, і це становило 27,5 %, у той час як у другій основній групі це зниження було більш істотним — 66,7 %, а в контрольній — лише на 8,3 %. Таке клінічне покращення супроводжувалось відповідно пропорційним зменшенням кількості таблеток нітрогліцерину на тиждень, так званого нітрогліцеринового порогу. Так, у другій основній групі зменшення прийому таблеток нітрогліцерину на 50 % відмічено в 72,2 % хворих. На фоні проведеного лікування відзначалась тенденція до нормалізації параметрів гемодинаміки — ЧСС, ЧД, САТ, ДАТ.
На підставі проведеного аналізу між першою та другою основною групою можна дійти висновку, що частка пацієнтів зі зменшенням кількості нападів стенокардії на тиждень на 50 % і більше та частка пацієнтів зі зменшенням кількості прийнятих таблеток нітрогліцерину на тиждень на 50 % і більше в другій основній групі була статистично значимо більшою (р = 0,001 для обох змінних), ніж в першій основній групі. Це свідчить на користь більшої ефективності терапії в другій основній групі.
Оцінка переносимості та побічних явищ при прийомі Тіотриазоліну в дозі 50 мг/добу і 200 мг/добу
Оцінка переносимості препаратів проведена на підставі аналізу даних об’єктивного обстеження й суб’єктивних відчуттів, про які повідомляли пацієнти, результатів проведеної ЕКГ та лабораторних аналізів. У жодного пацієнта на фоні прийому препаратів не виникло алергічних реакцій, нудоти, бронхообструктивного синдрому та інших побічних явищ, які б потребували відміни препарату. Лише у 3 випадках (по одному випадку у кожній із груп, в тому числі в контрольній) був відмічений неускладнений гіпертензивний криз, що, скоріше за все, обумовлений перебігом основного захворювання, а не небажаним побічним впливом препарату. За даними лабораторних аналізів (загальний аналіз крові, загальний аналіз сечі, біохімічний аналіз крові) клінічно значущих змін не було виявлено, навпаки, спостерігалася тенденція до нормалізації показників. Переносимість обох різнодозових режимів прийому препарату оцінена як добра.
Отже, препарат Тіотриазолін справляє антиішемічний і цитопротекторний ефекти у складі комплексної терапії хронічних серцево–судинних захворювань, підвищує толерантність до фізичних навантажень, знижує частоту нападів стенокардії. Препарат можна комбінувати з антиангінальними, антикоагулянтними, антиагрегантними, антиаритмічними засобами, серцевими глікозидами, діуретичними засобами, він може посилювати дію нітрогліцерину, /42/b-42.jpg) -–адреноблокаторів, антигіпертензивних засобів і периферичних вазодилататорів [3].
-–адреноблокаторів, антигіпертензивних засобів і периферичних вазодилататорів [3].
Висновки
1. Тривалість виконаного навантаження при проведенні навантажувального тесту (тредміл–тесту) за протоколом R. Bruce після закінчення курсу лікування зростає статистично більш значимо (р = 0,011) при застосуванні препарату Тіотриазолін, розчин для ін’єкцій, 25 мг/мл, у добовій дозі 50 мг на фоні стандартної терапії порівняно із застосуванням стандартної терапії при стабільній стенокардії напруження ІІ–ІІІ ФК.
2. Тривалість виконаного фізичного навантаження при проведенні навантажувального тесту (тредміл–тесту) за протоколом R. Bruce після закінчення курсу лікування статистично більш значимо зростає (р < 0,001) при застосуванні препарату Тіотриазолін, розчин для ін’єкцій, 25 мг/мл, у добовій дозі 200 мг на фоні стандартної терапії порівняно із застосуванням стандартної терапії стабільної стенокардії напруження ІІ–ІІІ ФК.
3. Кількість нападів стенокардії на тиждень зменшилась статистично більш значуще при застосуванні препарату Тіотриазолін, розчин для ін’єкцій, 25 мг/мл, у добовій дозі 50 та 200 мг на тлі стандартної терапії порівняно із застосуванням стандартної терапії стенокардії напруження ІІ–ІІІ ФК (р = 0,003 та р < 0,001 відповідно).
4. Тривалість виконаного фізичного навантаження при проведенні навантажувального тесту за протоколом R. Bruce після закінчення курсу лікування статистично значимо більша (р = 0,008) при застосуванні препарату Тіотриазолін, розчин для ін’єкцій, 25 мг/мл, у добовій дозі 200 мг порівняно із застосуванням препарату Тіотриазолін, розчин для ін’єкцій, 25 мг/мл, у добовій дозі 50 мг, що свідчить про перевищуючу ефективність курсового застосування (14 днів) препарату Тіотриазолін у добовій дозі 200 мг (по 4 мл розчину для ін’єкцій, 25 мг/мл, 2 рази на день) над курсовим застосуванням Тіотриазоліну в дозі 50 мг (по 2 мл розчину для ін’єкцій, 25 мг/ мл, 1 раз на день).
5. Кількість прийнятих таблеток нітрогліцерину на тиждень, так званий нітрогліцериновий поріг, зменшилась статистично більш значуще при застосуванні препарату Тіотриазолін, розчин для ін’єкцій, 25 мг/мл,у добовій дозі 50 та 200 мг на тлі стандартної терапії порівняно із застосуванням стандартної терапії стенокардії напруження ІІ–ІІІ ФК (р = 0,007 та р < 0,001 відповідно).
6. Тіотриазолін добре переноситься та є ефективним і безпечним препаратом у терапії хворих на ІХС, стабільну стенокардію напруження ІІ–ІІІ ФК у дозі як 50, так і 200 мг/добу.
Рекомендації
Рекомендовано курсове застосування препарату Тіотриазолін, розчин для ін’єкцій, 25 мг/мл (ПАТ «Галичфарм», Україна), у комплексній терапії пацієнтів II–III ФК, у добовій дозі 200 мг, що призначається по 4 мл (100 мг) внутрішньом’язово 2 рази на день протягом 14 днів.
1. Амосова Е.Н. Метаболическая терапия повреждений –миокарда, обусловленных ишемией. Новый подход к лечению ишемической болезни сердца и сердечной недостаточности // Укр. кардиол. журнал. — 2000. — № 4. — С. 86-92.
2. Бобров В.О., Кулішов С.К. Адаптаційні ішемічні і реперфузійні синдроми у хворих ішемічною хворобою серця: механізми, діагностика, обґрунтування терапії. — Полтава: Дивосвіт, 2004. — 240 с.
3. Визир В.А., Волошина И.Н., Волошин Н.А., Мазур И.А., Беленичев И.Ф. Метаболические кардиопротекторы: фармакологические свойства и применение в клинической практике: Методические рекомендации. — ЗГМУ, 2006. — 13 с.
4. Гагаріна А.А. Кардіопротектори метаболічного ряду тіотриазолін, цитохром, мілдронат в комплексній терапії аритмій серця при некоронарогенних захворюваннях міокарда: Автореф. дис... канд. мед. наук. — Сімферополь, 2001. — 20 с.
5. Губський Ю.І. Біологічна хімія. — К.; Вінниця: Нова книга, 2007. — 656 с.
6. Дейнега В.Г., Мамедов А.М., Шапран Н.Ф., Кондратенко Л.В., Дейнега И.В. Применение тиотриазолина и прерывистой нормобарической гипоксии при лечении больных ИБС с артериальной гипертензией // Актуальні питання фармацевтичної та медичної науки i практики: Зб. наук. ст. — Запоріжжя, 2002. — Вип. 8. — С. 64-70.
7. Діагностика та лікування хронічної серцевої недостатності. Головні положення рекомендацій Європейського кардіологічного товариства — 2006. Частина ІІ // Серце і судини. — 2006. — № 2. — С. 24-33.
8. Зупанец И.А., Безугла Н.П., Подружников Ю.В. Изучение биоэквивалентности препаратов Вазонат и Милдронат: основа доказательной медицины и фармации // Ліки України. — 2009. — № 5 (131). — С. 72-75.
9. Коваленко В.Н. Сердечно-сосудистые заболевания: новый шаг на пути к решению проблемы // Здоров’я України. — 2009. — № 19. — С. 10.
10. Мазур И.А., Волошин Н.А., Чекман И.С., Зименковский Б.С., Стец В.Р. Tиотриазолин: фармакологические аспекты и клиническое применение. — Запорожье, 2005. — 160 с.
11. Малая Л.Т., Корж А.Н., Балковая Л.Б. Эндотелиальная дисфункция при патологии сердечно-сосудистой системы. — Харьков: Торсинг, 2000. — 432 с.
12. Пархоменко А.Н. Жизнеспособный миокард и кардиоцитопротекция: возможности метаболической терапии при острой и хронической формах ишемической болезни сердца // Укр. мед. часопис. — 2001. — № 3 (23). — С. 5-11.
13. Приходько В.Ю. Метаболическая терапия при сердечно-сосудистых заболеваниях // Ліки України. — 2009. — № 5 (131). — С. 61-64.
14. Поливода С.Н., Черепок А.А., Рекалов Д.Г. Медикаментозное лечение стабильной стенокардии. Роль метаболических средств // Укр. кардіол. журн. — 2005. — № 5.
15. Поливода С.Н., Черепок А.А., Сычев Р.А. Коррекция эндотелиальной дисфункции у больных гипертонической болезнью: эффективность и патофизиологическое обоснование применения тиотриазолина // Медицина світу. — 2004. — С. 18-20.
16. Сиволап В.Д. Оптимізація терапії післяінфарктної стенокардії тіотриазоліном // Журнал практичного лікаря: Спец. інформ. вид. — 2003. — № 5. — С. 57-59.
17. Стан здоров’я народу України у зв’язку із хворобами системи кровообігу та можливі шляхи його покращання: Аналітично-статистичний посібник для лікарів-кардіологів, ревматологів, терапевтів загальної практики / За ред. В.М. Коваленка. — К., 2004. — 124 с.
18. Шилов А.М. Некоторые особенности патогенеза ишемической болезни сердца // РМЖ. — 2007. — Т. 15, № 9. — С. 23-29.
19. Чекман І.С., Горчакова Н.А., Загородній М.І. Кардіопротектори метаболічної дії: доцільність експериментального і клінічного вивчення // Запорожский мед. журн. — 2003. — № 2. — С. 251-252.
20. Яковлева О.А., Савченко Н.П., Стопинчук А.В., Семененко И.Ф. Влияние тиотриазолина на состояние эндотелиальной дисфункции и липидно-перекисный дисбаланс при моно- и комбинированной терапии с метопрололом у больных ИБС // Актуальні питання фармацевтичної та медичної науки і практики. — Запоріжжя, 2002. — Вип. 8. — С. 245-249.
21. Di Napoli P., Taccardi A.A., Barsotti A. Long term cardioprotective action of trimetazidine and potential effect on the inflammatory process in patients with ischaemic dilated cardiomyopathy // Heart. — 2005. — 91. — Р. 161-5.
22. Hueb W. et al. The Medicine, Angioplasty or Surgery trial (MASS-II): a randomized, controlled, clinical trial of three therapeutic strategies for multivessel coronary artery disease. One-year results // J. Amtr. Coll. Cardiology. — 2004. — Vol. 43. — P. 1743-1751.
23. Guidelines on management of stable angina pectoris. European Society of Cardiology, 2006.
24. Kantor P.F., Lucien A., Kozak R. et al. The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial long-chain 3-ketoacyl coenzyme A thiolase // Circ. Res. — 2000. — Vol. 86. — P. 580-586.
25. Lee L., Horowitz J., Frenneaux M. Metabolic manipulation in ischaemic heart disease, a novel approach to treatment // Eur. Heart J. — 2004. — 25. — Р. 634-41.

/42/42.jpg)
/45/45.jpg)
/46/46.jpg)
/47/47-1.jpg)
/47/47-3.jpg)
/48/48.jpg)