Журнал «» 3 (41) 2015
Вернуться к номеру
Взаємозв’язок між лептинорезистентністю та серцево-судинним ризиком у хворих із гіпертонічною хворобою та метаболічним синдромом
Авторы: МІТЧЕНКО О.І., РОМАНОВ В.Ю., КУЛИК О.Ю., ЯКУШКО Л.В. - ДУ «ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска» НАМН України, м. Київ
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Метою роботи було вивчити взаємозв’язок між лептинорезистентністю та серцево-судинним ризиком у хворих із гіпертонічною хворобою (ГХ) та метаболічним синдромом (МС). Обстежено 160 пацієнтів із ГХ II стадії та МС. У 84 пацієнтів визначали рівень SOB-R-рецепторів, серед них 43 жінки та 41 чоловік, які були поділені на клінічні групи залежно від порушень вуглеводного обміну. Виявлено, що у хворих із ГХ і МС лептинорезистентність за показниками вільного лептинового індексу асоціюється із зростанням виявлення факторів серцево-судинного ризику. Установлено корелятивний зв’язок між вільним лептиновим індексом і факторами серцево-судинного ризику, такими як окружність талії, індекс маси тіла, холестерин, тригліцериди, холестерин ліпопротеїдів високої щільності, та глюкозою та рівнем артеріального тиску в жіночих та чоловічих групах. Визначено, що обрахування серцево-судинного ризику у хворих із ГХ та МС за стандартною шкалою SCORE не дозволяє максимально виділити когорту хворих із високим серцево-судинним ризиком, оскільки не враховує вплив на його рівень надлишкової маси тіла та порушень вуглеводного обміну. Додаткове використання шкал SСOREBMI, PROCAM, FRAMINGHAM, DRS дозволяє оптимізувати виявлення хворих із високим і дуже високим кардіометаболічним ризиком. Установлено, що в пацієнтів із ГХ, МС та цукровим діабетом високий ризик ускладнень за шкалою IRIS II асоціювався з найбільшими проявами лептинорезистентності за визначенням вільного лептинового індексу, що становив 5,45 ± 1,09 у групі жінок та 4,5 ± 1,6 у групі чоловіків, що дозволяє використовувати вільний лептиновий індекс для оптимізації раннього виявлення ускладнень у хворих із цукровим діабетом.
Целью работы было изучить взаимосвязь между лептинорезистентностью и сердечно-сосудистым риском у больных с гипертонической болезнью (ГБ) и метаболическим синдромом (МС). Обследовано 160 пациентов с ГБ II стадии и МС. У 84 пациентов определяли уровень SOB-R-рецепторов, среди них 43 женщины и 41 мужчина, которые были разделены на клинические группы в зависимости от нарушений углеводного обмена. Выявлено, что у больных с ГБ и МС лептинорезистентность по показателям свободного лептинового индекса ассоциируется с ростом выявления факторов сердечно-сосудистого риска. Установлена корреляционная связь между свободным лептиновым индексом и факторами сердечно-сосудистого риска, такими как окружность талии, индекс массы тела, холестерин, триглицериды, холестерин липопротеидов высокой плотности, и глюкозой и уровнем артериального давления в женских и мужских группах. Определено, что стратификация сердечно-сосудистого риска у больных с ГБ и МС по стандартной шкале SCORE не позволяет максимально выделить когорту больных с высоким сердечно-сосудистым риском, поскольку не учитывает влияние на его уровень избыточной массы тела и нарушений углеводного обмена. Дополнительное использование шкал SСOREBMI, PROCAM, FRAMINGHAM, DRS позволяет оптимизировать выявление больных с высоким и очень высоким кардиометаболическим риском. Установлено, что у пациентов с ГБ, МС и сахарным диабетом высокий риск осложнений по шкале IRIS II ассоциировался с наибольшими проявлениями лептинорезистентности по определению свободного лептинового индекса, который составил 5,45 ± 1,09 в группе женщин и 4,5 ± 1,6 в группе мужчин, что позволяет использовать свободный лептиновый индекс для оптимизации раннего выявления осложнений у больных с сахарным диабетом.
Objective of the study was to investigate the correlation between leptin resistance and cardiovascular risk in patients with essential hypertension (EH) and metabolic syndrome (MS). The study involved 160 patients with stage II EH and MS. In 84 patients, we have determined the level of SOB-R-receptors, among them 43 women and 41 men who were divided into groups depending on carbohydrate metabolism disorders. It is found that in patients with EH and MS, leptin resistance, according to free leptin index, is associated with the growth in identifying the factors of cardiovascular risk. A correlative relationship has been established between free leptin index and factors of cardiovascular risk, such as waist circumference, body mass index, cholesterol, triglycerides, high-density lipids cholesterol, and glucose level and blood pressure in female and male groups. It is found that calculating cardiovascular risk in patients with EH and MS by a standard SCORE scale doesn’t enable to select maximally a cohort of patients with high cardiovascular risk because it does not take into account the impact on the level of overweight and carbohydrate metabolism disorders. Additional use of SCOREBMI, PROCAM, FRAMINGHAM, DRS scales enables to optimize the detection of patients with high and very high cardiometabolic risk. It is established that in patients with EH, MS and diabetes mellitus, the high risk for complications by IRIS II scale has been associated with most significant manifestations of leptin resistance by definition of free leptin index, which was 5.45 ± 1.09 in the group of women and 4.5 ± 1.6 in the group of men, that makes it possible to use free leptin index to optimize early detection of complications in patients with diabetes mellitus.
лептинорезистентість, метаболічний синдром, серцево-судинний ризик.
лептинорезистентность, метаболический синдром, сердечно-сосудистый риск.
leptin resistance, metabolic syndrome, cardiovascular risk.
Статья опубликована на с. 51-58
Серцево–судинні захворювання є основною причиною смерті у всьому світі. За оцінками ВООЗ, щорічні втрати досягають більше 17 мільйона осіб, що становить 30 % від усіх випадків смерті. У 2013 році хвороби системи кровообігу (ХСК) стали причиною 65,8 % всіх смертей в Україні, що є найвищим показником із–поміж країн Європейського союзу [2] В Україні близько 12 мільйонів осіб хворіють на гіпертонічну хворобу (ГХ), що становить майже 30 % дорослого населення. Сучасні погляди на профілактику артеріальної гіпертензії базуються на концепції сумарного серцево–судинного ризику (ССР), основні положення якої висвітлено в настановах Європейського товариства кардіологів із ведення пацієнтів з артеріальною гіпертензією, дисліпідеміями [3, 10, 14, 17]. Суть концепції полягає в комплексному підході до стратифікації ССР, що дозволяє з–поміж контингенту хворих на артеріальну гіпертензію виділяти осіб із несприятливим прогнозом й більш агресивно впливати на фактори ризику.
Загальновідомим є часте поєднання з артеріальною гіпертензією таких факторів ризику, як абдомінальне ожиріння, гіпертригліцеридемія, зниження рівня холестерину ліпопротеїдів високої щільності (ХС ЛПВЩ) та підвищення рівня глюкози, що формують поняття метаболічного синдрому. Наявність метаболічного синдрому (МС) подвоює ризик розвитку ХСК упродовж найближчих 5–10 років та в 3–6 разів збільшує ризик виникнення цукрового діабету (ЦД) ІІ типу. Крім того, у таких пацієнтів збільшується рівень смертності від ХСК [1, 4–7]. За даними Фремінгемського дослідження, що включало близько 5 тисяч осіб віком від 18 до 74 років, комбінація 3 і більше компонентів МС призводить до збільшення ризику ішемічної хвороби серця (ІХС) у 2,4 раза в чоловіків і в 5,9 раза в жінок [1, 8]. Одним із компонентів метаболічного синдрому є абдомінальне ожиріння. Як відомо, жирова тканина є ендокринним органом, що синтезує велику кількість адипоцитокінів. Лептин — пептидний гормон, що продукується білою жировою тканиною, бере участь у регуляції харчової поведінки й енергообміну [12, 13, 15, 18]. Рецептори до лептину експресуються в багатьох тканинах, включаючи серцево–судинну систему, а гіперлептинемія нерідко поєднується з дисліпідемією, гіперглікемією, артеріальною гіпертензією. Високий рівень лептину в плазмі також часто поєднується з активацією симпатичної нервової системи, ендотеліальною дисфункцією, оксидативним стресом, прозапальними та протромботичними порушеннями. Деякі дослідники вважають, що низький рівень розчинного рецептора лептину та низька частка зв’язаного лептину є маркерами лептинорезистентності, незалежно пов’язані з інсулінорезистентністю й абдомінальним ожирінням і можуть служити додатковим маркером МС [9, 11, 16, 19] В умовах лептинорезистентності відбувається порушення фізіологічної регуляції вироблення інсуліну, що може призвести до розвитку гіперінсулінемії та сприяти маніфестації цукрового діабету 2–го типу в осіб із надмірною масою тіла [2]. Виявлення в клінічній практиці пацієнтів із МС є важливим заходом, тому що практично всі його компоненти піддаються модифікації за допомогою як медикаментозних, так і немедикаментозних заходів корекції [4]. Нормалізація маси тіла відіграє провідну роль у лікуванні пацієнтів із МС: зменшення вмісту вісцерального жиру сприяє корекції інших компонентів МС та є профілактикою розвитку ЦД 2–го типу в пацієнтів із порушенням толерантності до глюкози [1]. Останнім часом багато що стало відомо про роль лептину та SOB–R–рецепторів у розвитку та прогресуванні ожиріння, інсулінорезистентності, атерогенної дисліпідемії, але деякі питання залишаються досі відкритими, що потребує подальшого проведення досліджень у пацієнтів із гіпертонічною хворобою та метаболічним синдромом.
Тому метою нашої роботи було вивчити взаємозв’язок між лептинорезистентністю та серцево–судинним ризиком у хворих із гіпертонічною хворобою та метаболічним синдромом.
Матеріали та методи
На базі відділу дисліпідемій ДУ «ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска» НАМН України було обстежено 160 пацієнтів із гіпертонічною хворобою II стадії та метаболічним синдромом. У 84 пацієнтів визначали рівень SOB–R–рецепторів, серед них 43 жінки та 41 чоловік. Діагноз ГХ установлювався відповідно до рекомендацій Української асоціації кардіологів 2013 року. Гіпертензія в групі пацієнтів із ГХ була 1–го та 2–го ступеня (м’яка та помірна АГ). МС визначався за Консенсусом із метаболічного синдрому 2009 р. та рекомендаціями Європейського товариства кардіологів із профілактики ССЗ 2012 р.
Аналіз даних проводився окремо в жіночих та чоловічих групах з урахуванням статевих різниць у нормативних величинах. Беручи до уваги гендерні норми рівнів лептину, клінічні групи окремо для жінок та чоловіків розподілили так: 1–шу групу обстежених становили пацієнти з ГХ та МС без порушень вуглеводного обміну; до 2–ї групи увійшли пацієнти з ГХ, МС та інсулінорезистентністю (ІР) без цукрового діабету (ЦД) та порушеної толерантності до вуглеводів; до 3–ї групи — пацієнти з ГХ, МС та порушеною толерантністю до вуглеводів; до 4–ї групи — пацієнти з ГХ, МС і ЦД. Середній вік пацієнтів становив 47,50 ± 2,89 року. До 1–ї групи увійшло 11 жінок з індексом маси тіла (ІМТ) 27,4 ± 1,4 і 11 чоловіків із ІМТ 27,2 ± 1,7, до 2–ї групи — 12 жінок з ІМТ 28,4 ± 1,7 та 10 чоловіків із ІМТ 31,9 ± ± 2,0, до 3–ї групи — 10 жінок з ІМТ 32,3 ± 4,0 та 10 чоловіків з ІМТ 34,0 ± 2,3 та до 4–ї групи — 10 жінок з ІМТ 33,0 ± 1,5 і 10 чоловіків з ІМТ 35,7 ± 0,9. Аналіз даних проводився з урахуванням нормативних величин індексу маси тіла (ІМТ), інсуліну натще, НОМА–індексу, рівнів лептину, розчинних рецепторів до лептину та їх співвідношення (лептин/рецептори до лептину). Референтною величиною лептину для жінок була визначена 16,3 ± 3,3 нг/мл, для чоловіків — 3,5 ± 0,3 нг/мл.
Усім хворим проводили визначення серцево–судинного ризику, використовуючи такі шкали ризику: SCORE (стандартна шкала), SCOREHDL (з урахуванням ХС ЛПВЩ), SСOREBMI (з урахуванням ІМТ), PROCAM, FRAMINGHAM, DRS, IRIS II.
Шкала SCORE (Systematic Coronary Risk Evaluation) розроблена для оцінки ризику розвитку фатальних серцево–судинних подій протягом 10 років. Використовували шкалу SCORE для країн із високим ризиком серцево–судинних захворювань, до яких відноситься і Україна. Стандартна шкала SCORE включає вік, загальний холестерин (ЗХС), систолічний артеріальний тиск (САТ) та наявність паління. Крім стандартної шкали SCORE, використовувалася шкала, що містить поправку на рівень ХС ЛПВЩ (SCOREHDL), та шкала, в якій враховано показник індексу маси тіла (SCOREBMI). Відповідно до показника серцево–судинного ризику, що було отримано при використанні шкал SCORE, хворі були віднесені до однієї з чотирьох груп ризику — низького, помірного, високого чи дуже високого. Групі низького серцево–судинного ризику відповідав 10–річний ризик настання фатальної серцево–судинної події < 1 %, у групі помірного ризику показник становив 1 % ≤ SCORE < 5 %, у групі високого ризику — 5 % ≤ SCORE < 10 %, у групі дуже високого серцево–судинного ризику показник становив ≥ 10 %.
Шкала серцево–судинного ризику PROCAM (Prospective Cardiovascular Munster) дає значно точніші дані щодо визначення сумарного ризику. Модель, що розроблена на підставі результатів проспективного дослідження PROCAM (Мюнстер, Німеччина), оцінює ризик розвитку серцево–судинних подій у найближчі 10 років з урахуванням кардіометаболічних факторів ризику. Для розрахунку сумарного ризику в цій моделі використовується значно більше факторів ризику: вік, ІМ у сімейному анамнезі, статус куріння, САТ, тригліцериди, ХС ЛПНЩ, ХС ЛПВЩ, рівень глюкози натще. Прогнозований ризик має 2 градації: низьку (< 20 %) і високу ( > 20 %).
Шкала FRAMINGHAM — це перша модель оцінки сумарного серцево–судинного ризику. Вона була розроблена на підставі найтривалішого проспективного дослідження (Framingham Heart Study, 1949–1984 рр.), проведеного в американському місті Фрамінгем. Американська шкала ризику дозволяє прогнозувати ризик розвитку серцево–судинних подій, включаючи маніфестацію ІХС у найближчі 10 років. Прогнозований ризик має 2 градації: низький (< 20 %) і високий (> 20 %). Для розрахунку ризику враховуються такі фактори: стать, вік, куріння, ЗХС, ХС ЛПВЩ, рівень артеріального тиску, цукровий діабет.
Проводили стратифікацію загального серцево–судинного ризику, згідно з рекомендаціями ESH (2013), на категорії низького, помірного, високого та дуже високого ризику, залежно від САТ, ДАТ, наявності факторів ризику, безсимптомного ураження органів–мішеней, діабету, стадії хронічного захворювання нирок або клінічно–маніфестних серцево–судинних захворювань. Класифікація на низький, помірний, високий та дуже високий ризик у цих рекомендаціях збережена й означає 10–річний загальний серцево–судинний ризик відповідно до визначення, даного в рекомендаціях ESC із профілактики 2012 р.
Використовування шкали DRS (The Diabetes Risk Score) прогнозує 10–річний ризик розвитку ЦД 2–го типу, що потребуватиме медикаментозного лікування. Враховуються вік, зріст, ІМТ, ОТ, антигіпертензивна терапія, наявність високих показників глюкози в анамнезі, рівень фізичної активності протягом тижня, вживання овочів і фруктів. Сума балів: < 9 балів — низький ризик, ≥ 9 балів — високий ризик.
Шкала IRIS II дозволяє прогнозувати ризик мікро– та макросудинних ускладнень при цукровому діабеті. Сума балів: < 70 балів — низький ризик, ≥ 70 балів — високий ризик.
Статистичну обробку отриманих результатів проведено стандартними методами варіаційної статистики з використанням пакета статистичних програм Statistica 6.0. Результати наведено як M ± m, де М — середнє значення показника, m — стандартна помилка. Вірогідність відмінностей між показниками, що вивчаються, визначалася за допомогою двовибіркового критерію Стьюдента.
Результати та їх обговорення
Аналіз рівнів лептину та рецепторів до лептину в жінок із ГХ та МС продемонстрував, що найвищі рівні лептину (61,96 ± 9,51 нг/мл) були зареєстровані в жінок 4–ї групи, до якої ввійшли пацієнтки з ГХ, МС та ЦД з найвищими значеннями ІМТ, на відміну від рівнів лептину пацієнток 1–ї групи без проявів порушень вуглеводного обміну (27,99 ± 5,65 нг/мл) (табл. 1). Навпаки, концентрація sOb–R–рецепторів була найвищою (19,14 ± 1,94 нг/мл) у жінок 1–ї групи та зменшувалася відповідно до збільшення проявів порушень вуглеводного обміну та збільшення маси тіла. Таким чином, найнижча концентрація sOb–R–рецепторів була виявлена в жінок із МС та ЦД, що увійшли до 4–ї групи (14,44 ± 1,60 нг/мл). У жінок цієї групи був найбільший ІМТ (33,03 ± 1,52 кг/м2) на відміну від жінок 1–ї групи без порушень вуглеводного обміну, у яких показник ІМТ був найнижчим серед порівнюваних груп і відповідно становив 27,44 ± 1,41 кг/м2. Виявлено корелятивний зв’язок між рівнем лептину, ОТ (r = 0,52, p < 0,05) та ІМТ (r = 0,56, p < 0,05). Корелятивний зв’язок між вільним лептиновим індексом та ОТ становив: r = 0,60, p = 0,05, з ІМТ — r = 0,61, p < 0,05. Установлено середній корелятивний зв’язок між рівнем лептину, загального холестерину (r = 0,45, p < 0,05), рівнем тригліцеридів (r = 0,32, p < 0,05) та обернений корелятивний зв’язок із ХС ЛПВЩ (r = –0,47, p < 0,05). Корелятивний зв’язок був вищим між вільним лептиновим індексом та цими ж показниками: корелятивний — із рівнем ЗХС (r = 0,49, p < 0,05), тригліцеридів (r = 0,37, p < 0,05) та обернений корелятивний — із ХС ЛПВЩ (r = –0,56, p < 0,05). Також відмічався корелятивний зв’язок лептину з рівнем глюкози (r = 0,34, p < 0,05) та вільного лептинового індексу з рівнем глюкози (r = 0,48, p < 0,05). У групах виявлено корелятивний зв’язок між рівнем лептину та САТ (r = 0,50, p < 0,05) і ДАТ (r = 0,41, p < 0,05). Корелятивний зв’язок між вільним лептиновим індексом і САТ становив r = 0,46 (p < 0,05) та ДАТ — r = 0,39 (p < 0,05).
Схожа тенденція була отримана в чоловічих групах. Найвищу концентрацію рівнів лептину було виявлено в пацієнтів 4–ї групи — 52,52 ± 12,24 нг/мл, до якої увійшли чоловіки з МС і ЦД, що вірогідно відрізнялися від рівнів лептину пацієнтів 1–ї групи (12,42 ± 2,73 нг/мл) без порушень вуглеводного обміну (табл. 2.) Прогресування ознак гіперлептинемії також асоціювалося з тенденцією до зменшення рівнів sOb–R–рецепторів, що були найнижчими (15,60 ± 1,25 нг/мл) у пацієнтів 4–ї групи, а найвищими — у пацієнтів 1–ї (20,09 ± 4,02 нг/мл). У чоловіків 4–ї групи був виявлений найбільший індекс маси тіла (35,70 ± 0,91 кг/м2). У чоловіків 1–ї групи без порушень вуглеводного обміну ІМТ був найнижчим серед порівнюваних груп і становив 27,27 ± 1,69 кг/м2. Як і в жіночих групах, у чоловіків було виявлено корелятивний зв’язок між рівнем лептину та САТ (r = 0,55, p < 0,05) та рівнем ДАТ (r = 0,32, p < 0,05), відповідно між вільним лептиновим індексом та САТ (r = 0,59, p < 0,05) та ДАТ (r = 0,31, p < 0,05). У чоловічих групах також виявлено корелятивний зв’язок між рівнем лептину, ОТ (r = 0,42, p < 0,05) та ІМТ (r = 0,48, p < 0,05). Корелятивний зв’язок між вільним лептиновим індексом та ОТ становив: r = 0,36, p < 0,05, та ІМТ: r = 0,44, p < 0,05. Установлено корелятивний зв’язок між рівнем лептину та загального холестерину (r = 0,32, p < 0,05), між вільним лептиновим індексом та рівнем загального холестерину (r = 0,36, p < 0,05). Також відмічався корелятивний зв’язок лептину з рівнем глюкози (r = 0,34, p = 0,05) та вільного лептинового індексу з рівнем глюкози (r = 0,48, p < 0,05).
Отже, у результаті проведеного аналізу виявлено корелятивний зв’язок лептину та вільного лептинового індексу з такими факторами серцево–судинного ризику, як ОТ, ІМТ, холестерин, тригліцериди, ХС ЛПВЩ, між глюкозою та рівнем артеріального тиску в жіночих та чоловічих групах.
З метою оцінки серцево–судинного ризику всім хворим було проведено стратифікацію серцево–судинного ризику з використанням шкал SCORE, SCOREHDL (з урахуванням ХС ЛПВЩ), SСOREBMI (з урахуванням ІМТ), PROCAM, DRS, FRAMINGHAM, IRIS II. Відповідно до показника ССР, що був отриманий при використанні шкал, хворі в групах були віднесені до однієї з чотирьох груп ризику — низького, помірного, високого чи дуже високого.
Під час використання шкали SCORE серед жінок 1–ї групи було виявлено 9 % пацієнток із низьким та 91 % пацієнток із помірним ризиком, тоді як у пацієнток 3–ї групи, до якої ввійшли пацієнтки з ГХ, МС та порушеною толерантністю до вуглеводів, 30 % мали помірний ризик, 70 % — високий ризик; пацієнтки 4–ї групи, до якої ввійшли жінки з ГХ, МС та цукровим діабетом, мали дуже високий ризик (100 %) (табл. 3). Під час використання шкали SCOREHDL було виявлено 27 % пацієнток низького ризику та 73 % пацієнток помірного ризику в 1–й групі; 20 % пацієнток помірного ризику та 80 % — високого ризику в 3–й групі; 100 % пацієнток із дуже високим ризиком у 4–й групі. Унаслідок використання шкали SСOREBMI було виявлено 18 % пацієнток низького ризику та 82 % — помірного ризику в 1–й групі; 20 % пацієнток помірного ризику та 80 % — високого ризику в 3–й групі; 100 % пацієнтів із дуже високим ризиком у 4–й групі (табл. 3). Найвищі рівні ССР в обох групах спостерігалися під час використання шкали SСOREBMI, що було пов’язано з наявністю надлишкової маси тіла та ожиріння в обстежуваних групах.
Схожа тенденція виявлена в чоловічих групах. Використовуючи шкалу SCORE серед чоловіків 1–ї групи, було виявлено 82 % пацієнтів із помірним та 18 % — із високим ризиком, тоді як серед пацієнтів 3–ї групи, до якої ввійшли пацієнти з ГХ, МС та порушеною толерантністю до вуглеводів, 20 % мали помірний ризик, 80 % — високий ризик; пацієнти 4–ї групи, до якої ввійшли пацієнти з ГХ, МС та цукровим діабетом, мали дуже високий ризик (100 %) (табл. 4). При використанні шкали SCOREHDL було виявлено 73 % пацієнтів помірного ризику та 27 % — високого ризику в 1–й групі; 30 % пацієнтів помірного ризику та 70 % — високого ризику в 3–й групі; пацієнти 4–ї групи мали дуже високий ризик (100 %). Завдяки використанню шкали SСOREBMI було виявлено 46 % пацієнтів помірного ризику та 54 % пацієнтів високого ризику в 1–й групі; 10 % пацієнток помірного ризику та 90 % пацієнтів високого ризику в 3–й групі; пацієнти 4–ї групи мали дуже високий ризик (100 %) (табл. 4).
За шкалою PROCAM жінки 1–ї групи мали низький ризик (100 %); у 3–й групі 80 % мали низький ризик та 20 % — високий ризик (табл. 5). У 1–й групі також 100 % пацієнтів мали низький ризик, серед чоловіків 3–ї групи 70 % мали низький ризик, 30 % — високий ризик. Чоловіки та жінки 4–ї групи мали високий ризик розвитку гострих коронарних подій в найближчі 10 років (100 % пацієнтів).
За шкалою FRAMINGHAM у 100 % жінок 1–ї групи був виявлений низький ризик, в 3–й групі в 60 % жінок — низький ризик, у 40 % — високий ризик (табл. 6). У 1–й чоловічій групі 100 % пацієнтів мали низький ризик, в 3–й групі 50 % пацієнтів мали низький ризик та 50 % — високий ризик.
Нами проводилася стратифікація загального серцево–судинного ризику залежно від САТ, ДАТ, наявності факторів ризику, безсимптомного ураження органів–мішеней, діабету, хронічної хвороби нирок та клінічно маніфестуючих серцево–судинних захворювань, згідно з ESH 2013 (табл. 7).
За шкалою DRS серед жінок 1–ї групи 73 % пацієнток мали низький ризик, 27 % — високий ризик; у 3–й групі 20 % пацієнтів мали низький ризик та 80 % — високий ризик (табл. 7). Серед чоловіків 1–ї групи 91 % мали низький ризик та 9 % — високий ризик. Серед чоловіків 3–ї групи 10 % мали низький ризик та 90 % — високий ризик.
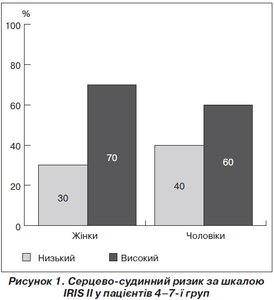
Також ми проаналізували ризик мікро– та макросудинних ускладнень при цукровому діабеті за шкалою IRIS II.
Серед жінок 4–ї групи з гіпертонічною хворобою, метаболічним синдромом та цукровим діабетом 70 % пацієнток мали високий ризик ускладнень, тоді як у чоловічих групах — 60 % відповідно. Це асоціювалося з найбільшими проявами лептинорезистентності за визначенням вільного лептинового індексу, що становив 5,45 ± 1,09 у групі жінок високого ризику за шкалою IRIS II проти 3,1 ± 0,5 у жінок низького ризику за цією ж шкалою. Схожа тенденція відмічалася в чоловічих групах. Так, вільний лептиновий індекс становив 4,5 ± 1,6 у групі чоловіків високого ризику за шкалою IRIS II проти 3,4 ± 1,3 у групі чоловіків низького ризику відповідно.
У результаті проведеного аналізу виявлено, що найчастіше високий ризик визначався в групах жінок та чоловіків 3–ї групи з ГХ, МС і порушеною толерантністю до вуглеводів, пацієнти 4–ї групи мали дуже високий ризик в 100 % випадків, оскільки цю групу становили пацієнти з ГХ, МС та цукровим діабетом. Додаткове використання шкал SCORE, що враховує ІМТ мало переваги, що було пов’язано з наявністю надлишкової маси тіла та ожиріння в обстежуваних групах. Виявлення серцево–судинного ризику за шкалами ризику асоціювалося із зростанням проявів лептинорезистентості за визначенням вільного лептинового індексу з 1,67 ± 0,33 у групі жінок із ГХ, МС без порушень вуглеводного обміну до 4,77 ± 0,80 у групі жінок із ГХ, МС та цукровим діабетом та з 0,73 ± 0,19 до 3,93 ± 1,20 у чоловічих групах відповідно. Отже, визначення лептинорезистентності може використовуватися для своєчасного виявлення хворих із високим серцево–судинним ризиком.
/57/57.jpg)
Висновки
1. Виявлено, що у хворих із ГХ та МС лептинорезистентність за визначенням вільного лептинового індексу асоціюється зі зростанням виявлення факторів серцево–судинного ризику. Установлено корелятивний зв’язок між вільним лептиновим індексом та факторами серцево–судинного ризику, такими як ОТ, ІМТ, холестерин, тригліцериди, ХС ЛПВЩ, та глюкозою та рівнем артеріального тиску в жіночих та чоловічих групах.
2. Визначено, що обрахування серцево–судинного ризику у хворих із ГХ та МС за стандартною шкалою SCORE не дозволяє максимально виділити когорту хворих із високим серцево–судинним ризиком, оскільки не враховує вплив на його рівень надлишкової маси тіла та порушень вуглеводного обміну. Додаткове використання шкал SСOREBMI, PROCAM, FRAMINGHAM, DRS дозволяє оптимізувати виявлення хворих із високим та дуже високим кардіометаболічним ризиком.
3. Установлено, що в пацієнтів із ГХ, МС і цукровим діабетом високий ризик ускладнень за шкалою IRIS II асоціювався з найбільшими проявами лептинорезистентності за визначенням вільного лептинового індексу, що становив 5,45 ± 1,09 у групі жінок та 4,5 ± 1,6 у групі чоловіків, що дозволяє використовувати вільний лептиновий індекс для оптимізації раннього виявлення ускладнень у хворих із цукровим діабетом.
1. Гідзинська І.М., Мороз Г.З., Ласиця Т.С., Безугла М.В. Метаболічний синдром та серцево-судинний ризик: сучасний погляд на проблему // Артериальная гипертензия. — 2012. — 2(22). — С. 21-27.
2. Коваленко В.М., Корнацький В.М. та співавт. Регіональні медико-соціальні проблеми хвороб системи кровообігу. Динаміка та аналіз. Аналітично-статистичний посібник. — К., 2013 р. — 239 с.
3. Коваленко В.М. Калькулятор кардіоваскулярного ризику // Здоров’я України. — 2010. — № 3 (тематичний номер). — С. 6.
4. Митченко Е.И., Мамедов М.Н., Колесник Т.В. и др. Современный профиль факторов риска сердечно-сосудистых заболеваний в городской популяции Украины // Український кардіологічний журнал. — 2013. — Додаток 4. Матеріали XIV Національного конгресу кардіологів України. — С. 76-83.
5. Питецька Н.І., Ковальова О.М. Фактори ризику серцево-судинних захворювань: гендерні особливості // Медицина транс-порту України. — 2011. — № 4. — С. 83-89.
6. Светлаков А.В., Яманова М.В., Филиппов О.С., Малахова Н.А. Лептин и липидный спектр крови у женщин с разными типами ожирения // Проблемы репродукции. — 2001. — 6. — 33.
7. Фадеенко Г.Д. Ожирение и риск сердечно-сосудистых заболеваний // Ліки України. — 2009. — № 7(133). — С. 55-64.
8. AHA/ACC/TOS Guideline for the Management of Overweight and Obesity in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Obesity Society // Circulation. — 2013. — Vol. 11. — P. 45-90.
9. Friedman J.M. Leptin and the Regulation of Body Weight // Journal of Medical Sciences. — 2010. — Vol. 3, № 3.
10. Giuseppe M. et al. Guidelines for the management of arterial hype rtension // European Heart Journal. — 2007. — Vol. 28. — P. 1462-1536.
11. Gorska E., Popko K., Stelmaszczyk-Emmel A., Ciepiela O., Kucharska A., Wasik M. Leptin receptors // Eur. J. Med. Res. Nov. — 2010. — 4. — 15, Suppl 2. — 50-4.
12. Kershaw E.E., Flier J.S. Adipose tissue as an endocrine organ // J. Clin. Endocrinol. Metab. — 2004. — 89. — 2548-2556.
13. Mantzoros C.S. The role of leptin in human obesity and disease: A review of current evidence // Ann. Intern. Med. — 1999. — 130. — 671-80.
14. Mancia G., Fagard R., Narkiewicz K. et al. ESH/ESC Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // Journal of Hypertension. — 2013. — 31, Iss. 7. — 1281-1357.
15. Myers M.G., Cowley M.A., Munzberg H. Mechanisms of leptin action and leptin resistance // Ann. Rev. Physiol. — 2008. — 70. — 537-556.
16. Owecki M., Nikisch E., Miczke A., Pupek-Musialik D., Sowiński J. Leptin, soluble leptin receptors, free leptin index, and their relationship with insulin resistance and BMI: high normal BMI is the threshold for serum leptin increase in humans // Horm. Metab. Res. — 2010 Jul. — 42(8). — 585-9. — Epub 2010 M.
17. Reiner Z. et al. Guidelines for the management of dyslipidaemias // European Heart Journal. — 2011. — Vol. 32. — P. 1769-1818.
18. Ren J. Leptin and hyperleptinemia-from friend and foe for cardiovascular function // J. Endocrinol. — 2004. — 181. — 1-1.
19. Sun Q., van Dam R.M., Meigs J.B., Franco O.H., Mantzoros C.S. et al. Leptin and soluble leptin receptor levels in plasma and risk of type 2 diabetes in U.S. women: a prospective study // Diabetes. — 2010. — 59. — 611-618.

/54/54.jpg)
/55/55.jpg)
/56/56.jpg)