Статтю опубліковано на с. 54-56
Вступ
Гострий панкреатит — це гострий неінфекційний процес у підшлунковій залозі, що виникає в результаті ранньої активності травних ензимів, які виходять з ацинарних клітин, з різними варіантами пошкодження самої залози, парапанкреатичної ділянки та інших органів (Cruz-Santamaria D.M. et al., 2012).
Частота виникнення захворювання, за даними різних авторів, становить до 80–100 випадків на 100 000 населення, причому в більшості випадків хворіють люди працездатного віку.
Загальна летальність при гострому панкреатиті становить від 4 до 15 %, при некротичній формі — 24–60 %, а післяопераційна летальність досягає 70–75 %. Основною причиною високої летальності в післяопераційному періоді є сепсис, тому проблема вибору технології антибіотикотерапії в даної категорії хворих і надалі залишається дуже серйозною.
Матеріал та методи
Нами обстежені 52 хворі (20 жінок та 32 чоловіки), які надходили у Львівську обласну клінічну лікарню з діагнозом гострого панкреатиту з 2012 по 2014 рік. Причинами гострого панкреатиту у 28 пацієнтів були жовчнокам’яна хвороба й мікролітіаз, у 22 хворих — зловживання алкоголем, а у 2 пацієнтів було діагностовано ідіопатичний панкреатит.
Обстеження з метою верифікації діагнозу й тяжкості гострого панкреатиту та його лікування проводили згідно зі Стандартами діагностики й лікування гострого панкреатиту [2], Протоколами діагностики й лікування гострого панкреатиту [1–3] та Між–народним керівництвом з лікування тяжкого сепсису та септичного шоку (2012) [7].
Верифікацію бактеріальних ускладнень проводили за допомогою бактеріологічних досліджень та визначення рівня прокальцитоніну [5, 6]. У випадку інфекційних ускладнень проводили інтенсивну терапію, що передбачена протоколом для лікування пацієнтів із сепсисом/тяжким сепсисом та токсико-септичним шоком, але останнім часом екстрапольована й на інших критичних хворих (Surviving Sepsis Compaign (SSC) Guidelines, 2012).
Результати дослідження та їх обговорення
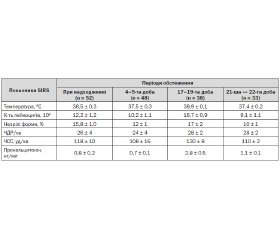
При надходженні в клініку стан тяжкості пацієнтів за шкалою APACHE II був оцінений у 21,13 ± 0,80 бала, тяжкість панкреатиту за шкалою Ranson — 5,5 ± 0,2 бала, а тяжкість поліорганної дисфункції за шкалою SOFA — 10,11 ± 1,10 бала.
У всіх хворих були ознаки загальної відповіді на запалення (SIRS): t = 38,3 ± 0,3 °C, L 12,2 ± 1,2 • 109 (незрілі форми — 15 %), частота дихальних рухів (ЧДР) 26 ± 4 за 1 хв, частота серцевих скорочень (ЧСС) 118 ± 10 уд за 1 хв.
У результаті проведеної інтенсивної терапії упродовж 4–5 діб вдалося досягнути зменшення активності SIRS: t = 37,5 ± 0,3 °C, L 10,2 ± 1,1 • 109 (незрілі форми — 12 %), ЧДР 24 ± 4 за 1 хв, ЧСС 108 ± 16 уд за 1 хв.
Ми з обережністю ставимося до призначення антибіотиків в асептичній фазі гострого панкреатиту, а тим більше до здатності антибіотика проникнути в підшлункову залозу/парапанкреатичну клітковину на фоні набряку цих тканин. Крім того, треба пам’ятати, що призначення цефалоспоринів та фторхінолонів, особливо без чітких показань, з так званою профілактичною метою, призводить до селекції мультирезистентних штамів мікроорганізмів (як грампозитивної, так і грамнегативної флори).
Проте на 17–19-ту добу лікування у 42 хворих клінічно діагностовано погіршення стану (прогресування загальної відповіді на запалення) - (табл. 1).
Лабораторно було виявлено зростання рівня прокальцитоніну (2,8 ± 0,5 нг/мл). З допомогою УЗД та КТ органів черевної порожнини діагностовано абсцес підшлункової залози та наявність вільної рідини в черевній порожнині. Хворим проведено санацію та дренування черевної порожнини лапароскопічним методом. У подальшому в 35 хворих виникла потреба в лапаротомії з метою санації та дренування черевної порожнини та позаочеревинного простору.
Під час операційного втручання проводився забір матеріалу з черевної порожнини на бактеріологічне дослідження. Паралельно проводився забір крові на бактеріологічне дослідження (дві проби: одна з інтактної вени, а друга з катетера, що знаходився в центральній вені). Посів крові проводили на виявлення аеробних патогенів, виявляти анаеробну флору та гриби не було технічної можливості.
Слід зазначити, що в усіх випадках при посіві крові з інтактної вени ми виділяли патоген у незначної кількості хворих, 103–104 КУО (табл. 2).
При посіві крові, взятої з центрального катетера, найчастіше висівали S.epidermidis (n = 24; 105–106 КОУ), причому всі вони були оксацилін-резистентні (methicillin resistant coagulase negative Staphylococcus — MRCNS). Як відомо, епідермальний стафілокок має меншу токсичність порівняно з S.аureus, оскільки є присутнім на шкірі людини, але добре колонізує на штучних матеріалах, що введені в організм людини (у тому числі судинних катетерах).
При посіві ексудату з черевної порожнини практично з однаковою частотою виділяли мікро–організми з родини ентеробактерій (E.сoli та K.pneumoniae) і неферментуючих грамнегативних паличок (Ps.aeruginosa). З огляду на тяжкість основної патології, тяжкість стану хворих, а також на те, що з кожним роком зростає частота появи патогенів родини ентеробактерій з розширеним спектром бета-лактамаз (Extended spectrum β-lactamases — ESBL), хворим як стартову емпіричну антибіотико–терапію було призначено меропенем (Мерограм, виробництво «Ауробіндо Фарма Лімітед»).
Незважаючи на те, що карбапенеми застосовуються в клінічній практиці з 1985 року, чутливість мікроорганізмів до них залишається дуже високою (96–98 % усіх ізолятів) [4]. Чому з карбапенемів було обрано Мерограм (меропенем)? Мерограм (меропенем) є одним з найефективніших антибіотиків щодо Р.aeruginosaе, найбільш агресивного та стійкого збудника інфекцій у відділенні анестезіології, реанімації та інтенсивної терапії. Згідно з даними літератури, 43,3 % іміпенем-резистентних штамів Ps.aeroginosae зберігають чутливість до меропенему [4]. Крім того, він легко проникає через стінку грамнегативних бактерій, стійкий до бета-лактамаз і практично не має перехресної резистентності з іншими антибактеріальними препаратами (АБП). Для Мерограму (меропенему) характерні низький рівень набутої резистентності, висока активність у біоплівках, що стають захистом мікроорганізмів від дії на них АБП, та виражений постантибіотичний ефект. Препарат активний як до аеробних, так і до анаеробних мікроорганізмів.
Мерограм (меропенем) до цього часу залишається високоефективним антибактеріальним препаратом при інфекціях органів грудної та черевної порожнини, середостіння, малого таза, деструктивного панкреатиту.
Мерограм (меропенем) вводили протягом 30–45 хв у дозі 1000 мг тричі на добу. Тривалість лікування становила не менше 7–10 діб.
Ефективність антибіотикотерапії оцінювали через 48 год. У всіх випадках ми отримали регрес ознак загальної відповіді на запалення, що було підставою продовжувати антибіотикотерапію у вищевказаному режимі (табл. 1).
У подальшому дані бактеріологічних досліджень підтвердили правильність вибору тактики емпіричної антибіотикотерапії.
З 52 хворих на тяжкий панкреатит померло 20 пацієнтів (летальність 38,4 %). Безпосередньою причиною смерті у 14 хворих було прогресування поліорганної дисфункції (переважно дихальна недостатність у вигляді респіраторного дистрес-синдрому, що був рефрактерний до респіраторної терапії), а в 6 хворих безпосередньою причиною смерті були ерозивні кровотечі.
Висновки
У хворих з тяжким панкреатитом на 17–19-ту добу захворювання можна очікувати погіршення їх загального стану, причиною якого є приєднання інфекції та розвиток сепсису.
Антибіотиком вибору в такій ситуації слід вважати Мерограм (меропенем), який слід вводити протягом 30–45 хв у дозі 1000 мг тричі на добу.
Список литературы
1. Багненко С.Ф. Протоколы диагностики и лечения острого панкреатита: Пособие для врачей / Багненко С.Ф, Толстой А.Д., Краснорогов В.Б., Курыгин А.А. и др. — К., 2007. — 12 с.
2. Коновалов С.П. Стандарти діагностики і лікування гострого панкреатиту: Метод. рекомендації / Коновалов С.П., Терлецький В.П., Рощін Г.Г., Пляцок А.О. та ін. — К., 2005. — 27 с.
3. Мальцева Л.О. Острые панкреатиты / Мальцева Л.О., Кутовий О.Б., Кобеляцький Ю.Ю. — Дніпропетровськ: Лізунов Прес, 2014. — 192 с.
4. Рыбицкий З. Антибиотикотерапия в проблематике госпитальных инфекций. — Люблин: Makmed, 2014. — 350 с.
5. Толстой А.Д. Шок при остром панкреатите: Пособие для врачей / Толстой А.Д., Павлов В.П., Захарова Е.В., Бекбауов С.А. — К., 2007. — 76 с.
6. Cruz-Santamaria D.M., Taxonera C., Giner M. Update on pathogenesis and clinical management of acute pancreatitis // World J. Gastrointest. Pathophisiol. — 2012. — № 3 (3). — P. 60-70
7. Surviving Sepsis Campaign: international Guidelines for Management of Severe Sepsis and Septic Shock: 2012 (SSC-Guidelines: 2012) // Intensive Care Med. — 2013. — Vol. 38. — № 1. — Р. 296-327.

/55.jpg)
/55_2.jpg)