Статья опубликована на с. 59-62
По данным литературы и нашим наблюдениям, заболеваемость острым панкреатитом неуклонно растет, по частоте он занимает 3-е место после острого аппендицита и холецистита. Лечение острого панкреатита, особенно его деструктивных форм, по-прежнему является сложной проблемой хирургии из-за высокой летальности — от 25 до 80 % [1–3].
Печень оказывается первым органом-мишенью, на который приходится основной удар панкреатогенной токсемии в виде массивного поступления в оттекающую по воротной вене кровь активированных панкреатических и лизосомальных ферментов, биологически активных веществ, токсичных продуктов распада паренхимы поджелудочной железы при некробиозе и активации калликреин-кининовой системы.
В результате действия повреждающих факторов в паренхиме печени развиваются глубокие микроциркуляторные расстройства, в гепатоцитах происходят активация митохондриальных факторов гибели клетки и индукция апоптоза печеночных клеток. Декомпенсация внутренних механизмов детоксикации усугубляет течение острого панкреатита вследствие накопления в организме множества токсичных веществ и метаболитов, концентрирующихся в крови и создающих вторичный гепатотропный эффект.
Печеночная недостаточность — одно из грозных осложнений острого панкреатита. Часто она предопределяет течение заболевания и его исход. Из литературы известно, что у 20,6 % больных при отечном панкреатите и у 78,7 % при деструктивном процессе в поджелудочной железе происходит нарушение различных функций печени, что в значительной степени ухудшает результаты лечения и в 72 % наблюдений является непосредственной причиной смерти [4].
Ввиду этого очевидна необходимость адекватной профилактики и лечения печеночной недостаточности у каждого больного острым панкреатитом с использованием всего комплекса консервативных мер. Сегодня одним из приоритетных направлений комплексной терапии печеночной недостаточности при остром панкреатите является включение в лечение гепатопротекторов, в частности L-орнитин-L-аспартата (Гепа-Мерц).
Препарат несколько лет существует на фармацевтическом рынке, он хорошо зарекомендовал себя и успешно применяется в терапевтической, неврологической, токсикологической практике при острых и хронических заболеваниях печени [5–9]. Препарат стимулирует дезинтоксикационную функцию печени, регулирует метаболизм в гепато–цитах, оказывает выраженное антиоксидантное действие [10, 11].
В период с ноября 2009 г. по март 2010 г. проведено мультицентровое нерандомизированное клиническое исследование по изучению эффективности гепатопротектора L-орнитин-L-аспартата (Гепа-Мерц) в комплексном лечении больных острым панкреатитом. В исследование были включены 232 пациента (150 (64,7 %) мужчин и 82 (35,3 %) женщины) с острым панкреатитом, подтвержденным клинико-лабораторными и инструментальными методами. Возраст пациентов варьировал от 17 до 86 лет, в среднем — 46,7 (34; 58) года. У 156 (67,2 %) пациентов диагностирована отечная форма панкреатита, у 76 (32,8 %) — деструктивные формы: у 21 (9,1 %) — геморрагический панкреонекроз, у 13 (5,6 %) — жировой, у 41 (17,7 %) — смешанный, у 1 (0,4 %) — посттравматический.
Все больные получали базисную комплексную консервативную терапию (блокада экзокринной функции поджелудочной железы, инфузионно-дезинтоксикационные, антибактериальные средства).
L-орнитин-L-аспартат (Гепа-Мерц) в комплексе лечебных мероприятий применяли у 182 (78,4 %) больных (основная группа); 50 (21,6 %) пациентов составили контрольную группу, в которой данный препарат не использовали. Препарат назначали с 1-го дня включения больного в исследование по разработанной схеме: 10 г (2 ампулы) внутривенно капельно со скоростью введения не более 5 г/ч на 400 мл физиологического раствора натрия хлорида в течение 5 сут., с 6-х суток — перорально (препарат в виде гранулята по 1 пакету, 3 г, 3 раза в день в течение 10 дней).
Степень тяжести состояния пациентов оценивали по шкале тяжести физиологического состояния SAPS II. В зависимости от суммарного балла по SAPS II в обеих группах было выделено по 2 подгруппы больных: с суммарным баллом < 30 и > 30.
Подгруппу с тяжестью состояния по SAPS II < 30 баллов составили 112 (48,3 %) пациентов, в том числе 97 (87 %) — из основной группы: мужчин — 74 (76,3 %), женщин — 23 (23,7 %), средний возраст — 40,9 (33; 45) года, тяжесть состояния — 20,4 ± 5,2 балла; из контрольной группы было 15 (13 %) пациентов: мужчин — 11 (73,3 %), женщин — 4 (26,7 %), средний возраст — 43,3 (28,5; 53) года, тяжесть состояния — 25 ± 6 баллов.
Подгруппу с суммарным баллом по SAPS II > 30 составили 120 (51,7 %) пациентов, в том числе 85 (71 %) — из основной группы: мужчин — 56 (65,9 %), женщин — 29 (34,1 %), средний возраст — 58,2 (45; 66,7) года, тяжесть состояния — 36,3 ± 5,6 балла; из контрольной группы было 35 (29 %) пациентов: мужчин — 17 (48,5 %), женщин — 18 (51,4 %), средний возраст — 55,4 (51; 63,5) года, тяжесть состояния — 39,3 ± 5,9 балла.
В исследовании было выделено 4 базовые точки: 1-е, 3-и, 5-е и 15-е сутки. Для оценки эффективности лечения определяли в динамике тяжесть состояния больных по интегральной шкале SOFA; исследовали лабораторные показатели: концентрацию билирубина, уровень белка, мочевины и креатинина, ферментов цитолиза — аланинаминотрансферазы (AЛT), аспартатаминотрансферазы (ACT). Степень нарушения когнитивных функций и скорость их восстановления в ходе лечения оценивали в тесте связи чисел (ТСЧ).
Математическая обработка фактического материала проводилась с использованием базовых методов биомедицинской статистики с применением пакета прикладных программ Microsoft Office Excel 2003 и BIOSTAT. При описании групповых характеристик рассчитывали среднеквадратичное отклонение среднего значения признака при его параметрическом распределении и интерквартильный интервал — при непараметрическом. Достоверность различий между 2 параметрами оценивали с помощью критериев Mann — Withney и χ2. Различия считали статистически значимыми при р = 0,05.
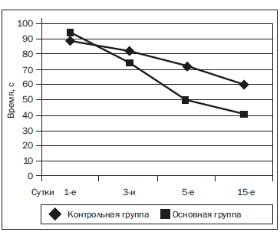
У больных основной группы со степенью тяжести состояния по SAPS II < 30 баллов применение L-орнитин-L-аспартата (Гепа-Мерц) в комплексе лечения привело к более быстрому восстановлению нервно-психической сферы, что оценивалось в ТСЧ. При поступлении у пациентов обеих групп длительность счета была выше нормы (норма — не более 40 с) на 57,4 % в основной группе и на 55,1 % — в контрольной: соответственно 94 с (80; 98) и 89,5 с (58,5; 116). На фоне терапии отмечалась положительная динамика в обеих группах. На 3-и сутки длительность счета составила 74 с (68; 78) в основной группе и 82,3 с (52,5; 100,5) — в группе сравнения, что превышало норму на 45,9 и 51,2 % соответственно (р = 0,457, Mann — Withney). На 5-е сутки время в ТСТ составило 50 с (48; 54) в основной группе и 72,9 с (44; 92) — в контрольной, что превышало норму на 20 и 45,2 % соответственно (р = 0,256, Mann — Withney). Статистически достоверные изменения отмечены на 15-е сутки исследования: в основной группе — 41 с (35; 49), что превышало нормальное значение на 2,4 %, а в контрольной — 61 с (41; 76) (больше нормы на 34,4 %; р = 0,038, Mann — Withney) (рис. 1).
/60.jpg)
У пациентов с тяжестью состояния по SAPS II > 30 баллов в ходе исследования выявлено позитивное влияние L-орнитин-L-аспартата (Гепа-Мерц) на динамику биохимических показателей сыворотки крови, при этом наиболее значимые изменения касались показателей цитолитического синдрома (AЛT, ACT) и скорости восстановления нервно-психических функций.
При динамическом наблюдении за тяжестью состояния больных, оцениваемой по шкале SOFA, также отмечена более быстрая нормализация в основ–ной группе (рис. 2). Тяжесть состояния больных основной и контрольной групп в 1-е сутки исследования по шкале SOFA составила 4 (3; 6,7) и 4,2 (2; 7) балла соответственно, на 3-и сутки исследования — соответственно 2 (1; 3,7) и 2,9 (1; 4) балла (р = 0,456, Mann — Withney), на 5-е сутки — соответственно 1 (0; 2) и 1,4 (0; 2) балла (р = 0,179, Mann — Withney), на 15-е сутки — в основной группе в среднем 0 (0; 1) баллов, у 13 (11 %) пациентов — 1 балл; в контрольной группе признаки органной дисфункции наблюдались у 12 (34 %) пациентов, среднее значение по SOFA в данной группе составило 0,9 (0; 2) балла (р = 0,028, Mann — Withney).
Применение L-орнитин-L-аспартата (Гепа-Мерц) в нашем исследовании сопровождалось более выраженным уменьшением показателей цитолиза, чем в контроле (рис. 3, 4).
В 1-е сутки уровни AЛT и ACT превышали верхнюю границу нормы у всех больных. Среднее содержание AЛT в основной группе составило 137 Ед/л (27,5; 173,5), в контрольной — 134,2 Ед/л (27,5; 173,5), ACT — соответственно 120,5 Ед/л (22,8; 99) и 97,9 Ед/л (22,8; 99). На 3-и сутки содержание AЛT составило соответственно 83 Ед/л (25; 153,5) и 126,6 Ед/л (25; 153,5) (р = 0,021, Mann — Withney), ACT — 81,5 Ед/л (37; 127) и 104,4 Ед/л (37; 127) (р = 0,014, Mann — Withney). На 5-е сутки среднее содержание AЛT в основной и контрольной группах составило соответственно 62 Ед/л (22,5; 103) и 79,7 Ед/л (22,5; 103) (р = 0,079, Mann — Withney), a ACT — 58 Ед/л (38,8; 80,3) и 71,6 Ед/л (38,8; 80,3) (р = 0,068, Mann — Withney). Концентрация AЛT и ACT у больных, получавших L-орнитин-L-аспартат (Гепа-Мерц), на 15-е сутки достигла нормальных значений. Уровень AЛT в основной группе составил 38 Ед/л (22,5; 49), в группе сравнения — 62 Ед/л (22,5; 49) (р = 0,007, Mann — Withney), уровень ACT — соответственно 31,5 Ед/л (25; 54) и 54,2 Ед/л (25; 70) (р = 0,004, Mann — Withney).
Изучение внимания с помощью ТСЧ у пациентов с тяжестью состояния по SAPS II > 30 баллов также выявило лучшие результаты в основной группе (рис. 5).
Скорость счета к 3-м суткам была у них выше, чем в группе сравнения, на 18,8 %: затрачивалось 89 с (69,3; 105) и 109,6 с (90; 137) соответственно (р = 0,163, Mann — Withney); к 5-м суткам разница достигала 34,7 %: 59 с (52; 80) и 90,3 с (66,5; 118) соответственно (р = 0,054, Mann — Withney). На 15-е сутки в основной группе на счет уходило в среднем 49 с (41,5; 57), что было на 47,1 % больше аналогичного показателя в контрольной группе — 92,6 с (60; 120); р = 0,002, Mann — Withney.
К непосредственным результатам лечения следует также отнести снижение сроков госпитализации в среднем на 18,5 % у больных основной группы (р = 0,049, Mann — Withney).
В контрольной группе наблюдалось 2 (6 %) летальных исхода от нарастающей полиорганной недостаточности (р = 0,15; χ2), в основной группе летальных исходов не было.
Наблюдение показало, что в подавляющем большинстве случаев L-орнитин-L-аспартат (Гепа-Мерц) хорошо переносился больными. У 7 (3,8 %) пациентов отмечены побочные явления, у 2 (1,1 %) препарат был отменен в связи с развитием аллергической реакции, у 5 (2,7 %) отмечались диспептические явления в виде тошноты, рвоты, которые купировались при снижении скорости введения препарата.
Своевременное применение L-орнитин-L-аспартата (Гепа-Мерц) в комплексе лечебных мероприятий при остром панкреатите патогенетически оправданно и позволяет заметно снизить степень выраженности эндогенной интоксикации. L-орнитин-L-аспартат (Гепа-Мерц) хорошо переносится больными.
Список литературы
1. Буеверов А.О. Печеночная энцефалопатия как основное проявление недостаточности функции печени // Материалы сателлитного симпозиума компании Мерц «Заболевания печени и печеночная энцефало–патия», 18 апреля 2004 г., Москва. —
С. 8.
2. Иванов Ю.В. Современные аспекты возникновения функциональной недостаточности печени при остром панкреатите // Математическая морфология: электронный математический и медико-биологический журнал. — 1999. — 3(2). — 185-195.
3. Ивашкин В.Т., Надинская М.Ю., Буеверов А.О. Печеночная энцефалопатия и методы ее метаболической коррекции // Библиотека РМЖ. — 2001. — 3(1). — 25-27.
4. Лаптев В.В., Нестеренко Ю.А., Михайлусов С.В. Диагностика и лечение деструктивного панкреатита. — М.: Бином, 2004. — 304 с.
5. Надинская М.Ю., Подымова С.Д. Лечение печеночной энцефалопатии препаратом Гепа-Мерц // Материалы сателлитного симпозиума компании Мерц «Заболевания печени и печеночная энцефалопатия», 18 апреля 2004 г., Москва. — С. 12.
6. Остапенко Ю.Н., Евдокимов Е.А., Бойко А.Н. Опыт проведения мультицентрового исследования в ЛПУ г. Москвы по изучению эффективности использования Гепа-Мерц при эндотоксикозах различной этиологии // Материалы второй научно-практической конференции, июнь 2004 г., Москва. — С. 31-32.
7. Попов Т.В., Глушко А.В., Яковлева И.И. и др. Опыт использования препарата Селеназа в комплексе интенсивной терапии больных с деструктивным панкреатитом // Consilium Medicum. Инфекции в хирургии. — 2008. — 6(1). — 54-56.
8. Савельев B.C., Филимонов М.И., Гельфанд Б.Р. и др. Острый панкреатит как проблема ургентной хирургии и интенсивной терапии // Consilium Medicum. — 2000. — 2(9). — 367-373.
9. Спиридонова Э.А., Ульянова Я.С., Соколов Ю.В. Использование препаратов Гепа-Мерц в комплексной терапии фульминантных вирусных гепатитов // Материалы сателлитного симпозиума компании Мерц «Заболевания печени и печеночная энцефалопатия», 18 апреля 2004 г., Москва. — С. 19.
10. Kircheis G. Therapeutic efficacy of L-ornithine-L-aspartate infusions in patients with cirrosis and hepatic encephalopathy: results of placebo-controlled, double-blind study // Hepatology. — 1997. — Р. 1351-1360.
11. Nekam K. et al. Effect of in vivo treatment with ornitin-aspartate hepamerz on the activity and expression of superoxidedismutase SOD in patients with cirrhosis of the liver // Hepatology. — 1991. — 11. — Р. 75-81.
Впервые опубликовано в журнале «Вестник хирургической гастроэнтерологии», 2011, № 2
/60.jpg)

/61.jpg)