Статтю опубліковано на с. 92-96
Інсульт — одне з поширених захворювань у світі. У країнах Європейського Союзу щороку реєструється більше ніж 1 млн випадків захворювання на інсульт [4]. В Україні інсульт та інші цереброваскулярні захворювання (ЦВЗ), згідно з офіційною статистикою, займають 2-ге місце серед причин смертності. Щороку діагностується 100–110 тис. інсультів (понад третина з них у людей працездатного віку), 30–40 % хворих на інсульт помирають упродовж перших 30 днів і до 50 % — впродовж одного року від початку захворювання, 20–40 % хворих, що вижили, стають залежними від сторонньої допомоги (12,5 % первинної інвалідності), і лише близько 10 % повертаються до повноцінного життя [6].
З іншого боку, у численних дослідженнях встановлено, що однією з основних причин і важливим фактором ризику виникнення різних форм ЦВЗ є цукровий діабет (ЦД) [14]. Результати проведених широких досліджень свідчать про те, що ЦД підвищує ризик розвитку ішемічного інсульту в 1,8–6 раз, а наявність і вираженість діабетичної ангіопатії значною мірою визначають прогноз захворювання [2]. У хворих на ЦД значно переважають ішемічні інсульти (95,75 % від усіх інсультів), тоді як у хворих без ЦД це число дорівнює 77,7 % [3].
Слід зазначити, що останніми роками змінилися погляди на стратегію та тактику ведення хворих із гострими порушеннями мозкового кровообігу. Це обумовлене появою нових даних про патофізіологію гострого періоду мозкового інсульту. Наслідком розвитку наукових досліджень у галузі інсультології стала можливість для реалізації концепції «час — мозок», яка сформувала нове ставлення до інсульту з визнан–ням його невідкладним станом, лікування якого вимагає екстреної госпіталізації, а надання медичної допомоги здійснюється в перші хвилини, години з моменту його розвитку в спеціалізованих інсультних відділеннях [6].
У той же час у літературі переважно висвітлюються дані про фактори ризику та патогенез інсульту у хворих на ЦД [3], але недостатньо даних про особливості перебігу й інтенсивну терапію в цієї категорії хворих.
Патофізіологічні аспекти
У хворих на цукровий діабет інсультіндукована стресова реакція на фоні інсулінової недостатності призводить до суттєвого збільшення в крові концентрації глюкагону (антагоніста інсуліну). Унаслідок цього різко посилюються процеси, які стимулюються глюкагоном — глікогеноліз та ліполіз. У результаті збільшується продукція глюкози. У той же час утилізація глюкози печінкою, м’язами та жировою тканиною за відсутності інсуліну різко знижується. Унаслідок цих процесів виникає виражена гіперглікемія.
Посилення розпаду ліпідів (ліполіз) призводить до різкого підвищення концентрації вільних жирних кислот у крові, які починають включатися в кетогенез. За інсулінової недостатності організм лише на 15 % може покривати свої енергетичні потреби шляхом окислення глюкози, оскільки нестача інсуліну блокує поглинання та оксидацію глюкози м’язовою та жировою тканинами [9]. У цьому випадку 80 % енергії організм отримує шляхом окислення жирних кислот, що призводить до накопичення побічних продуктів їх розпаду — кетонових тіл (ацетону, ацетооцтової та β-оксимасляної кислот). Порушується кислотно-лужна рівновага, і виникає тяжкий метаболічний ацидоз — діабетичний кетоацидоз (ДКА).
Коли рівень глікемії перевищує нирковий поріг (8–9 ммоль/л), глюкоза починає виділятися з сечею і за законами осмосу виводить з організму велику кількість рідини (поліурія). Осмотичний діурез приводить до небезпечної для життя дегідратації. Втрата води може становити близько 10–15 % маси тіла або 20–25 % загальної кількості води в організмі. Паралельно відбуваються втрати електролітів, насамперед загального калію (до 500 ммоль).
Отже, ДКА у хворих на інсульт слід розглядати як взаємопоєднаний розвиток гіперглікемії, гіперкетонемії, метаболічного ацидозу, дегідратації, дисбалансу електролітів та порушень ментального статусу [9].
З іншого боку, численні літературні дані свідчать про те, що не тільки дія гормонів стресу під час інсульту може викликати або поглиблювати ДКА. Правильне й протилежне — діабетичний кетоацидоз являє собою фактор ризику розвитку інсульту [11]. Системне запалення, судинні розлади, збільшення коагулопатії та ризик кровотеч, як правило, присутні при кетоацидозі. Гіперглікемія й ацидоз можуть сприяти розвитку оксидативного стресу й призвести до ішемії тканин [18]. Ризик тромбозу за кетоацидозу підвищується через розлади згортання, активацію тромбоцитів, зменшення загального об’єму й швидкості кровотоку [15]. Під час початкової стадії лікування ДКА, коли відновлюється перфузія головного мозку, можуть виникати реперфузійні ушкодження [10]. Крім того, у хворих на ДКА були зафіксовані порушення згортання крові та патологічні сироваткові рівні протеїну С, протеїну S, гомоцистеїну і фактора фон Віллебранда [13]. У пацієнтів із ДКА часто реєструються також ендотеліальна дисфункція, порушення активації тромбоцитів, відносний гіпофібриноліз і активація системи згортання. Усі ці механізми погіршують мозковий кровообіг, особливо в пацієнтів старших вікових груп, та визначають особливості клінічної картини ДКА у хворих на інсульт.
Клінічні особливості
Слід зазначити, що згідно з Ф. Плам, Д.Б. Познер (1986), декомпенсація ЦД може мати такі клінічні форми: 1) діабетичний кетоацидоз; 2) гіперосмолярна кома; 3) гіпоглікемія; 4) лактат-ацидоз; 5) набряк мозку й лікворний ацидоз (енцефалопатична форма ДКА).
Енцефалопатична форма частіше спостерігається в осіб похилого віку. Клініка нагадує інсульт, який і сам по собі може обумовлювати виникнення діабетичної коми. Енцефалопатична форма гіперкетонемічної коми частіше за все є завершальним акордом діабетичної коми. Вона відрізняється глибокими порушеннями функції головного мозку, у тому числі довгастого: зіниці звужені, кореальні рефлекси відсутні, дихання Куссмауля переходить у поверхове, артеріальний тиск (АТ) прогресивно знижується. Результат цієї форми ДКА зазвичай летальний [1].
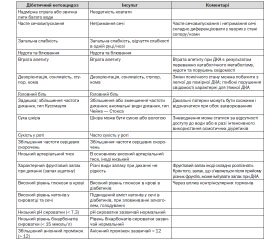
Ураховуючи викладене, можемо констатувати, що існує значний збіг симптомів, ознак і результатів лабораторних досліджень при інсульті та ДКА (табл. 1).
Така подібність симптомів двох станів під час клінічного обстеження може дезорієнтувати лікаря, а правильна інтерпретація симптоматики часто ускладнюється, особливо в пацієнтів похилого віку та з порушеннями когнітивних функцій. Наявність енцефалопатичної форми декомпенсації вуглеводного обміну вимагає від лікаря проведення ретельного діагностичного пошуку та диференціальної діагностики порушень мозкового кровообігу у хворих на ЦД.
Діагностика
При надходженні в усіх пацієнтів із цукровим діабетом, які страждають від інсульту (у тому числі у хворих із раніше встановленим діабетом), для своєчасної діагностики вираженого (наприклад, рН < 7,25; бікарбонат < 15 ммоль/л) або м’якого/компенсованого діабетичного кетоацидозу (рН 7,25–7,35; бікарбонат 15–22 ммоль/л) повинні бути визначені рівні рН, бікарбонату й газів крові. Наявність у хворого депресії дихання може ще більше ускладнити диференціальну діагностику між респіраторними й метаболічними причинами ацидозу. У таких випадках може бути корисним вимірювання рівня аніонного проміжку.
Унаслідок інсультіндукованого стресу рівень глюкози підвищений у більшості пацієнтів із цукровим діабетом. Крім того, слід зауважити, що рівні рН, бікарбонату й аніонного проміжку в діабетичних пацієнтів з інсультом рутинно не визначаються. Тому значне число випадків кетоацидозу у хворих із гострим інсультом може залишатися непоміченим.
Інтенсивна терапія
Терапія порушень вуглеводного обміну у хворих з інсультом повинна бути патогенетично обґрунтованою й адекватною. Основні напрямки лікувальної тактики включають:
— регідратацію (інфузійну терапію);
— інсулінотерапію;
— парціальну корекцію метаболічного ацидозу тяжкого ступеня;
— введення антикетогенних засобів;
— компенсацію втрат калію;
— контроль неврологічного статусу.
Важливим моментом лікування є забезпечення постійного спостереження й контролю за станом хворого (великого значення набуває достатня компетентність персоналу). Хворі з ознаками ДКА тяжкого ступеня потребують госпіталізації у відділення інтенсивної терапії.
Регідратація (інфузійна терапія). При вирішенні питання про спосіб доступу до судинного русла слід пам’ятати, що мінімально інвазивні процедури (катетеризація периферичної вени) мають переваги перед установленням центрального венозного катетера, оскільки введення самого катетера в центральну вену може бути фактором ризику тромбоемболії судин головного мозку [17]. У той же час є рекомендації у непритомних пацієнтів з інсультом встановлювати центральний венозний катетер, що дозволяє проводити моніторинг центрального венозного тиску, який бажано підтримувати на рівні 8–10 мм вод.ст. [8].
У хворих з артеріальною гіпотензією проведення інтенсивної інфузії для стабілізації гемодинаміки є головною метою перших годин терапії.
Лікування починають із уведення кристалоїдних розчинів (наприклад, ізотонічного розчину натрію хлориду). Для запобігання розвитку ускладнень інфузійну терапію сольовими розчинами слід доповнювати введенням колоїдних та багатокомпонентних розчинів, які здатні утримуватись в судинному руслі та підтримувати онкотичний тиск і рН крові [9]. Об’єм і темп уведення розчинів у пацієнтів з ДКА наведено в табл. 2.
/95.jpg)
Якщо інфузійна терапія хворих із кетоацидозом добре розроблена та обґрунтована, то настанови з проведення інфузійної підтримки у хворих на інсульт не містять чітких і однозначних рекомендацій. Зокрема, національний «Уніфікований клінічний протокол медичної допомоги. Ішемічний інсульт» визначає такі обов’язкові дії лікаря: «Необхідно підтримувати нормоволемію. Введення рідини не менше добової потреби» та «Якщо при госпіталізації у пацієнта є ознаки гіповолемії (низький АТ, підвищений гематокрит, сухість слизових оболонок) і немає протипоказань (некомпенсована серцева недостатність), інфузійна терапія може бути призначена в об’ємі 1000–1500 мл 0,9% розчину хлориду натрію або розчину Рінгера» (курсив наш. — О.Г.) [8]. Тут необхідно зазначити два нюанси. По-перше, уже в наведених двох рекомендаціях є протиріччя. Добова потреба пацієнта (наприклад, для чоловіка вагою у 70 кг) становить 2160 мл, а не 1000–1500 мл. По-друге, введення великих об’ємів розчину Рінгера та 0,9% розчину натрію хлориду призводить до гіперхлоремії та гіперхлоремічного ацидозу. Тому будувати програму інфузійної терапії хворих на інсульт тільки на призначенні двох зазначених препаратів нераціонально й небезпечно.
Ще більш складною є проблема вибору оптимальної програми інфузійної терапії у хворих на ДКА з інсультом.
Паралельне й інтенсивне використання осмотичних розчинів (наприклад, манітолу) та петльових діуретиків (фуросеміду, торасеміду й буметаніду) може збільшити існуючий рівень зневоднення й поглибити тяжкість ДКА. Одночасне застосування регідратації та осмотичних діуретиків має місце на практиці, але чіткі терапевтичні принципи та алгоритми такого лікування відсутні. Не відомі також оптимальна швидкість регідратації, відповідні дози осмотичних та інших діуретиків, залишаються дискусійними й способи моніторингу обсягу навантаження, включаючи вимірювання центрального венозного тиску.
Отже, інфузійна терапія хворих на інсульт із супутнім цукровим діабетом та ДКА повинна проводитися ретельно й малими порціями, з постійним контролем артеріального тиску, гематокриту, рівня електролітів та показників кислотно-лужного стану. У програмі інфузійної терапії слід використовувати розчини кристалоїдів та сучасні штучні колоїди — похідні ГЕК та желатину.
Оскільки рідинна ресусцитуція повинна бути обмеженою, слід очікувати, що діабетичний кетоацидоз може мати тривалий клінічний перебіг, що становить значний ризик розвитку нових інсультів та ускладнень [16].
Інсулінотерапія. Цей метод вважається стрижнем у лікуванні декомпенсації ЦД. Важливий він і для хворих із гострим інсультом. Слід пам’ятати, що підвищення рівня глюкози в крові здатне викликати розвиток вторинних ушкоджень головного мозку (унаслідок активації анаеробного гліколізу й накопичення лактату, що призводить до ацидозу тканин).
Інсулінотерапію розпочинають одразу ж після встановлення факту наявності у хворого гіперглікемії [4]. Використовується інсулін короткої дії в режимі малих доз [9]. Сама інсулінотерапія в лікуванні діабетичного кетоацидозу не матиме великого ефекту, якщо вона не супроводжується адекватною та інтенсивною регідратацією. У багатьох хворих на додаток до обмежень у швидкості регідратації існуюча дегідратація може посилюватися використанням терапевтичних агентів для лікування інсульту, що може додатково ускладнити стан пацієнта.
Корекція метаболічного ацидозу. При корекції ацидозу слід пам’ятати, що ДКА розвивається через посилене надходження кетонових тіл унаслідок інсулінової недостатності. Тому етіологічним лікуванням даного виду ацидозу є замісна інсулінотерапія, яка в більшості випадків допомагає його усунути [7]. Корекція ацидозу бікарбонатом натрію, яка широко використовувалась раніше, пов’язана з високим ризиком ускладнень. Тому сьогодні введення бікарбонату не рекомендується, за винятком випадків небезпечного для життя кетоацидозу [16].
Компенсація втрат калію є важливим компонентом у лікуванні діабетичного кетоацидозу. Вихідний рівень калію в сироватці хворих часто перевищує норму. Однак у процесі лікування (через 3–5 годин) швидко виникає гіпокаліємія внаслідок інтенсивного надходження/повернення калію у внутрішньоклітинний сектор. Саме в цей час гіпокаліємія стає реальною загрозою ускладнень (появи аритмій). Тому бажано починати компенсацію втрат калію ще при нормокаліємії, можливо, через 2 години лікування. Виняток: терапію препаратами калію не починають при олігурії (діурез менший за 30 мл/год) і при концентрації калію в сироватці понад 5 ммоль/л [9].
Орієнтовне дозування калію хлориду залежить від рівня каліємії. Якщо рівень калію в сироватці < 3,5 ммоль/л, то на кожний літр ізотонічного розчину натрію хлориду додають по 40 ммоль калію хлориду. При рівні каліємії 3,5–4 ммоль/л — по 30 ммоль/л, а при 4–5 ммоль/л — по 20 ммоль/л калію хлориду.
У сучасних рекомендаціях указано, що для корекції дефіциту калію доцільно використовувати комбінацію хлориду й фосфату калію під постійним лабораторним контролем [5]. При цьому зазначається, що й у хворих на ДКА, і у хворих із гострим порушенням мозкового кровообігу швидко розвивається дефіцит фосфатів. Тому рекомендовано для поповнення цього дефіциту вводити по 30 ммоль фосфату кожні 12 год.
Каліємію слід підтримувати на рівні 4–5 ммоль/л. Обов’язково проводять ЕКГ-моніторинг, однак це не заміняє визначення рівня каліємії (кожні 2–4 години).
Контроль неврологічного статусу. Оцінка ефективності терапії хворих з інсультом та ДКА повинна включати регулярний контроль неврологічного статусу. Вважається, що корекція гіперглікемії та кетозу веде до покращання в неврологічному статусі. Якщо в процесі терапії виявляється погіршення неврологічного стану, то слід виключити його можливі причини:
— набряк мозку (до 10 % випадків);
— повторний інсульт або його геморагічна трансформація;
— інфекція ЦНС;
— недіагностована (пропущена) черепно-мозкова травма.
У зв’язку з клінічною підозрою на наявність цих станів слід виконати відповідні діагностичні процедури й корекцію терапії.
Висновки
1. Дія гормонів стресу протягом гострого інсульту може сприяти розвитку кетоацидозу у хворих на цукровий діабет. Правильне й протилежне: під час гострого епізоду кетоацидозу значно збільшується ризик виникнення гострого ішемічного або геморагічного інсульту.
2. Існує значний збіг симптомів, ознак і результатів лабораторних досліджень при інсульті й діабетичному кетоацидозі, що часто ускладнює точну діагностику й диференціальну діагностику цих станів.
3. З метою точної й своєчасної діагностики діабетичного кетоацидозу у всіх хворих на гострий інсульт, що страждають від цукрового діабету, при надходженні потрібно вимірювати рівень рН сироватки, бікарбонат, гази крові та аніонну різницю.
4. Інфузійна підтримка повинна проводитися ретельно й малими порціями, із постійним контролем артеріального тиску, гематокриту, рівня електролітів та показників кислотно-лужного стану. У програмі інфузійної терапії слід використовувати розчини кристалоїдів та сучасні штучні колоїди — похідні ГЕК та желатину.
5. Потрібні подальші дослідження для визначення рекомендацій та алгоритмів інтенсивної терапії у хворих на інсульт із цукровим діабетом.
Список литературы
1. Боднар П.Н., Михальчишин Г.П., Комиссаренко Ю.И., Приступюк А.М. Эндокринология. — Вінниця: Нова Книга, 2007. — 344 с.
2. Ефимов А.С., Зуева Н.А., Тронько Н.Д., Скробонская Н.А. Малая энциклопедия врача-эндокринолога: Книга 1. — К.: ООО «ДСГ Лтд», 2005. — 120 с.
3. Маньковський Б.М. Ішемічний інсульт при цукровому діабеті (фактори ризику, механізми розвитку та особливості перебігу): Автореф. дис... д-ра мед. наук. — К., 1997. — 48 с.
4. Мерхольц Я. Ранняя реабилитация после инсульта: Пер. с англ. — М.: МЕДпресс-информ, 2014. — 248 с.
5. Рыбицкий З. Интенсивное лечение взрослых пациентов / Под ред. Ю.С. Полушина, У.А. Фесенко, В.С. Фесенко. — Люблин: Makmed, 2012. — 644 с.
6. Сучасні принципи діагностики та лікування хворих із гострим ішемічним інсультом та ТІА. Адаптована клінічна настанова. — К.: Видавець Д.В. Гуляєв, 2012. — 144 с.
7. Тронько Н.Д., Соколова Л.К., Рыбченко Ю.Б. Неотложные состояния в диабетологии: кетоацидотическая кома // Острые и неотложные состояния в практике врача. — 2008. — № 4. — С. 25-28.
8. Уніфікований клінічний протокол медичної допомоги. Ішемічний інсульт (екстрена, первинна, вторинна (спеціалізована) медична допомога, медична реабілітація). — К.: Видавець Д.В. Гуляєв, 2012. — 136 с.
9. Шлапак І.П., Галушко О.А. Цукровий діабет: погляд з позиції лікаря-анестезіолога. — К.: Книга-плюс, 2010. — 160 с.
10. Alvarez-Sabín J., Molina C.A., Ribó M. Impact of admission hyperglycemia on stroke outcome after thrombolysis: risk stratification in relation to time to reperfusion // Stroke. — 2004. — 35 (11). — Р. 2493-2498.
11. Burzynski J. DKA and thrombosis // CMAJ. — 2005. — 173 (2). — 132 р.
12. Chaithongdi N., Subauste J.S., Koch C.A., Geraci S.A. Diagnosis and management of hyperglycemic emergencies // Review. Hormones. — 2011. — 10 (4). — Р. 250-260.
13. Edge J.A., Hawkins M.M., Winter D.L., Dunger D.B. The risk and outcome of cerebral oedema developing during diabetic ketoacidosis // Arch. Dis. Child. — 2001. — 85 (1). — P. 16-22.
14. Gaede P., Lund-Andersen H., Parving H.H., Pedersen O. Effect of a multifactorial intervention on mortality in type 2 diabetes // N. Engl. J. Med. — 2008. — Feb 7. — 358 (6). — P. 580-91.
15. Glaser N.S., Wootton-Gorges S.L., Marcin J.P., et al. Mechanism of cerebral edema in children with diabetic ketoacidosis // J. Pediatr. — 2004. — 145 (2). — P. 164-171.
16. Jovanovic A., Stolic R.V., Rasic D.V., Markovic-Jovanovic S.R., Peric V.M. Stroke and diabetic ketoacidosis — some diagnostic and therapeutic considerations // Vasc. Health Risk Manag. — 2014. — Apr 8. — 10. — P. 201-4.
17. Kusminsky R.E. Complications of central venous catheterization // J. Am. Coll. Surg. — 2007. — 204 (4). — P. 681-696.
18. Lin J.J., Lin K.L., Wang H.S., Wong A.M., Hsia S.H. Occult infarct with acute hemorrhagic stroke in juvenile diabetic ketoacidosis // Brain Dev. — 2008. — 30 (1). — P. 91-93.
/95.jpg)

/94.jpg)