Статтю опубліковано на с. 144-147
Вступ
Основною метою анестезіолога при проведенні анестезії є захист дитини від операційного стресу. Операційний стрес викликає в організмі дитини відповідну реакцію з боку різних систем: нервової, серцево-судинної, ендокринної, метаболізму [1, 2]. Стресова відповідь — це реакція гіпоталамо-гіпофізарно-наднирникової системи, що викликає гіперглікемію, надмірне виділення адренокортикотропного гормона, кортизолу, соматотропіну, а також зменшує секрецію інсуліну [3]. Особливе значення операційний стрес набуває саме у дітей [4] внаслідок недосконалості в них центральних і периферичних систем нейрогуморальної регуляції, що й обумовлює низьку адаптованість організму дитини.
Загальновідомо, що одним із найбільш швидко реагуючих компонентів больової реакції є перебудова серцево-судинної системи. Серед сучасних методологічних підходів до оцінки стану серцево-судинної системи та організму в цілому істотне місце належить аналізу варіабельності ритму серця (ВРС). У наш час відомо, що ВРС є ефективним методом оцінки функціонального стану організму людини, що дозволяє прогнозувати розвиток адаптаційних процесів до різних факторів зовнішнього середовища [5, 6]. Кожного моменту функціонування організму сила і ритм серцевих скорочень несуть інформацію про діяльність усіх регулюючих систем, що дозволяє на основі показників ВРС отримати об’єктивні дані про стан симпатичної і парасимпатичної ланок вегетативної нервової системи (ВНС) та їх взаємодію у дітей різного віку [7, 8]. Як результат, це дозволяє оцінити адаптивні властивості серцево-судинної системи дитячого організму.
У літературі зустрічаються роботи, в яких проведено аналіз маркерів стресу з метою оцінки адекватності антиноцицептивного захисту пацієнта. Але майже немає робіт, у яких вивчено стан ВНС при оперативних втручаннях в умовах різних способів загальної анестезії, зокрема при аденотомії у дітей.
Мета дослідження — оцінка стану вегетативної нервової системи та порівняння рівня маркерів стресу при аденотомії у дітей в умовах різних способів загальної анестезії.
Матеріали та методи
Дослідження проведено на базі відділення анестезіології та інтенсивної терапії КЗОЗ «Обласна дитяча клінічна лікарня м. Харкова». До нього увійшли 60 дітей віком від 6 до 11 років, яким було проведено аденотомію. Фізичний статус у всіх пацієнтів відповідав I за ASA.
Критерії виключення з дослідження були такі: діти віком молодші від 5 років і старші за 12 років; оперативні втручання на лор-органах, за винятком аденотомії; фізичний статус ASA III–IV; наявність тяжкої хронічної патології, що супроводжується порушеннями системного метаболізму та функціонування інших органів і систем; наявність органічного або функціонального ураження центральної нервової системи.
Залежно від способу загальної анестезії пацієнти були розподілені на 3 групи. I група (n = 21) — пацієнти, оперовані в умовах внутрішньовенної анестезії на основі пропофолу та фентанілу. II група (n = 19) — пацієнти, оперовані в умовах інгаляційної анестезії севофлюраном та фентанілом. III група (n = 20) — пацієнти, оперовані в умовах внутрішньовенної анестезії на основі тіопенталу натрію та фентанілу. За віком, антропометричними даними та статтю пацієнти в групах не відрізнялися (p > 0,05) (табл. 1).
Середня тривалість оперативного втручання у групах не відрізнялася (p > 0,05): у I групі — 7,4 ± 0,4 хвилини, у II групі — 7,5 ± 0,6 хвилини, у III групі — 7,1 ± 0,3 хвилини.
У I групі індукцію анестезії поводили з використанням 1% розчину пропофолу (2,5–3 мг/кг), підтримання здійснювали фракційним уведенням 1 мг/кг пропофолу, в середньому через 2,5–3 хвилини після попереднього введення.
У II групі індукцію анестезії здійснювали сево–флюран-кисневою сумішшю «болюсною» методикою без попереднього заповнення дихального контура 8 об% севофлюрану при потоці кисню 4 л/хв. Після досягнення клініки хірургічної стадії наркозу підтримання анестезії здійснювали подаванням 2–2,5 об% севофлюрану при потоці свіжого газу 2 л/хв.
У III групі при індукції анестезії використовували тіопентал натрію (5–6 мг/кг); зважаючи на короткочасність втручання, необхідності у повторному введенні анестетика з метою підтримання анестезії не було.
Міорелаксація забезпечувалася введенням 2% розчину дитиліну (2 мг/кг), підтримання міоплегії здійснювали у пацієнтів I та III груп за необхідності фракційним уведенням дитиліну (1 мг/кг). Штучна вентиляція легень здійснювалася повітряно-кисневою сумішшю апаратом МК-1 («Респект-Плюс», Білорусь). Пацієнтам усіх груп анальгезія інтраопераційно забезпечувалася введенням 0,005% розчину фентанілу (2 мкг/кг). З метою профілактики нудоти та блювоти пацієнтам I та III груп інтраопераційно вводили ондансетрон (0,1 мг/кг), а пацієнтам II групи — ондансетрон (0,1 мг/кг) у поєднанні з дексаметазоном (0,1–0,15 мг/кг). Післяопераційне знеболювання в усіх групах проводилося пероральним прийомом нестероїдного протизапального препарату ібупрофену (10 мг/кг). Під час анестезії проводилася інфузійна терапія 0,9% розчином NaCl в об’ємі компенсації інтраопераційних втрат.
Проводився періопераційний моніторинг, що включав: пульсоксиметрію, частоту серцевих скорочень, середній артеріальний тиск, капнометрію, ВРС монітором UM-300 (Україна). Аналізу підлягали такі параметри кардіоінтервалограми: мода (Мо) — значення кардіоінтервала (мс), що найбільш часто зустрічається в заданому динамічному ряду; амплітуда моди (АМо) — частка (%), що відповідає значенням моди; варіаційний розмах (ВР) — різниця між максимальним та мінімальним значеннями кардіоінтервалу (мс); індекс напруження регуляторних систем Баєвського (ІН, ум.од.), що розраховується за формулою: ІН = Aмо/2·Мо·ВР. Показники ВРС досліджували на таких етапах: 1-й — перед операцією; 2-й — індукція анестезії; 3-й — травматичний момент операції; 4-й — екстубація; 5-й — через 1 годину після операції; 6-й — через 6 годин після операції; 7-й — через 20 годин після операції.
Рівень кортизолу (К) у сироватці крові визначався імуноферментним методом із використанням набору реагентів (Xema-Medica, Росія), рівень інсуліну (І) — імуноферментним методом із використанням набору реагентів (DRG, Німеччина), рівень глюкози — глюкозооксидазним методом із використанням набору реагентів («Філісіт-Діагностика», Україна).
Розраховували співвідношення кортизол/інсулін (К/І), що, на думку Л.Є. Паніна [9], є найбільш об’єктивним критерієм активності компенсаторних процесів, які розвиваються в організмі у відповідь на стрес. Чим вищий цей коефіцієнт, тим менший резерв компенсаторних можливостей організму і тим більш загрозливий з точки зору прогнозу компенсації функцій стан напруження функціональних систем організму. Цей показник розраховували за формулою:
Дослідження виконувалось на таких етапах: 1-й — перед операцією; 2-й — травматичний момент операції; 3-й — екстубація; 4-й — через 20 годин після операції. Статистична обробка даних проводилась за допомогою програм Microsoft Excel, Statistica 7.0. Відмінності вважалися вірогідними при р < 0,05 з використанням значень t-критерію Стьюдента.
Результати та їх обговорення
При дослідженні маркерів стресу встановлено, що вихідні рівні кортизолу, глікемії до операції у пацієнтів трьох груп вірогідно не відрізнялися (р > 0,05). Відзначалася також вірогідна різниця передопераційних показників інсуліну між пацієнтами I та II груп і II та III груп, однак усі ці показники не виходили за межі лабораторної норми (табл. 2).
/146.jpg)
На етапі травматичного моменту операції відзначалося підвищення рівня кортизолу у I групі з 260,0 ± 24,4 нмоль/л до 333,3 ± 37,2 нмоль/л (p > 0,05), однак це підвищення було у межах лабораторної норми. У пацієнтів II та III груп відзначалася більш істотна тенденція до зростання рівня кортизолу: з 322,0 ± 88,3 нмоль/л до 830,0 ± 322,3 нмоль/л (p > 0,05) та з 308,1 ± 44,5 нмоль/л до 506,3 ± 218,2 нмоль/л (p > 0,05) відповідно. Між етапами у групах вірогідної різниці не було (p > 0,05). На етапі екстубації трахеї у пацієнтів II та III груп відзначалася тенденція до зниження рівня кортизолу, а у пацієнтів I групи він зростав, але у межах лабораторної норми. Наступного ранку після операції вірогідних міжгрупових відмінностей рівня кортизолу не відзначалося (p > 0,05).
Щодо рівня інсуліну, в усіх групах на всіх етапах дослідження він не виходив за межі лабораторної норми (13,5 ± 11,5 мкОд/мл).
Співвідношення К/І на етапі травматичного моменту операції у пацієнтів I та III груп вірогідно не відрізнялося від передопераційних показників, але у пацієнтів II групи була тенденція до зростання показника до 2,3 ± 0,6 (p > 0,05). Міжгрупових відмінностей не було (p > 0,05). У динаміці спостереження на наступних етапах дослідження у пацієнтів I групи відзначалася тенденція до зростання показника до 2,1 ± 1,0, а у пацієнтів III групи К/І майже не змінювався впродовж усіх етапів. У пацієнтів II групи наступного ранку після операції відзначалася тенденція до зниження показника до 0,5 ± 0,1, була вірогідна різниця порівняно з вихідним етапом і етапом екстубації трахеї (p < 0,01 та p < 0,05 відповідно).
Показники глікемії впродовж усіх етапів дослідження у пацієнтів усіх груп були у межах лабораторної норми (4,4 ± 1,1 ммоль/л).
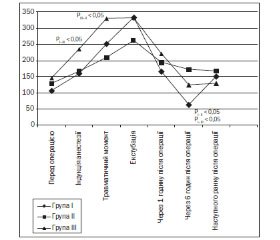
Зважаючи на те, що ІН, згідно з класифікацією Р.М. Баєвського, відображає активність ВНС, міру переваги симпатичних впливів над парасимпатичними, а також рівень напруженості регуляторних систем організму [10–12], ми надалі акцентували увагу саме на цьому інтегральному критерії. Перед–операційні значення ІН між групами вірогідних відмінностей не мали (p > 0,05) (рис. 1).
Надалі у пацієнтів усіх груп починаючи від етапу індукції анестезії до етапу екстубації трахеї включно відзначалася тенденція до підвищення ІН, що підтверджує наявність напруження компенсаторно-адаптаційних механізмів із переважанням симпатичного відділу ВНС. Після етапу екстубації трахеї у пацієнтів усіх груп реєструвалася тенденція до зниження активності симпатичного тонусу. Наступного ранку після операції значення ІН у всіх групах вірогідно не відрізнялися від передопераційних даних (p > 0,05).
Підсумовуючи проаналізовані параметри ВРС, ми встановили, що статистично вища активність симпатичного відділу вегетативної нервової системи була у пацієнтів III групи під час індукції анестезії порівняно з пацієнтами I групи (p < 0,05) та II групи (p < 0,05) на етапі травматичного моменту операції. Звертало на себе увагу те, що у дітей I групи через 6 годин після операції відбувалося вірогідне зниження ІН, судячи з усього, як результат вагусної активації.
Висновки
1. Анестезія з використанням пропофолу у поєднанні з фентанілом (2 мкг/кг) при аденотомії у дітей забезпечує найбільш виражений антиноцицептивний захист порівняно з анестезією севофлюраном у поєднанні з фентанілом (2 мкг/кг) та тіопенталом натрію у поєднанні з фентанілом (2 мкг/кг).
2. Дослідження індексу напруження регуляторних систем при аденотомії у дітей в умовах різних способів загальної анестезії продемонструвало, що в інтраопераційному періоді відзначалася активація симпатичного тонусу ВНС у дітей усіх груп, що була більш вираженою у дітей, яким проводили аденотомію в умовах загальної анестезії з використанням тіопенталу натрію у поєднанні з фентанілом, із подальшою тенденцією до її зниження.
3. При проведенні дітям аденотомії в умовах загальної анестезії з використанням пропофолу у поєднанні з фентанілом необхідно звертати увагу на стабільність показників гемодинаміки з 1-ї по 6-ту годину після проведеної операції, беручи до уваги зниження ІН упродовж цього періоду.
Список литературы
1. Зильбер А.П. Клиническая физиология в анестезиологии и реаниматологии. — М.: Медицина, 1984. — C. 113-124.
2. Reis F.М., Ribeiro-de-Oliveira A. Jr, Machado L., Guerra R.M., Reis A.M., Coimbra C.C. Изменения пролактина и глюкозы в плазме, индуцированные хирургическим стрессом: единая или двойственная реакция? Мини-обзор / Перевод и обработка В. Фесенко // Медицина неотложных состояний. — 2008. — № 5(18). — С. 108-114.
3. Palmieri T.L., Lerine S., Schonffeld-Warden N., O’Mara M.S., Greenhalgh D.G. Hypothalamic-pituitary-adrenal axis response to sustained stress after major burn injury in children // J. Burn. Care Res. — 2006. — 27. — P. 742-748. doi: 10.1097/01.BCR.0000238098.43888.07.
4. Гвак Г.В. Хирургический стресс и естественные стресс-лимитирующие системы у детей: Автореф. дис… д-ра мед. наук: 14.00.37 / НИИ общей реаниматологии РАМН. — М., 2005. — 46 с.
5. Киселев А.Р., Киричук В.Ф., Гриднев В.И., Колижирина О.М. Оценка вегетативного управления сердцем на основе спектрального анализа вариабельности сердечного ритма // Физиология человека. — 2005. — Т. 31, № 6. — С. 37-43.
6. Баевский P.M., Иванов Г.Г., Чирейкин Л.В. Анализ вариабельности сердечного ритма при использовании различных электрокардиографических систем: Метод. рек. // Вестник аритмологии. — 2001. — № 24. — С. 1-23.
7. Баевский Р.М., Семенов Ю.Н. Комплекс для обработки кардиоинтервалограмм и анализа вариабельности сердечного ритма Варикард 2.51. — Рязань: Рамена, 2007. — 288 с.
8. Коняева Т.Н. Возрастные особенности вегетативной регуляции у практически здоровых мальчиков 10–17 лет по данным кардиоинтервалографии // Альманах «Новые исследования». — М.: Вердана, 2003. — № 2(5). — С. 102-107.
9. Панин Л.Е. Биохимические механизмы стресса. — Новосибирск: Наука, Сибирское отделение, 1983. — 240 с.
10. Баевский Р.М., Кирилов О.И., Клецкин С.З. Математический анализ изменений сердечного ритма при стрессе. — М.: Наука, 1984. — 219 с.
11. Флюнт І.С., Тимочко О.Б., Гривнак Р.Ф., Оліярник О.Я., Романський Р.Ю., Ткачук С.П. Зв’язки показника активності регуляторних систем Баєвського з параметрами варіабельності серцевого ритму // Медична гідрологія та реабілітація. — 2011. — Т. 9, № 2. — С. 102-108.
12. Макаров Л.М. Холтеровское мониторирование. — 2-е изд. — M.: ИД «Медпрактика-М». — 2003. — 340 с.
/145.jpg)
/147.jpg)

/145_2.jpg)
/146.jpg)