Статтю опубліковано на с. 65-70
Вступ
Актуальність дослідження обумовлена тим, що метастатичне ураження кісток є однією з найскладніших проблем сучасної онкоортопедії. Метастази в кістки, як правило, супроводжуються тривалим болем, що виснажує пацієнта й призводить до значного погіршення життя [3, 12]. Біль та інші ускладнення, викликані метастатичним ураженням кісток, можуть значно обмежувати функцію різних органів, призводять до розвитку переломів кісток і є несприятливим прогностичним фактором [8, 11]. Зростання частоти метастатичного ураження кісток спостерігається зі збільшенням розмірів первинної пухлини [12]. Середній час між хірургічним видаленням первинної пухлини й появою метастазів становить близько 38 місяців [15]. Середня тривалість життя пацієнтів з метастатичним ураженням кісток становить від 6 до 35 місяців [9, 10, 13]. Медіана виживання хворих при метастазах у кістки становить 6–48 місяців [1].
Лікування метастатичного ураження кісток у частини хворих з онкопатологією може бути радикальним, але в переважної більшості хворих — тільки паліативним. У літературі повідомляється, що головними показаннями до хірургічного лікування метастатичного ураження кісток є солітарні метастази, виражений больовий синдром, патологічний перелом або загроза його виникнення, але застосування тільки хірургічних методів лікування призводить до 45,6 % рецидивів пухлини [1, 4, 6].
Хірургічне лікування, що є паліативним методом у комбінованій терапії метастазів у кістки, відіграє важливу роль в адаптації хворих і полегшує проведення їм певних маніпуляцій [5]. При плануванні хірургічного лікування патологічних переломів довгих трубчастих кісток на тлі метастатичного ураження необхідно враховувати наступне: метод фіксації повинен забезпечити достатню стабільність у ранні терміни після хірургічного втручання, зрощення в ділянці перелому не відбувається, фіксація уламків кістки повинна бути задовільною до кінця життя хворого [1, 6]. Ендопротезування суглобів практично завжди обґрунтоване та є методикою вибору при метастатичному ураженні суглобових сегментів кістки, але використання ендопротезів, що заміщують 2/3 або цілу кістку, при ураженні діафіза кістки дуже травматичне й виправдане тільки при солітарних метастазах або первинних пухлинах кісток, коли воно спрямоване на лікування хворого [2]. Черезкістковий остеосинтез характеризується тривалістю лікування, що часто перевищує тривалість життя хворого з IV стадією онкологічного процесу, використанням об’ємних конструкцій, які обмежують амплітуду рухів у суглобах, та високою ймовірністю розвитку запальних ускладнень — до 40,8 % в онкологічно ослаблених хворих [2]. З огляду на те, що більшість онкологічних хворих є ослабленими пацієнтами, можливість застосування малоінвазивних (кістковий цемент) методів лікування кісткових метастазів на сьогодні є актуальним питанням [7], але використання кісткового цементу при патологічних переломах довгих трубчастих кісток при значному метастатичному ураженні кістки по довжині не завжди є достатнім. Цементна вставка при навантаженнях втрачає зв’язок з кісткою, що призводить до перелому, тому необхідний додатковий металоостеосинтез: накістковий або інтрамедулярний, який підсилює конструкцію та сприяє опороздатності та функціонуванню кінцівки, що підтверджено ви експериментальному дослідженні [14]. При хірургічних втручаннях на довгих трубчастих кістках при метастатичному ураженні вдається покращити опороздатність та функцію кінцівки, поліпшити якість життя хворих і в найближчому післяопераційному періоді проводити додаткову специфічну терапію [7]. У літературі практично відсутні дані про вибір методики металоостеосинтезу при патологічному переломі або загрозі патологічного перелому при метастатичному ураженні довгої трубчастої кістки кінцівки. У даній статті на підставі клінічних спостережень та результатів лікування хворих із метастатичним ураженням кісток нами була запропонована схема вибору різних методик остеосинтезу довгих кісток кінцівок при даній патології.
Матеріали та методи
У клінічному відділі ДУ «Інститут травматології та ортопедії НАМН України» за період з 2009 по 2015 рік остеосинтез з приводу метастатичного ураження довгих трубчастих кісток кінцівок виконаний 63 пацієнтам. Остеосинтез стрижневими апаратами зовнішньої фіксації Костюка — у 31 пацієнта, армований остеосинтез з використанням кісткового цементу — у 32 пацієнтів. Чоловіків було 24 (38,1 %), жінок — 39 (61,9 %). Вік пацієнтів — від 35 до 78 років, середній вік становив 49,2 ± 0,9 року.
За локалізацією пухлинного процесу розподіл пацієнтів був таким: стегнова кістка (проксимальний відділ) — 20 (31,7 %) пацієнтів, стегнова кістка (діафіз) — 15 (23,8 %), плечова кістка (діафіз) — 12 (19 %), стегнова кістка (дистальний відділ) — 6 (9,5 %), великогомілкова кістка (діафіз) — 4 (6,3 %), плечова кістка (проксимальний відділ) — 2 (3,2 %), плечова кістка (дистальний відділ) — 2 (3,2 %), великогомілкова кістка (проксимальний відділ) — 1 (1,6 %), променева кістка (діафіз) — 1 (1,6 %).
У табл. 1 подана кількість пацієнтів, яким виконані різні види остеосинтезу, залежно від першоджерела пухлини.
У табл. 2 подані методики остеосинтезу, застосовані в комплексному лікуванні 63 хворих з метастатичним ураженням довгих трубчастих кісток кінцівки.
Методика застосування апаратів зовнішньої фіксації. Хворому при морфологічному підтвердженні патологічного перелому довгої трубчастої кістки або загрозі його виникнення на тлі метастатичного ураження виконувалось хірургічне втручання, що полягало в проведенні металевих стрижнів у кістку під контролем емісійно-оптичного перетворювача проксимальніше й дистальніше за осередок ураження, від видимих меж ураження відступали на 2–3 см (враховувалися рентгенограми).
Для проведення стрижнів виконувалися розрізи шкіри до 1 см. За допомогою дриля свердлом проводилося розсвердлювання кістки через два кортикальних шари. Після фіксації металевих стрижнів у кістці встановлювали металеву рамку апарата. При переломах проксимального відділу стегнової кістки (шийка, міжвертлюгова ділянка) металеві стрижні для більш надійної фіксації встановлювалися проксимальніше в тілі клубової кістки.
Методика армованого металоостеосинтезу. Хворому при морфологічному підтвердженні метастатичного ураження довгої трубчастої кістки проводилось хірургічне втручання, що складалося з трепанації кістки, кюретажу метастатичної пухлини або внутрішньокісткової резекції кістки з пухлиною та заміщення дефекту кістки кістковим цементом (поліметилметакрилат) Pаlаcos або Palamed. При патологічному переломі або загрозі патологічного перелому кістки на тлі метастатичного ураження додатково проводився накістковий металоостеосинтез пластинами різної конфігурації й розмірів або металоостеосинтез інтрамедулярним стрижнем.
Вибір методики остеосинтезу при патологічному переломі або загрозі патологічного перелому кістки на тлі метастатичного ураження визначався нами з урахуванням пропозиції авторів [2] з огляду на фактори, наведені в табл. 3.
У всіх пацієнтів остеосинтез виконувався у схемах комплексного лікування (хіміотерапія (ХТ), променева терапія (ПТ), бісфосфонати, імунотерапія (ІТ), гормонотерапія (ГТ), радіоізотопна терапія).
Крім хірургічного лікування 31 пацієнтові, яким був встановлений стрижневий апарат зовнішньої фіксації Костюка, проводилося опромінення ураженого сегмента кістки до сумарної осередкової дози (СОД) 30–40 Гр (разова вогнищева доза (РОД) становила 2,2–3 Гр щоденно). Після хірургічного органозберігаючого втручання паралельно з променевою терапією призначалися бісфосфонати внутрішньовенно та курси системної поліхіміотерапії (ПХТ) згідно зі схемами лікування первинної пухлини. З бісфосфонатів пацієнти отримували внутрішньовенно золедронову кислоту в стандартному дозовому режимі 4 мг у вигляді 15–20-хвилинної інфузії або памідронову кислоту (паміредин) у дозі 90 мг/добу з інтервалом між введеннями 28 днів. Кількість введень — від 6 до 12, залежно від ефекту лікування й типу первинної пухлини.
У 32 пацієнтів, яким був виконаний накістковий або заглибний інтрамедулярний металоостеосинтез, у передопераційному періоді проводився курс променевої терапії на вогнище ураження. Передопераційна ПТ на уражений сегмент кістки проводилася до СОД 30–40 Гр (РОД 2,2–3,0 Гр щоденно) з віддаленим хірургічним лікуванням через три тижні після останнього сеансу ПТ для абластичного та більш радикального видалення метастатичної пухлини.
Функціональний результат прооперованої кінцівки розраховувався за шкалою MSTS (Musculo-Sceletal Tumor Staging/System). Ступінь больового синдрому визначали за шкалою R.G. Watkins (шкала балів від 0 до 4, де 0 — немає болю та порушення функції; 1 — мінімальний біль та порушення функції; 2 — помірний біль та порушення функції; 3 — несильний постійний біль та порушення функції; 4 — постійний сильний біль із постійним прийомом наркотичних анальгетиків). Якість життя хворих визначали згідно з опитувальником EORTC QLQ-С30. Опитувальник EORTC QLQ-C30 складається з 30 питань, що згруповані в 5 функціональних шкал, 3 шкали симптоматики та подані як поодинокі пункти, причому кожному варіанту відповіді відповідає певний бал. Виживаність хворих розраховувалась за методом Kaplan — Meier.
Отримані результати та їх обговорення
У результаті комплексного лікування 63 хворих із метастатичним ураженням кісток, що складалося з хірургічного лікування (армований металоостеосинтез, апарати зовнішньої фіксації), ПХТ, ПТ, ІТ, ГТ, бісфосфонатів, ускладнення виявлено в 1 (1,59 ± 0,03 %) хворого (нагноєння рани в місці введення стрижнів апарата зовнішньої фіксації), ускладнень у процесі та після проведення ПХТ та ПТ не спостерігалося.
Рецидиви метастатичної пухлини в місці хірургічного втручання виявлені в 3 (4,76 ± 0,05 %) пацієнтів (після армованого металоостеосинтезу).
Результати порівняльної оцінки больового синдрому в місці метастатичного ураження кістки (за R.G. Watkins) до і після застосування стрижневих апаратів зовнішньої фіксації подані в табл. 4.
При порівняльній оцінці больового синдрому до і після операції (табл. 4) видно, що 14 (45,16 ± 0,20 %) хворих до операції мали больовий синдром, що відповідав 2–3 балам за шкалою R.G. Watkins. У 12 (38,71 ± 0,20 %) хворих зберігався постійний сильний больовий синдром (4 бали за R.G. Watkins). Дана група пацієнтів потребувала постійного прийому наркотичних анальгетиків.
У післяопераційному періоді в 3 (9,68 ± 0,30 %) хворих больовий синдром був відсутній (0 балів за R.G. Watkins). У 26 (83,87 ± 0,10 %) хворих (1–2 бали за R.G. Watkins) була необхідність у періодичному прийомі ненаркотичних анальгетиків, що купірували больовий синдром. У 2 (6,46 ± 0,40 %) пацієнтів зберігався виражений больовий синдром (3–4 бали за R.G. Watkins), що вимагало прийому наркотичних анальгетиків.
При порівняльній оцінці больового синдрому в місці метастатичного ураження до і після армованого металоостеосинтезу (за R.G. Watkins) отримані такі результати (табл. 5).
При порівняльній оцінці больового синдрому до і після операції армованого металоостеосинтезу (табл. 5) видно, що переважна більшість — 24 (68,76 ± 0,10 %) хворі до операції мали больовий синдром, що відповідав 2–3 балам за шкалою R.G. Watkins. У 7 (21,86 ± 0,3 %) хворих зберігався постійний сильний больовий синдром (4 бали за R.G. Watkins). Дана група пацієнтів потребувала постійного прийому наркотичних анальгетиків.
У післяопераційному періоді в 14 (43,75 ± 0,2 %) хворих зберігався мінімальний больовий синдром (1 бал за R.G. Watkins), що не вимагало прийому анальгетиків. У 6 (18,75 ± 0,30 %) пацієнтів больовий синдром був відсутній. У 2 (6,25 ± 0,40 %) хворих була необхідність у періодичному прийомі ненаркотичних анальгетиків, що купірували больовий синдром.
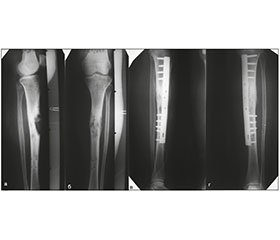
На рис. 1 подані фотовідбитки рентгенограм хворої Д. із метастазом раку молочної залози у великогомілкову кістку і загрозою патологічного перелому, якій виконано армований металоостеосинтез великогомілкової кістки з використанням накісткової пластини.
Результати функціональної активності прооперованого відділу скелета після використання стрижневих апаратів зовнішньої фіксації (за шкалою MSTS): при локалізації метастатичного вогнища в проксимальному відділі стегнової кістки, коли проводиться фіксація стрижнів у клубовій кістці та дистальніше за вогнище ураження в стегновій (своєрідний артродез), — 60,2 ± 0,1 %, при локалізації метастатичного вогнища в діафізі стегнової кістки — 76,40 ± 0,08 %, при локалізації метастатичного вогнища в дистальному відділі стегнової кістки, коли проводиться фіксація стрижнів у стегновій кістці проксимальніше за осередок ураження та дистальніше в проксимальному відділі великогомілкової кістки (своєрідний артродез), — 62,4 ± 0,1 %.
У результаті використання армованого металоостеосинтезу при метастатичному ураженні кістки функціональна активність прооперованого відділу скелета (за шкалою MSTS) становила: стегно — 67,00 ± 0,09 %, плече — 74,00 ± 0,08 %, передпліччя — 88,00 ± 0,06 %, гомілка — 71,20 ± 0,08 %.
При визначенні якості життя хворих з метастатичним ураженням кісток до і після використання стрижневих апаратів зовнішньої фіксації згідно з опитувальником EORTC QLQ-C30 відзначено поліпшення якості життя з 30 балів до 70 балів.
При визначенні якості життя хворих з метастатичним ураженням кісток до і після армованого металоостеосинтезу згідно з опитувальником EORTC QLQ-C30 відзначалося поліпшення якості життя з 45 балів до 75 балів. Загальна трирічна виживаність пацієнтів становила 32,60 ± 0,76 %, п’ятирічна — 18,40 ± 1,22 %.
Висновки
При метастатичному ураженні довгої кістки кінцівки, загрозі або патологічному переломі кістки методика черезкісткового остеосинтезу може бути використана для стабільної фіксації та усунення деформації, що дозволяє хворим самостійно обслуговувати себе, і на сьогодні вона є методикою вибору. Наявність встановленого стрижневого апарату зовнішньої фіксації не є протипоказанням до проведення променевої терапії та хіміотерапії. Коли консолідація патологічного перелому проблематична або має місце солітарне метастатичне ураження, методика черезкісткового остеосинтезу дозволяє провести протипухлинне лікування в комфортних для хворого умовах і наступним етапом виконати органозберігаючу операцію (ендопротезування, алопластика, автопластика, армований металоостеосинтез). Методика армованого металоостеосинтезу дозволяє домогтися більш стабільної фіксації кістки. Основними факторами, що забезпечують клінічний ефект армованого металоостеосинтезу, є: консолідація кістки й забезпечення внаслідок цього опороспроможності та функції кінцівки; термічне руйнування больових рецепторів періосту кістки й усунення внаслідок цього больового синдрому, що підтверджено в експериментальних дослідженнях деякими авторами [14].
Додатковими факторами армованого остеосинтезу, які впливають на клінічний ефект лікування хворих, що також підтверджено в експериментальних дослідженнях [14], є: хімічний цитотоксичний вплив на тканину пухлини (за рахунок токсичності мономера кісткового цементу); термічний цитотоксичний вплив (термокоагуляція) на тканину пухлини (за рахунок екзотермічної реакції композиційних матеріалів); ішемічний вплив на тканину пухлини — порушення кровопостачання пухлини.
У результаті застосування комплексного лікування (із застосуванням хірургічних методик лікування) хворих із метастатичним ураженням кісток вдалося досягти швидкого знеболювання у хворих і завдяки цьому поліпшити якість життя даної категорії хворих.
Отже, при виборі методики остеосинтезу при метастатичному ураженні кісток кінцівок необхідно враховувати такі фактори: локалізація пухлини в кістці, протяжність процесу в кістці, гістологічний варіант первинної пухлини, ступінь її злоякісності, давність перелому та чутливість до специфічної терапії.
Список литературы
1. Алиев М.Д. Органосохраняющие методы хирургического лечения метастазов рака почки при поражении длинных трубчатых костей / М.Д. Алиев, В.В. Тепляков, В.А. Соколовский // Онкоурология. — 2006. — № 1. — С. 12-16.
2. Выбор тактики и метода хирургического лечения у больных с патологическими переломами длинных трубчатых костей / В.В. Тепляков, В.Ю. Карпенко, Э.Р. Мусаев [и др.] // Мат-лы IX Российского онкологического конгресса. — М., 2005. — С. 62-64.
3. Коноваленко В.Ф. Опухоли и опухолеподобные заболевания костей и суставов (клиника, диагностика, лечение) / В.Ф. Коноваленко, А.А. Бурьянов, В.В. Проценко В.В. [и др.] — К.: Лазурит-Полиграф, 2015. — 344 с.
4. Махсон А.Н. Хирургия при метастатических опухолях костей / А.Н. Махсон, Н.Е. Махсон. — М: Реальное время, 2002. — 120 с.
5. Онкология: клинические рекомендации / Под ред. В.И. Чиссова, С.Л. Дарьяловой. — М.: ГЭОТАР-медицина, 2006. — 720 с.
6. Тарасов А.Н. Лечебная тактика при патологических переломах (обзор литературы) / А.Н. Тарасов // Травматология и ортопедия России. — 2009. — № 2. — С. 150-156.
7. Тепляков В.В. Хирургическое лечение патологических переломов длинных трубчатых костей при метастатическом поражении / В.В. Тепляков, В.Ю. Карпенко, А.К. Валиева // Вопросы онкологии. — 2005. — Т. 51, № 3. — С. 377-381.
8. A population-based study of surgery for spinal metastases: survival rates and complications / J. Finkelstein, G. Zaveri, E. Wai [et al.] // J. Bone Joint Surg. Br. — 2003. — Vol. 85. — P. 1045-1050.
9. Characterization of bone metastases in patients with renal cell cancer / G.U. Adiga, J.P. Dutcher, M. Larkin [et al.] // BJU Int. — 2004. — Vol. 93. — P. 1237-1240.
10. Coleman R.E. Metastatic bone disease: clinical features, pathophysiology and treatment strategies / R.E. Coleman // Cancer Treat. Rev. — 2001. — Vol. 27. — P. 165-176.
11. Costs of prostate cancer, metastatic to the bone, in The Netherlands / M.T. Groot, C.G. Boeken-Kruger, R.C. Pelger [et al.] // Eur. Urol. — 2003. — Vol. 43. — P. 226-232.
12. Health-related quality of life among patients with breast cancer receiving zoledronic acid or pamidronate disodium for metastatic bone lesions / K.P. Weinfurt, L.D. Castel, Y. Li [et al.] // Med. Care. — 2004. — Vol. 42. — P. 164-175.
13. Lipton A. Pathophysiology of bone metastases: how this knowledge may lead to therapeutic intervention / A. Lipton // J. Support. Oncol. — 2004. — Vol. 2. — P. 205-220.
14. Malawer M.M. The effect of cryosurgery and PMMA in dogs with experimental bone defects, comparable to tumor defects / M.M. Malawer, A. Marks, D. McChacney // Clin. Orthop. — 1988. — Vol. 226. — P. 299-310.
15. Metastatic breast carcinoma confined to bone: portrait of a clinical entity / E. Briasoulis, V. Karavasilis, L. Kostadima [et al.] // Cancer. — 2004. — Vol. 101. — P. 1524-1528.

/66.jpg)
/67.jpg)
/68.jpg)
/69.jpg)