Статтю опубліковано на с. 108-112
Вступ
Останніми роками в усьому світі відмічається тенденція до росту захворюваності на бронхіальну астму (БА) і наростання її тяжкості. Особливо виражена ця тенденція в дітей. Уточнення ролі й місця супутніх факторів — як тригерних, так і етіологічних — у виникненні БА має принципове значення для визначення тактики лікування захворювання [1, 4, 8, 9].
Найбільш актуальним постає вивчення у хворих БА ролі мікробно-вірусних асоціацій, у яких одним із інфекційних агентів є внутрішньоклітинні збудники (Chlamydophila pneumonia, Mycoplasma pneumoniae). Встановлено, що внутрішньоклітинні збудники можуть як обумовити дебют захворювання, так і бути причиною його загострення й тяжких варіантів перебігу [6].
Доведено, що БА, асоційована з атиповою флорою, перебігає тяжко, характеризується персистуючим перебігом на фоні адекватної терапії інгаляційними стероїдами й β2-агоністами тривалої дії, частими й тяжкими загостреннями, супроводжується вираженими порушеннями вентиляційної функції легень. Однак роль атипової флори в загостренні БА та формуванні резистентності до терапії до цього часу залишається недостатньо вивченою [2].
Дослідження, проведені у Великобританії та США, виявили статистично вірогідне збільшення стероїдозалежних форм БА у хворих, інфікованих Chlamydophila pneumoniae, порівняно з неінфікованими. Після проведення специфічної антибактеріальної терапії відмічено покращення перебігу захворювання та зниження стероїдозалежності [5, 6].
Дані літератури свідчать про те, що атипові збудники, з одного боку, змінюють імунну відповідь хворого на БА (як загальний, так і місцевий імунітет), а з другого боку, сприяють колонізації дихальних шляхів іншими патогенами, що призводить до рецидивування та прогресуючого перебігу захворювання.
Поширеність свистячого дихання (wheezing), за даними анкетування, коливається у дітей 8 років і старше від 2,1 до 32,2 % і від 4,1 до 32,1 % — у групі 6–7-річних дітей (близько 20–25 % бронхітів у дітей перебігає у вигляді гострих обструктивних бронхітів, що суттєво більше, чим у дорослих [7]. Крім того, обструктивні стани на фоні гострих респіраторних вірусних інфекцій реєструються в 10–30 % дітей [7]. За даними В.К. Таточенко, у значної частини хворих на обструктивний бронхіт (30–50 %) він повторюється, у 25 % спостерігається трансформація в рецидивуючий бронхіт, у 47,6 % — у бронхіальну астму.
Мета роботи: оцінити ефективність лікування дітей з бронхообструктивним синдромом (БОС), асоційованим з атиповими збудниками.
Матеріали та методи дослідження
Під спостереженням було 105 дітей з БОС віком від 3 до 15 років, із них: 35 дітей із рецидивуючим обструктивним бронхітом (РОБ), 35 хворих з бронхіальною астмою, легким персистуючим перебігом (БАЛПП), 35 пацієнтів з бронхіальною астмою, середньотяжким персистуючим перебігом (БАСТПП). Контрольну групу становили 30 здорових дітей того ж віку.
Серед пацієнтів із БАЛПП у 72,3 % виявлена сенсибілізація до пилкових та побутових алергенів, у 27,7 % — до пилкових алергенів. У дітей з БАСТПП у 82,5 % виявлена сенсибілізація до різних видів пилкових та побутових алергенів, у 16,5 % — до пилкових алергенів. Погіршення стану, поява симптомів на фоні гострих респіраторних інфекцій відмічені у 92 % хворих з РОБ, 75 % дітей із БАЛПП, 82 % пацієнтів із БАСТПП.
Застосовувались загальноклінічні методи дослідження (анамнез захворювання, алергологічний анамнез, клінічний огляд), лабораторне обстеження крові, визначення sIgA в слині. Усі діти були обстежені на наявність антитіл IgG до Chlamydophila pneumoniae методом імуноферментного аналізу за допомогою наборів фірми Organics (Ізраїль), виконано дослідження слизу із зіву методом прямої імунофлюоресценції: виявлення антигенів Mycoplasma pneumoniae («Мікопневмо флюоскрин», м. Москва), антигенів Chlamydophila pneumoniae («Хламіскан», м. Москва). Діагностично значимим титром до хламідій вважався 1 : 8. Усі серопозитивні діти були обстежені після лікування через 1 місяць. Визначались показники клітинної ланки імунітету СD3+, СD4+, СD8+, СD4+/СD8+, СD16+, СD22+ методом непрямої імунофлюоресцентної реакції з моноклональними антитілами виробництва ЗАТ «Сорбент-сервіс» (м. Москва) та гуморальної ланки — вміст сироваткових імуноглобулінів (G, A, M) визначали за методом Mancini et al. (1965). Фагоцитарну активність нейтрофілів з підрахунком фагоцитарного індексу й числа, рівень ІЛ-1β у сироватці крові визначали за допомогою твердофазного методу імуноферментного аналізу з використанням набору Biotract, рівень ІЛ-4 — тим же методом з використанням набору «Протеїновий контур». Рівень загального імуноглобуліну Е у сироватці крові визначали імуноферментним методом (Delfia, Фінляндія). Статистичний аналіз проводився з використанням пакету програм статистичної обробки «Статист».
Усім серопозитивним дітям призначались макроліди — 2 курси по 10 днів, пробіотик (2 млрд L.acidophillus + B.lactis + фруктоолігосахариди) по 1 табл. 2 рази на добу та імуномодуляторна терапія протягом місяця. Хворі з РОБ отримували антилейкотрієнові препарати як базисну терапію протягом 3 місяців. Обстеженим із БАЛПП та БАСТПП призначали інгаляційні стероїди для базисної терапії протягом 4–6 місяців.
Результати досліджень та їх обговорення
Інтоксикаційний синдром, що проявлявся у вигляді загальної слабкості, нездужання, зниження апетиту, головного болю, головокружіння, міалгії, підвищеної пітливості, спостерігався у 82,3 % дітей із РОБ, 86,5 % хворих із БАЛПП і 89,7 % пацієнтів із БАСТПП. Лихоманка до субфебрильних цифр визначалась у 76,2 % дітей із РОБ, 82,7 % хворих із БАЛПП і 84,3 % обстежених з БАСТПП. Збільшення регіонарних лімфатичних вузлів характерним було у 82,8 % дітей з РОБ, 85,8 % дітей із БАЛПП і 89,4 % пацієнтів із БАСТПП.
Гепатолієнальний синдром спостерігався в 66,2 % дітей з РОБ, 72,7 % обстежених із БАЛПП і 78,3 % хворих з БАСТПП. Сухий нападоподібний або кашлюкоподібний кашель, що спостерігався протягом 7–10 діб, був у 82,4 % дітей з РОБ, у 87,8 % хворих з БАЛПП та у 92,4 % обстежених із БАСТПП.
У групі дітей з РОБ у 64,58 % виявлені антитіла IgG до хламідій, у 16,66 % — антигени до хламідій, у 20,8 % — антигени до мікоплазми, у 14,58 % — антигени до хламідій та мікоплазми.
При вивченні показників клітинного імунітету відмічено вірогідне зниження СD3+-лімфоцитів у 88,4 %, СD4+-субпопуляції — у 92,3 %, СD8+-клітин — у 95,4 %, СD22+-лімфоцитів — у 69,3% порівняно з даними контрольної групи (р < 0,001). Фагоцитарна активність нейтрофілів була вірогідно знижена у 82,1 % (р < 0,001) (табл. 1).
З боку гуморального імунітету (табл. 2) відмічено виражену гіпогаммаглобулінемію, вірогідне зниження концентрації IgG у 95,7 % дітей, ІgА — у 88,2 % хворих та ІgМ — у 80,5 % обстежених з РОБ порівняно з контролем (табл. 2). Спостерігалося підвищення рівня ІЛ-4 у 3,5 раза, ІЛ-1β — у 14 разів порівняно з контролем, зниження концентрації sІgА у 2,4 раза у 96 % хворих та підвищення рівня загального ІgЕ у 2 рази у 36,35 % хворих з РОБ (табл. 2, 4). Підвищення рівня ІЛ-4, ІЛ-1β та зниження концентрації sІgА вказує на вираженість запального процесу, напруження неспецифічних протиінфекційних факторів захисту та зниження захисту слизових оболонок від патогенної флори.
При проведенні кореляційно-регресивного аналізу спостерігалася позитивна кореляція між рівнем ІЛ-4 та кількістю СD4+-лімфоцитів (r = 0,522; р < 0,05), вмістом IЛ-4 і субпопуляцією CD8+-клітин (r = 0,509; р < 0,05), рівнем IЛ-4 і концентрацією ІgA (r = 0,605; р < 0,05), умістом IЛ-4 і концентрацією IgE (r = 0,833; р < 0,01), високий ступінь кореляції між рівнем ІЛ-1β і вмістом СD4+-лімфоцитів (r = 0,678; р < 0,05), вмістом ІЛ-1β і кількістю СD22+-клітин (r = 0,739; р < 0,01), рівнем ІЛ-1β і фагоцитарним індексом (r = 0,877; р < 0,01), що свідчить про посилення імунної відповіді за рахунок не тільки збільшення числа Т-хелперів, але й стимуляції дозрівання В-лімфоцитів і проліферації В-клітин та протиінфекційного захисту.
При проведенні кореляційно-регресивного аналізу ми спостерігали позитивну кореляцію між титром антитіл ІgG до Chlamуdophila pneumonia і вмістом СD4+-лімфоцитів (r = 0,462; р < 0,05), кількістю СD8+-клітин (r = 0,345; р < 0,05), концентрацією ІgG (r = 0,425; р < 0,05), концентрацією ІgА (r = 0,487; р < 0,05), концентрацією ІgМ (r = 0,320; р < 0,05), що вказує на те, що атипові збудники призводять до зниження клітинного та гуморального імунітету.
Підвищення рівня загального ІgЕ та зниження sIgA вказує на сенсибілізацію організму алергенами й інфекційними агентами. Дефіцит секреторного sІgА посилює проникність слизової оболонки та сприяє проникненню алергену. Оскільки sІgА і ІgЕ синтезуються переважно в слизових оболонках, порушення продукції ІgА призводить до компенсаторного підвищення вироблення ІgЕ. Порушення імунологічного бар’єра в результаті недостатності sІgА сприяє проникненню поряд з алергенами й інфекційних агентів, що мають якості алергенів (наприклад, Staphylococcus aureus, H.influenzae, Klebsiella, атипові збудники і інші), що сприяє додатковій сенсибілізації організму дітей.
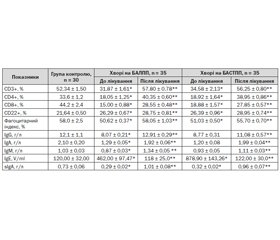
Обстеження хворих на бронхіальну астму з легким персистуючим перебігом (табл. 3) показало, що кількість СD3+-лімфоцитів у 95,2 %, СD4+-субпопуляції — у 93,6 % та СD8+-клітин — у 93,5 %, СD22+-лімфоцитів — у 74,6 % та фагоцитарна активність нейтрофілів — у 98,4 % були вірогідно нижче за дані контрольної групи. Концентрація сироваткових імуноглобулінів ІgG у 92,5 %, ІgА — у 93,6 % дітей та ІgМ — у 74,6 % обстежених вірогідно знижена порівняно з контролем (табл. 3).
Спостерігалася позитивна кореляція між вмістом СD4+-лімфоцитів і концентрацією ІgG (r = 0,694; р < 0,05), кількістю СD4+-клітин і концентрацією ІgА (r = 0,748; р < 0,01, високий ступінь кореляції), вмістом лімфоцитів з фенотипом СD4+ і концентрацією ІgМ (r = 0,566; р < 0,05), що вказує на прямий зв’язок між Т-лімфоцитами хелперами та сироватковими імуноглобулінами.
У дітей із БАЛПП було виявлено вірогідне підвищення вмісту загального ІgЕ в 4 рази порівняно з контролем та зниження концентрації sІgА в 2,5 раза порівняно з контролем (р < 0,001) (табл. 3). Характерним було вірогідне підвищення рівня ІЛ-4 в 3,5 раза та ІЛ-1β — в 11 разів порівняно з контролем (табл. 4), що свідчить про вираженість алергічного запалення й напруження неспецифічної резистентності організму.
Спостерігалася також позитивна кореляція між рівнем ІЛ-4 і вмістом СD4+-клітин (r = 0,523; р < 0,05), вмістом ІЛ-4 і кількістю СD8+-лімфоцитів (r = 0,470; р < 0,05), рівнем ІЛ-4 і концентрацією ІgА (r = 0,452; р < 0,05), вмістом ІЛ-4 і концентрацією ІgЕ (r = 0,519; р < 0,05) та рівнем ІЛ-1β і кількістю СD4+-клітин (r = 0,615; р < 0,05), вмістом ІЛ-1β і вмістом СD22+-лімфоцитів (r = 0,884; р < 0,01), рівнем ІЛ-1β і фагоцитарним індексом (r = 0,882; р < 0,01).
У дітей з БАЛПП виявлені антитіла IgG до Chlamуdophila pneumonia у 37,03 %, антигени Chlamуdоphila pneumonia — у 33,33 % хворих, у 44,4 % — антигени Mycoplasma pneumonia, у 23,45 % дітей — антигени Chlamуdophila pneumonia і Mycoplasma pneumonia.
Виявлено позитивну кореляцію між титром антитіл ІgG до Chlamуdophila pneumonia і вмістом СD4+-клітин (r = 0,735; р < 0,01), кількістю СD8+-супресорів/цитотоксичних (r = 0,473; р < 0,05), концентрацією сироваткового ІgG (r = 0,648; р < 0,05), концентрацією ІgА (r = 0,531; р < 0,05), концентрацією ІgМ (r = 0,499; р < 0,05). Ці дані підтверджують положення про те, що атипові збудники призводять до зниження клітинної та гуморальної ланки імунітету, що відмічають також О.Е. Чернишова, Є.І. Юліш.
При обстеженні хворих на бронхіальну астму середньотяжкого персистуючого перебігу нами відмічено вірогідне зниження кількості СD3+-лімфоцитів у 94,7 %, СD4+-субпопуляції — 94,9 % та СD8+-клітин — у 98,5 % дітей порівняно з конт–ролем. Спостерігалося вірогідне зниження вмісту СD22+-лімфоцитів та фагоцитарної активності нейтрофілів порівняно з контролем (р < 0,001) (табл. 3).
Для хворих з БАСТПП характерним є також явище гіпоімуноглобулінемії — вірогідне зниження концентрації ІgG у 92,1 %, ІgА — у 97,3 %, ІgМ — у 73,6 % випадків відповідно (р < 0,001) (табл. 3).
Cпостерігалася позитивна кореляція між вмістом СD4+-клітин і концентрацією сироваткового ІgG (r = 0,546; р < 0,05), кількістю СD4+-лімфоцитів і концентрацією ІgА (r = 0,582; р < 0,05), вмістом СD4+-лімфоцитів і концентрацією ІgМ (r = 0,532; р < 0,05).
У дітей з БАСТПП спостерігалося вірогідне підвищення рівня загального ІgЕ у 7 разів та зниження концентрації sІgА у 2 рази порівняно з контрольною групою (р < 0,001) (табл. 3), що свідчить про сенсибілізацію організму та зниження захисту слизових. Спостерігалося вірогідне підвищення рівня ІЛ-4 у 3,5 раза (р < 0,02), рівня ІЛ-1β — до 11,9 ± 0,29 пг/мл порівняно з контролем (р < 0,001) (табл. 4) та фагоцитарного індексу до 51,03 ± 0,50 (р < 0,01), що вказує на вираженість запального процесу та напруження неспецифічних протиінфекційних факторів захисту.
Характерною була позитивна кореляція між рівнем ІЛ-4 і вмістом СD4+-клітин (r = 0,687; р < 0,05), рівнем ІЛ-4 і вмістом СD8+-лімфоцитів (r = 0,370; р < 0,05), рівнем ІЛ-4 і концентрацією ІgА (r = 0,641; р < 0,05), рівнем ІЛ-4 і концентрацією ІgЕ (r = 0,499; р < 0,05), рівнем ІЛ-1β і субпопуляцією СD4+-клітин (r = 0,897; p < 0,01), рівнем ІЛ-1β і кількістю СD22+-лімфоцитів (r = 0,746; р < 0,01), вмістом ІЛ-1β і фагоцитарним індексом (r = 0,825; р < 0,01), що вказує на те, що протизапальний цитокін у відповідь на запальні стимули підвищує захисні якості організму, стимулюючи клітинну, гуморальну та місцеву ланки імунітету, і призводить до активації Тh2-хелперів.
У 45,83 % хворих з БАСТПП виялені антитіла IgG до Chlamуdophila pneumonia, у 27,08 % — антигени Chlamуdophila pneumonia, у 52 % — антигени Mycoplasma pneumonia, у 27 % — антигени Chlamуdophila pneumonia і Mycoplasma pneumonia. Нами визначено негативну кореляцію між титром антитіл ІgG до Chlamуdophila pneumonia і вмістом СD4+-клітин (r = 0,612; р < 0,05), кількістю СD8+-лімфоцитів (r = 0,511; р < 0,05), концентрацією сироваткового ІgG (r = 0,496; р < 0,05), ІgА (r = 0,547; р < 0,05), ІgМ (r = 0,510; р < 0,05).
Після комплексного лікування спостерігалось зникнення інтоксикаційного синдрому на 5–7-му добу лікування у 99,2; 98,6 та 97,3 % дітей з РОБ, БАЛПП та БАСТПП відповідно. Характерною була позитивна динаміка гепатолієнального синдрому на 7-му добу лікування у 98,6; 98,4 та 98,2 % обстежених з РОБ, БАЛПП та БАСТПП. Сухий нападоподібний кашель був відсутнім на 3–4-ту добу лікування у 99,6; 98,6 та 98, 2 % дітей з РОБ, БАЛПП та БАСТПП відповідно. Спостерігалась позитивна динаміка проліферативного синдрому у 99,6; 98,1 та 97,8 % хворих з РОБ, БАЛПП та БАСТПП.
Після проведеного комплексного лікування РОБ, БАЛПП, БАСТПП у цих групах спостерігалось вірогідне підвищення показників клітинної ланки імунітету СD3-лімфоцитів, СD4-субпопуляції, СD8-клітин, СD22-лімфоцитів (р < 0,001), і фагоцитарна активність нейтрофілів у даних групах вірогідно підвищилась (р < 0,01), що вказує на посилення неспецифічного протиінфекційного захисту (табл. 1, 3). Після лікування в трьох групах відмічено вірогідне підвищення концентрації ІgG, ІgА, ІgМ (р < 0,001), що вказує на нормалізацію гуморальної ланки імунітету в дітей з РОБ, БАЛПП та БАСТПП (табл. 1, 3). Характерним було вірогідне зниження вмісту ІЛ-4, ІЛ-1β майже до норми (р < 0,001), що вказує на значне зменшення запального процесу у хворих із РОБ, БАЛПП та БАСТПП (табл. 3, 4). Спостерігалося зниження рівня загального IgE до рівня контролю, а концентрація sIgA збільшилась у 4; 3,5; 3,0 раза в обстежених із РОБ, БАЛПП, БАСТПП відповідно.
Серопозитивні діти були обстежені через 1 місяць після лікування на наявність антитіл IgG до хламідій та антигенів до хламідій і мікоплазми. Результати були негативними.
Висновки
1. У дітей з бронхообструктивним синдромом виявлена висока інфікованість атиповими збудниками (хламідії, мікоплазма). У 71,24 % хворих з РОБ, 70,36 % хворих із БАЛПП, 72,91 % дітей із БАСТПП діагностована хламідійна інфекція; у 20,8 % дітей з РОБ, 44,4 % дітей із БАЛПП, 52 % хворих із БАСТПП — мікоплазменна інфекція.
2. Комплексне лікування бронхообструктивного синдрому, викликаного атиповими збудниками, сприяло вірогідному відновленню вмісту СD3+-лімфоцитів, СD4+-клітин, субпопуляції СD8+-клітин, СD22+-лімфоцитів та підвищенню рівня сироваткових імуноглобулінів ІgG, IgA, IgM у дітей.
3. Дітям з бронхообструктивним синдромом, у яких виявлена інфікованість атиповими збудниками, необхідно на додаток до базисної терапії призначати макроліди, пробіотики та імуномодулятори.
4. Після проведеного курсу лікуванння відмічено стійку ремісію протягом року у хворих із бронхообструктивним синдромом.

/110.jpg)
/109.jpg)
/111.jpg)