Журнал «Здоровье ребенка» 7 (67) 2015
Вернуться к номеру
Активированные азотсодержащие метаболиты организма человека при заболеваниях органов дыхания. Генераторы и генерация (часть 2-я)
Авторы: Абатуров А.Е. - ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»; Волосовец А.П. - Национальный медицинский университет им. А.А. Богомольца, г. Киев; Борисова Т.П. - ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
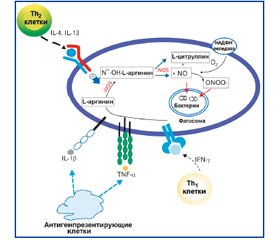
В обзоре литературы изложены современные данные об индукции и ингибиции синтеза монооксида азота (NO) при заболеваниях органов дыхания. Детально рассмотрены индукция генерации NO цитокинами, регуляция генерации NO Th1- и Th2-лимфоцитами. Представлены сигнальные пути основных индукторов индуцибельной или макрофагальной нитрооксидсинтазы (iNOS), а также факторы транскрипции, участвующие в регуляции активности гена iNOS. Показаны особенности продукции NO в зависимости от локальных условий.
В огляді літератури викладені сучасні дані щодо індукції та інгібіції синтезу монооксиду азоту (NO) при захворюваннях органів дихання. Детально розглянуті індукція генерації NO цитокінами, регуляція генерації NO Th1- та Th2-лімфоцитами. Представлені сигнальні шляхи основних індукторів індуцибельної або макрофагальної нітрооксидсинтази (iNOS), а також фактори транскрипції, що беруть участь у регуляції активності гена iNOS. Показані особливості продукції NO залежно від локальних умов.
This literature review presents current data about the induction and inhibition of the synthesis of nitric oxide (NO) in respiratory diseases. We have discussed in detail the induction of NO generation by cytokines, the regulation of NO generation by Th1- and Th2-lymphocytes. The signal pathways of the main inducers of the inducible or macrophage nitric oxide synthase (iNOS), as well as transcription factors involved in the regulation of iNOS gene activity were shown. The features of NO production were presented depending on local conditions.
активированные азотсодержащие метаболиты, легкие.
активовані азотумісні метаболіти, легені.
activated nitrogen-containing metabolites, lungs.
Статья опубликована на с. 127-131
Введение
Индукция синтеза монооксида азота
/128.jpg)
Ингибиция синтеза монооксида азота
Синтез монооксида азота
1. Ванин А.Ф. NO в биологии: история, состояние и перспективы исследований // Биохимия. — 1998. — T. 63, вып. 7. — C. 867-869.
2. Alderton W.K. Nitric oxide synthases: structure, function and inhibition / W.K. Alderton, C.E. Cooper, R.G. Knowles // Biochem. J. — 2001. — Vol. 357. — P. 593-615. PMID: 11463332.
3. Bogdan C. Nitric oxide and the immune response // Nat. Immunol. — 2001. — Vol. 2, № 10. — P. 907-916. PMID: 11577346.
4. Comhair S.A. Redox control of asthma: molecular mechanisms and therapeutic opportunities / S.A. Comhair, S.C. Erzurum // Antioxid. Redox Signal. — 2010. — Vol. 12, № 1. — P. 93-124. doi: 10.1089/ARS.2008.2425.
5. Daff S. NO synthase: structures and mechanisms// Nitric Oxide. — 2010. — Vol. 23, № 1. — P. 1-11. doi: 10.1016/j.niox.2010.03.001. Epub 2010 Mar 18.
6. Epidermal growth factor and interleukin-1 synergistically stimulate the production of nitric oxide in rat intestinal epithelial cells / K. Kitagawa, Y. Hamada, Y. Kato et al. // Am. J. Physiol. Gastrointest. Liver Physiol. — 2004. — Vol. 287. — P. G1188-G1193. PMID: 15271652
7. Epithelial inducible nitric-oxide synthase is an apical EBP50-binding protein that directs vectorial nitric oxide output / Glynne P.A., Darling K.E., Picot J., Evans T.J. // J. Biol. Chem. — 2002. — Vol. 277. — P. 33132-33138. PMID: 12080081
8. Förstermann U. Endothelial nitric oxide synthase in vascular disease: from marvel to menace / U. Förstermann, T. Münzel // Circulation. — 2006. — Vol. 113, № 13. — P. 1708-1714. doi:10.1161/CIRCULATIONAHA.105.602532.
9. Goodrum K.J. Cytokine Responses to Group B Streptococci Induce Nitric Oxide Production in Respiratory Epithelial Cells / K.J. Goodrum, J. Poulson-Dunlap // Infect Immun. — 2002 Jan. — 70 (1). — P. 49-54. doi: 10.1128/IAI.70.1.49-54.2002.
10. Krajewska W.M. Caveolins: structure and function in signal Transduction / W.M. Krajewska, I. Masłowska // Cell. Mol. Biol. Lett. — 2004. — Vol. 9. — P. 195-220. PMID: 15213803.
11. Kwon S. Synergistic cytokine-induced nitric oxide production in human alveolar epithelial cells / S. Kwon, S.C. George // Nitric. Oxide. — 1999. — Vol. 3. — P. 348-357. PMID:10444374.
12. Liu J. Exhaled breath condensate as a method of sampling airway nitric oxide and other markers of inflammation / J. Liu, P.S. Thomas // Med. Sci. Monit. — 2005. — Vol. 11, № 8. — P. MT53-MT62. PMID:16049390.
13. Lipopolysaccharide and interferon-gamma-induced nitric oxi–de production and protein oxidation in mouse peritoneal macrophages are affected by glutathione peroxidase-1 gene knockout / Fu Y., McCormick C.C., Roneker C., Lei X.G. // Free Radic. Biol. Med. — 2001. — Vol. 31. — P. 450-459. PMID:11498278
14. MacMicking J. Nitric oxide and macrophage function / MacMicking J., Xie Q.W., Nathan C. // Annu. Rev. Immunol. — 1997. — Vol. 15. — P. 323-350. PMID:9143691.
15. Mechanisms of nitric oxide synthesis and action in cells / Arzumanian V., Stankevičius E., Laukevičienė A., Kėvelaitis E. // Medicina. — 2003. — Vol. 39, № 6. — P. 535-541. PMID: 12829875.
16. Mühl H. Inducible NO synthase and antibacterial host defence in times of Th17/Th22/T22 immunity / Mühl H., Bachmann M., Pfeilschifter J. // Cell. Microbiol. — 2011. — Vol. 13, № 3. — P. 340-348. doi: 10.1111/j.1462-5822.2010.01559.x. Epub 2010 Dec 28.
17. Nitric Oxide in Health and Disease of the Respiratory System / Ricciardolo F.L.M., Sterk P.J., Gaston B., Folkerts G. // Physiol. Rev. — 2004. — Vol. 84, № 3. — P. 731-765. doi: 10.1152/physrev.00034.2003.
18. Nitric oxide synthase localization in the rat neutrophils: immunocytochemical, molecular, and biochemical studies / R. Saini, S. Patel, R. Saluja et al. // J. Leukocyte Biol. — 2006. — Vol. 79. — P. 519-528. PMID:16387842.
19. Oxidation of nitric oxide by oxomanganese-salen complexes: a new mechanism for cellular protection by superoxide dismutase/catalase mimetics / Sharpe M.A., Ollosson R., Stewart V.C., Clark J.B. // Biochem. J. — 2002. — Vol. 366. — P. 97-107. PMID:11994046.
20. Protein-protein interactions involving inducible nitric oxide synthase / W. Zhang, T. Kuncewicz, Z.Y. Yu et al. // Acta Physiol. Scand. — 2003. — Vol. 179. — P. 137-142. PMID:14510776.
21. Protein interactions with nitric oxide synthases: controlling the right time, the right place, and the right amount of nitric oxide / Kone B.C., Kuncewicz T., Zhang W., Yu Z.-Y. // Am. J. Physiol. Renal Physiol. — 2003. — Vol. 285. — P. F178-F190. doi: 10.1152/ajprenal.00048.2003.
22. Rao K.M.K. Molecular mechanisms regulating iNOS expression in various cell types // J. Toxicol. Environ Health B Crit. Rev. — 2000 Jan-Mar. — 3 (1). — P. 27-58. doi: 10.1080/109374000281131.
23. Ricciardolo F.L.M. Multiple roles of nitric oxide in the airways // Thorax. — 2003. — Vol. 58. — P. 175-182. doi: 10.1136/thorax.58.2.175.
24. Saha R.N. Regulation of inducible nitric oxide synthase gene in glial cells / R.N. Saha, K. Pahan // Antioxid. Redox. Signal. — 2006. — Vol. 8, № 5-6. — P. 929-947. PMID:16771683.
25. Specific association of nitric oxide synthase-2 with Rac isoforms in activated murine macrophages / Kuncewicz T., Balakrishnan P., Snuggs M.B., Kone B.C. // Am. J. Physiol. Renal Physiol. — 2001. — Vol. 281. — P. F326-F336. PMID: 11457725.
26. Transcriptional and post-transcriptional regulation of iNOS expression in human chondrocytes / N. Schmidt, A. Pautz, J. Art et al. // Biochem. Pharmacol. — 2010. — Vol. 79, № 5. — P. 722-732. doi: 10.1016/j.bcp.2009.10.012. Epub 2009 Oct 23.
27. The role of nitric oxide in inflammatory reactions / Tripathi Pl., Tripathi P., Kashyap L., Singh V. // FEMS Immunol Med Microbiol. — 2007 Dec. — 51 (3). — P. 443-452. doi: http://dx.doi.org/10.1111/j.1574-695X.2007.00329.x .
28. Ubiquitination of inducible nitric oxide synthase is required for its degradation / Kolodziejski P.J., Musial A., Koo J.S, Eissa N.T. // Proc. Natl. Acad. Sci. USA. — 2002. — Vol. 99. — P. 12315-12320. PMID:12221289.
29. Van der Vliet A. Nitric oxide: a pro-inflammatory mediator in lung disease? / Van der Vliet A., Eiserich J.P., Cross C.E. // Respirat. Res. — 2000. — Vol. 1. — P. 67-72. PMID:11667967.
30. Yang C.S. The role of nitric oxide in mycobacterial infections / Yang C.S., Yuk J.M., Jo E.K. // Immune Netw. — 2009. — Vol. 9, № 2. — P. 46-52.

/128_2.jpg)
/129_2.jpg)
/129.jpg)
/130.jpg)