Журнал "Гастроэнтерология" 4 (58) 2015
Вернуться к номеру
Сравнительное исследование эффективности препарата Прогепар у пациентов с неалкогольным стеатогепатитом
Авторы: Передерий В.Г., Сизенко А.К. - Национальный медицинский университет им. А.А. Богомольца, г. Киев
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Неалкогольная жировая болезнь печени (НАЖБП) является одним из самых распространенных заболеваний печени в развитых странах. В среднем ее частота достигает 20 %. У части пациентов НАЖБП протекает с наличием воспаления, вакуолизации гепатоцитов и последующим развитием фиброза и цирроза. Такой вариант течения НАЖБП называют неалкогольным стеатогепатитом (НАСГ). Пациенты с НАСГ подвержены более высокому риску развития осложнений, например возникновению гепатоцеллюлярной карциномы или варикозного расширения вен пищевода. Специфическая терапия НАСГ на сегодняшний день еще не разработана. Основные рекомендации для пациентов заключаются в изменении стиля жизни, что имеет определенную эффективность в снижении уровня стеатоза и активности воспаления. Однако быстро прогрессирующее течение НАСГ не всегда возможно контролировать одним только снижением калорийности диеты и увеличением уровня физической активности. Для лечения пациентов с НАСГ также используется неспецифическая терапия, которая способна замедлять прогрессирование заболевания и снижать уровень воспаления. Так как основным механизмом патогенеза НАСГ является оксидативный стресс, исследователи активно изучают действие различных антиоксидантов и их комбинаций. На сегодняшний день представлено большое количество результатов исследований подобных препаратов. Существенным ограничением большой части данных исследований является отсутствие тщательного мониторинга комплайенса и длительности выполнения пациентами рекомендаций по изменению образа жизни. Ведь в данной ситуации особый интерес должны представлять именно те пациенты, у которых высокая степень активности НАСГ сохраняется, несмотря на строгую приверженность к рекомендациям по изменению стиля жизни. В связи с этим требуется проведение дополнительных исследований по оценке эффективности фармакологической терапии у пациентов с НАСГ на фоне длительного изменения образа жизни. В этой статье мы приведем описание и результаты одноцентрового контролируемого исследования по оценке эффективности препарата Прогепар у пациентов с НАСГ с персистенцией активности воспалительного процесса на фоне модификации образа жизни.
Неалкогольна жирова хвороба печінки (НАЖХП) є одним із найпоширеніших захворювань печінки в розвинених країнах. У середньому частота даної патології досягає 20 %. У частини пацієнтів перебіг НАЖХП асоціюється з наявністю запалення, вакуолізації гепатоцитів і подальшим розвитком фіброзу та цирозу. Такий варіант перебігу НАЖХП називають неалкогольним стеатогепатитом (НАСГ). Пацієнти з НАСГ мають більш високий ризик ускладнень, наприклад розвитку гепатоцелюлярної карциноми або варикозного розширення вен стравоходу. На сьогодні не існує специфічної терапії НАСГ. Основні рекомендації полягають у модифікації стилю життя, що має певну ефективність у зниженні рівня стеатозу та активності запалення. Однак швидкий прогресуючий перебіг НАСГ не завжди можливо контролювати одним тільки зниженням калорійності дієти та збільшенням рівня фізичної активності. Для лікування пацієнтів із НАСГ також використовується неспецифічна терапія, що здатна сповільнювати прогресування захворювання і знижувати рівень його активності. З огляду на те, що основним механізмом патогенезу НАСГ є оксидативний стрес, дослідники активно вивчають дію різних антиоксидантів та їх комбінацій. На сьогодні представлена значна кількість досліджень подібних препаратів. Істотним обмеженням значної частини даних досліджень є відсутність ретельного моніторингу комплайєнсу та тривалості дотримання пацієнтами рекомендацій щодо зміни способу життя. Адже в даній ситуації особливий інтерес повин-ні становити саме ті пацієнти, у яких зберігається високий ступінь активності НАСГ, незважаючи на суворе дотримання немедикаментозних рекомендацій. У зв’язку з цим необхідне проведення додаткових досліджень з оцінки ефективності фармакологічної терапії в пацієнтів із НАСГ на тлі тривалої зміни способу життя. У цій статті ми наведемо опис і результати одноцентрового контрольованого дослідження з оцінки ефективності препарату Прогепар у пацієнтів із НАСГ із персистенцією активності запального процесу на фоні модифікації способу життя.
Non-alcoholic fatty liver disease is one of the most common pathologies of the liver in developed countries. On the average, its prevalence reaches 20 %. In some patients, non-alcoholic fatty liver disease occurs with inflammation, vacuolization of hepatocytes and subsequent development of fibrosis and cirrhosis. This type of non-alcoholic fatty liver disease is called non-alcoholic steatohepatitis. Patients with non-alcoholic steatohepatitis are at higher risk of complications, for example, hepatocellular carcinoma or varicose veins of the esophagus. Specific therapy for non-alcoholic steatohepatitis has not been yet developed. The main recommendations for patients are lifestyle changes that have some effectiveness in reducing steatosis and inflammation activity. However, rapid progressive course of non-alcoholic steatohepatitis is not always possible to be controlled only by low calorie diet and increased physical activity. For the treatment of patients with non-alcoholic steatohepatitis, we can also use a non-specific therapy that can slow disease progression and reduce inflammation. Since the main mechanism of pathogenesis in non-alcoholic steatohepatitis is oxidative stress, researchers are actively investigating the effect of different antioxidants and their combinations. Today there is a large number of studies of these drugs. There are significant limitations of a large part of these studies: the lack of thorough monitoring of compliance and duration of lifestyle modification. Indeed, in this situation particular interest must be provided for those patients with a high activity of non-alcoholic steatohepatitis that persists despite strict adherence to the recommendations in lifestyle changes. Additional research required to assess the effectiveness of pharmacological therapy in patients with non-alcoholic steatohepatitis with long-term lifestyle changes. In this article, we will present a description and results of single-centre controlled trial to assess the effectiveness of Prohepar in patients with non-alcoholic steatohepatitis with persistent inflammatory activity on the background of adequate modification of lifestyle.
неалкогольная жировая болезнь печени, неалкогольный стеатогепатит, модификация образа жизни, комбинированный препарат гидролизата печени, монопрепарат гидролизата печени, Прогепар.
неалкогольна жирова хвороба печінки, неалкогольний стеатогепатит, модифікація способу життя, комбінований препарат гідролізату печінки, Прогепар.
non-alcoholic fatty liver disease, non-alcoholic steatohepatitis, lifestyle modification, liver hydrolysate combined drug, Progepar.
Статья опубликована на с. 55-61
Введение
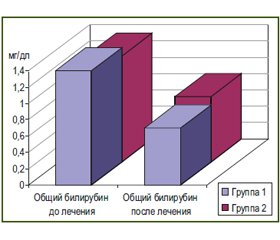
Материалы и методы
/58.jpg)
Обсуждение
1. Vernon G., Baranova A., Younossi Z.M. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults // Aliment. Pharmacol. Ther. — 2011. — 34. — 274-285.
2. Ong J.P., Younossi Z.M. Epidemiology and natural history of NAFLD and NASH // Clin. Liver Dis. — 2007. — 11. — 1-16, vii.
3. Leite N.C., Salles G.F., Araujo A.L., Villela-Nogueira C.A., Cardoso C.R. Prevalence and associated factors of non-alcoholic fatty liver disease in patients with type-2 diabetes mellitus // Liver Int. — 2009. — 29. — 113-119.
4. Assy N., Kaita K., Mymin D., Levy C., Rosser B., Minuk G. Fatty infiltration of liver in hyperlipidemic patients // Dig. Dis. Sci. — 2000. — 45. — 1929-1934.
5. Chalasani N., Younossi Z., Lavine J.E., Diehl A.M., Brunt E.M., Cusi K., Charlton M., Sanyal A.J. The diagnosis and management of non-alcoholic fatty liver disease: practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association // Hepatology. — 2012. — 55. — 2005-2023.
6. Musso G., Gambino R., Cassader M., Pagano G. Meta-ana–lysis: natural history of non-alcoholic fatty liver disease (NAFLD) and diagnostic accuracy of non-invasive tests for liver disease severity // Ann. Med. — 2011. — 43. — 617-649.
7. Dam-Larsen S., Franzmann M., Andersen I.B., Christoffersen P., Jensen L.B., Sørensen T.I., Becker U., Bendtsen F. Long term prognosis of fatty liver: risk of chronic liver disease and death // Gut. — 2004. — 53. — 750-755.
8. Dam-Larsen S., Becker U., Franzmann M.B., Larsen K., Christoffersen P., Bendtsen F. Final results of a long-term, clinical follow-up in fatty liver patients // Scand. J. Gastroenterol. — 2009. — 44. — 1236-1243.
9. Adams L.A., Lymp J.F., St Sauver J., Sanderson S.O., Lindor K.D., Feldstein A., Angulo P. The natural history of nonalcoholic fatty liver disease: a population-based cohort study // Gastroenterology. — 2005. — 1, 129. — 113-21.
10. Matteoni C.A., Younossi Z.M., Gramlich T., Boparai N., Liu Y.C., McCullough A.J. Nonalcoholic fatty liver disease: a spectrum of clinical and pathological severity // Gastroenterology. — 1999 Jun. — 116(6). — 1413-9.
11. Dam-Larsen S., Franzmann M., Andersen I.B., Christoffersen P., Jensen L.B., Sørensen T.I., Becker U., Bendtsen F. Long term prognosis of fatty liver: risk of chronic liver disease and death // Gut. — 2004 May. — 53(5). — 750-5.
12. Ekstedt M., Franzén L.E., Mathiesen U.L., Thorelius L., Holmqvist M., Bodemar G., Kechagias S. Long-term follow-up of patients with NAFLD and elevated liver enzymes // Hepatology. — 2006. — 44. — 865-73.
13. Dunn W., Xu R., Wingard D., Rogers C., Angulo P., Younossi Z.M., Schwimmer J.B. Suspected Nonalcoholic Fatty Liver Disease and Mortality Risk in a Population-based Cohort Study // Am. J. of Gastroenterology. — 2008. — 103. — 2263-71.
14. Rafiq N., Bai C.B., Fang Y., Srishord M., McCullough A., Gramlich T., Younossi Z.M. Long-Term Follow-Up of Patients with Non-Alcoholic Fatty Live // Clinical Gastro and Hepatology. — 2009. — 7. — 234-8.
15. Dam-Larsen S., Becker U., Franzmann M.B., Larsen K., Christoffersen P., Bendtsen F. Final results of a long-term, clinical follow-up in fatty liver patients // Scand. J. Gastroenterol. — 2009. — 44(10). — 1236-43.
16. Stepanova M., Rafiq N., Younossi Z.M. Components of metabolic syndrome as independent predictors of mortality in chronic liver disease: A population-based study // Gut. — 2010. — 59(10). — 1410-5.
17. Soderberg C., Stal P., Askling J., Glaumann H., Lindberg G., Marmur J., Hultcrantz R. Decreased survival of subjects with elevated liver function tests during a 28-year follow-up // Hepa–tology. — 2010. — 51. — 595-602.
18. Sanyal A.J., Brunt E.M., Kleiner D.E., Kowdley D.E., Chalasani N., Lavine J.E., Ratziu V., McCullough A. End points and clinical trial design for nonalcoholic steatohepatitis // Hepato–logy. — 2011. — 54. — 344-353.
19. Gambino R., Cassader M., Pagano G. Meta-analysis: Natural history of non-alcoholic fatty liver disease (NAFLD) and diagnostic accuracy of non-invasive tests for liver disease severity // Annals of Medicine. — 2011. — 43(8). — 617-49.
20. Angulo P., Hui J.M., Marchesini G., Bugianesi E., George J., Farrell G.C., Enders F., Saksena S., Burt D.A. et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD // Hepatology. — 2007. — 45. — 846-854.
21. Andersen T., Gluud C., Franzmann M.B., Christoffersen P. Hepatic effects of dietary weight loss in morbidly obese subjects // J. Hepatol. — 1991. — 12. — 224-229.
22. Palmer M., Schaffner F. Effect of weight reduction on hepatic abnormalities in overweight patients // Gastroenterology. — 1990. — 99. — 1408-1413.
23. Park H.S., Kim M.W., Shin E.S. Effect of weight control on hepatic abnormalities in obese patients with fatty liver // J. Korean Med. Sci. — 1995. — 10. — 414-421.
24. Ueno T., Sugawara H., Sujaku K., Hashimoto O., Tsuji R., Tamaki S. et al. Therapeutic effects of restricted diet and exercise in obese patients with fatty liver // J. Hepatol. — 1997. — 27. — 103-107.
25. Kugelmas M., Hill D.B., Vivian B., Marsano L., McClain C.J. Cytokines and NASH: a pilot study of the effects of lifestyle modification and vitamin E // Hepatology. — 2003. — 38. — 413-419.
26. Sreenivasa Baba C.S., Alexander G., Kalyani B., Pandey R., Rastogi S., Pandey A. et al. Effect of exercise and dietary modification on serum aminotransferase levels in patients with nonalcoholic steatohepatitis // J. Gastroenterol. Hepatol. — 2006. — 21. — 191-198.
27. Hickman I.J., Jonsson J.R., Prins J.B., Ash S., Purdie D.M., Clouston A.D., Powell E.E. Modest weight loss and physical activity in overweight patients with chronic liver disease results in sustained improvements in alanine aminotransferase, fasting insulin, and quality of life // Gut. — 2004. — 53. — 413-419.
28. Suzuki A., Lindor K., Saver J., Lymp J., Mendes F., Muto A., Okada T. et al. Effect of changes on body weight and lifestyle in nonalcoholic fatty liver disease // J. Hepatol. — 2005. — 43. — 1060-1066.
29. Hasegawa T. et al. Plasma transforming growth factor-beta1 level and efficacy of alpha-tocopherol in patients with nonalcoholic steatohepatitis: a pilot study // Aliment. Pharmacol. Ther. — 2001. — 15. — 1667-1672.
30. Harrison S.A. et al. Vitamin E and vitamin C treatment improves fi- brosis is patients with nonalcoholic steatohepatitis // Am. J. Gastroenterol. — 2003. — 98. — 2485-2490.
31. Dufour J.F. et al. Swiss Association for the Study of the Liver. Randomized placebo-controlled trial of ursodeoxycholic acid with vitamin E in nonalcoholic steatohepatitis // Clin. Gastroenterol. Hepatol. — 2006. — 4. — 1537-1543.
32. Sanyal A.J. et al. A pilot study of vitamin E versus vitamin E and pioglitazone for the treatment of nonalcoholic steatohepatitis // Clin. Gastroenterol. Hepatol. — 2004. — 2. — 1107-1115.
33. Yakaryilamz F. et al. Effects of vitamin E treatment on peroxisome proliferator-activated receptor-alpha expression and insulin resistance in patients with non-alcoholic steatohepatitis, results of a pilot study // Intern. Med. J. — 2007. — 37. — 229-235.

/59.jpg)