Статтю опубліковано на с. 113-121
/113.jpg)
Актуальність захворювань верхнього відділу травного тракту не зменшується з часом, незважаючи на появу нових методів і методик діагностики цього важкодоступного відділу шлунково-кишкового тракту. Інвазивність методів, необхідних для повноцінної діагностики, дещо обмежує діагностичні можливості лікарів, але й до сьогодні вони залишаються єдиними, що здатні надати повноцінну інформацію про стан слизової оболонки верхнього відділу шлунково-кишкового тракту. У сучасній гастроентерології на сьогодні існує тенденція до обмеження призначення ендоскопічного дослідження пацієнтам, які звертаються до лікарів загальної практики з диспептичними симптомами. Розроблені діагностичні критерії, так звані червоні прапорці, для визначення груп пацієнтів, яким таке дослідження проводиться терміново, в інших випадках пропонують додаткові індикації причин виникнення диспепсії. На нашу думку, такий підхід не є правильним, оскільки не можна не враховувати необхідність своєчасної діагностики гастриту. Ще важливішою є повноцінна діагностика тяжких його форм, оскільки відомо, що тривалий перебіг цього захворювання призводить до прогресування і, згідно з відомою концепцією P. Correa, східчастим шляхом веде до розвитку канцерозних змін слизової оболонки шлунка (рис. 1). Концепцію запропоновано у 1975 році, з подальшим переглядом та доопрацюванням у 1988 та 1992 рр., і базується вона на постулаті, що інтестинальний тип раку шлунка є результатом прогресуючих змін слизової оболонки шлунка, починаючи від хронічного гастриту, через мультифокальний атрофічний гастрит та інтестинальну метаплазію (ІМ) [1].
/114.jpg)
Низка досліджень показує, що атрофічний гастрит виявляють у 5–30 % пацієнтів, інфікованих H.pylori, а інтестинальну метаплазію — у близько 45 % інфікованих H.pylori, що значно більше, ніж у неінфікованих осіб — 5–10 %. Проте слід зазначити, що на етапах розвитку кишкової метаплазії позитивність уреазного тесту помітно та вірогідно зменшується залежно від ступеня її тяжкості [2]. Частота виявлення дисплазії в західній популяції становить 0,5–4 % з ризиком розвитку карциноми від 9 до 20 %. У цілому ризик розвитку карциноми шлунка протягом 10 років при інтестинальній метаплазії сягає 10 %, при дисплазії — 73 % [3, 4]. Численні дослідження підтверджують, що зі збільшенням ступеня атрофії слизової оболонки шлунка зростає ризик розвитку раку шлунка [5, 6]. Довготривале когортне дослідження у Швеції продемонструвало, що протягом 20 років рак шлунка буде розвиватися в однієї з 256 осіб з незміненою слизовою оболонкою, в 1 з 85 хворих із гастритом, в 1 з 50 — з атрофічним гастритом, в 1 з 39 осіб з інтестинальною метаплазією та в 1 з 19 хворих зі дисплазією. При цьому автори дослідження наголошують, що виявлені при повторній біопсії зміни в каскаді Correa у напрямку вгору або, що більш важливо, донизу мають прогностичне значення для розвитку більш тяжких змін у слизовій оболонці шлунка [7].
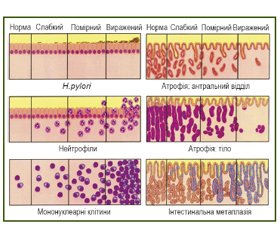
У 1990 році на Всесвітньому конгресі гастроентерологів у м. Сіднеї (Австралія) на підставі існуючих етіологічних чинників гастриту була запропонована нова класифікація. Було наголошено на важливості об’єднання топографічної, морфологічної й етіологічної інформації в єдину схему, що дало можливість формулювання повноцінного діагнозу. Гістологічні аспекти Сіднейської системи призначені для практичного користування, при якому біопсійні дослідження та результати гістологічного дослідження можуть бути задокументованими. Також у Сіднейській системі запропоновано чотири шкали для визначення ступеня тяжкості патоморфологічних змін. На думку М. Stolte, вивчення параметрів дифузного гастриту за щільністю інфільтрації власної пластинки нейтрофільними лейкоцитами й плазмоцитами є доцільним у зв’язку з їх варіабельністю. Недоліками поданої системи вважали невизначеність таких станів, як мультифокальний атрофічний гастрит та дифузний антральний гастрит. Також проблематичною є класифікація кишкової метаплазії, оскільки навіть взяття чотирьох біоптатів за Сіднейською системою пов’язане з можливістю помилки вибірки [5]. Для подальшої адаптації Сіднейської системи через 4 роки після введення вона була переглянута в Х’юстоні, штаті Техас, США, у вересні 1994 року. У цілому принципи й сама Сіднейська класифікація були змінені незначно, вони були доповнені розробленою візуально-аналоговою шкалою для визначення атрофічних та метапластичних змін слизової оболонки шлунка. Внесені деякі термінологічні зміни для більш чіткого розмежування атрофічних і неатрофічних змін слизової шлунка, уточнені діагностичні критерії (рис. 2). Проведена корекція методики дослідження, доповнена взяттям біоптату з кута шлунка (рис. 3).
/115.jpg)
Така корекція методики дослідження була визнана необхідною, оскільки максимальний ступінь атрофії та інтестинальної метаплазії найчастіше виявляють саме в цій ділянці шлунка. Цей підхід дозволив покращити діагностику передракових станів та мультифокального гастриту. Окрім того, оновлена система виділяє дві форми гастриту: неатрофічний і атрофічний, останній може бути автоімунним (з ураженням тіла шлунка) і мультифокальним. При оцінці гістологічних особливостей гастриту враховується топографічна картина ураження (переважають зміни в тілі або антральному відділі), а для прикінцевої діагностики гастриту — й етіологічні компоненти діагнозу [6, 8].
При подальшому обговоренні термінології хронічного гастриту було наголошено на особливостях перебігу атрофічного гастриту, оскільки втрата відповідних залоз відбувається різними шляхами. Так, різне функціональне значення має втрата залоз в антральному відділі й тілі шлунка, крім того, залишаються невивченими співвідношення між атрофією й інтестинальною метаплазією, топографічні особливості їх розвитку. Враховуючи наявність таких питань, міжнародна група гастроентерологів розробила покращену гістологічну систему визначення стадії атрофії шлунка OLGA (Operative Link on Gastritis Assessment) [9, 10]. Стадія атрофічного гастриту встановлюється шляхом оцінки біоптатів за ступеневою системою (табл. 1).
/115_2.jpg)
Тяжкість атрофії визначається за бальною шкалою — від 0 до 3. Ступінь атрофії розраховується за комбінацією балів атрофії в тілі та антральному відділі шлунка. Наступні дослідження показали, що такий підхід надає можливість передати в повному обсязі інформацію щодо клініко-патологічних наслідків гастриту та визначити групи пацієнтів, які підлягають більш пильному контролю для запобігання негативним наслідкам прогресування цього стану. Так, 12-річне дослідження групи пацієнтів показало, що система OLGA надійно відокремлює групи ризику розвитку неоплазії в майбутньому [11]. Так, пацієнтів із низьким рівнем атрофії за системою OLGA можна впевнено виключити з подальшого нагляду, у той час як пацієнти з більш високим рівнем атрофії (стадія III і IV) потребують ретельного ендоскопічного нагляду. Подальшим прогресивним кроком в оцінці ступеня тяжкості патологічних змін у слизовій оболонці шлунка стала система OLGIM (Operative Link on Gastric Intestinal Metaplasia Assessment), представлена L. Capelle зі співавт. у 2010 році [12]. Вона базується на системі OLGA, але із заміною визначення атрофії оцінкою кишкової метаплазії (табл. 2).
Кишкова метаплазія визначається як заміна стовпчастих клітин шлунка клітинами кишечника, що характеризуються високим вмістом муцину. Такі клітини легко відрізнити у слизовій оболонці, оскільки для неї вони не є типовими. Припущення, що діагностичний індекс, який визначається за допомогою системи OLGIM, вирішить завдання щодо визначення груп пацієнтів з високим ступенем ризику, які потребують ретельного нагляду, є виправданим, оскільки тяжкість і ступінь кишкової метаплазії — важливий предиктор ризику раку шлунка. Ризик аденокарциноми збільшується в 5 разів у хворих з інтестинальною метаплазією на ділянці малої кривизни тіла шлунка. Результати, що були отримані на невеликій групі пацієнтів (126 осіб), дозволили авторам дослідження дійти висновку, що кореляція між OLGIM і ризиком шлункового раку є більш високою. Більше того, запропонована система дисплазії більш надійна, ніж OLGA. Застосування системи OLGIM дозволить знизити захворюваність на рак шлунка у подальшому, забезпечивши лікарів надійним способом виявлення пацієнтів із передраковими станами. Такі дані стали підставою для проведення подальших досліджень та початку дискусії щодо визначення оптимальної системи для формування груп ризику виникнення неопластичних процесів. Так, M. Rugge зі співавт., переглянувши близько 4500 біоптатів, наголосив, що хоча в 67 (1,5 %) випадках, що відповідали високому ризику як за системою OLGA, так і за системою OLGIM, виявлені неопластичні зміни (р < 0,001 для обох), серед 243 результатів високого ризику за OLGA 14 (5,8 %) були визначені як низькі за системою OLGIM. Два випадки з 34 інтестинального раку шлунка відповідали високому ризику за системою OLGA, але низькому рівню градації за OLGIM. Зваживши на отримані дані, автор заперечив більшу чутливість системи OLGIM для визначення груп ризику порівняно з OLGA [13]. За результатами дослідження R. Marcos-Pinto зі співавт. показано, що застосування системи OLGIM для визначення груп ризику призвело до зниження його у 27,0 % випадків на етапі низького ризику, при більш високих стадіях різниця в ступені тяжкості становила 3 % на користь системи OLGA. Автори підкреслюють, що відносно виявлення дисплазії обидві запропоновані системи були адекватними й частота виявлення становила 86,0 % на стадії високого ризику. Утім навіть з огляду на зниження стадії тяжкості за системою OLGIM та зменшення кількості пацієнтів, які потребують подальшого нагляду, автори зазначають, що остання є більш простою для застосування [14]. Дослідження латвійських вчених 2014 року, що включало 835 пацієнтів, також продемонструвало необхідність комплексного застосування обох систем для визначення груп ризику пацієнтів із передраковими станами. Так, за системою OLGA у 280 обстежених (33,4 %) виявляли гастрит стадії I–II, а за системою OLGIM така стадія гастриту встановлена в 167 (19,9 %), стадія III–IV встановлена у 25 пацієнтів, тоді як за шкалою OLGIM — у 23. 15,8 % гастритів I стадії за системою OLGA відповідали 0 за системою OLGIM, стадії II у 22,6 % випадках відповідала стадія I. Окрім того, 5 % випадків стадії III за OLGA були розцінені як стадія II за OLGIM [15]. Корейські дослідники у своїй роботі, проведеній на підставі вивчення біоптатів 474 пацієнтів із раком шлунка, визначають, що стадії III–IV за системою OLGA більше асоціюються з інтестинальним типом раку шлунка, у той час як стадії гастриту I–IV за системою OLGIM вірогідно корелюють з підвищеним ризиком обох типів раку шлунка: інтестинального та дифузного [16]. Утім важливою є оцінка біоптатів з обов’язковим узяттям матеріалу з кута шлунка, оскільки без нього у 8 % випадків пропускається атрофічний гастрит та в 3 % випадків — кишкова метаплазія, а стадія тяжкості і, відповідно, рівень градації ризику значно зменшуються за обома системами [17]. На жаль, встановленням діагнозів атрофічного гастриту, кишкової метаплазії і навіть дисплазії часто нехтують у клінічній практиці. Широке застосування системи OLGA покращить ситуацію, але впровадження потребує й система OLGIM, тому що поєднання цих двох параметрів вдосконалює виявлення пацієнтів з високим ризиком розвитку раку шлунка. На сьогодні сучасна медицина може розраховувати й на розвиток ендоскопічних методів для визначення ступеня тяжкості гастритичних змін, особливо якщо брати до увагу можливості вузькосмугової ендоскопії з високою роздільною здатністю (NBI), що значно покращує можливості діагностики пренеопластичних змін порівняно зі звичайною ендоскопію в білому світлі. Так, чутливість і специфічність звичайної ендоскопії для визначення атрофії порівняно з гістологічним висновком є досить високою і становить 61,5 і 57,7 % відповідно для антрального відділу і 46,8 і 76,4 % відповідно для тіла шлунка, а для діагностики інтестинальної метаплазії частота правильної інтерпретації ендоскопічних змін значно нижча і становить 24,0 і 91,9 % для антрального відділу та 24,2 і 88,9 % для тіла шлунка [18]. Застосування NBI-ендоскопії значно збільшує шанси отримати вірогідну інформацію, особливо щодо інтестинальної метаплазії та дисплазії. Так, чутливість для виявлення метаплазії становить від 71,0 до 82,5 %, за даними різних авторів, а для дисплазії — близько 58,0 % [19, 20]. Як свідчать порівняльні дослідження японських дослідників, NBI-ендоскопія є альтернативою системам OLGA і OLGIM, що майже дорівнює їм за можливостями [21].
Результати обстеження 632 пацієнтів, опубліковані у 2014 році, дозволили з’ясувати, що кількість пацієнтів з високим ступенем гастриту за системою OLGA і OLGIM вірогідно збільшується з віком. Так, у хворих, старших за 40, 50 та 60 років, відношення шансів (OR) становить 5,17; 6,97 і 12,23 відповідно, у тих, хто палить, OR = 2,54; у Нp-позитивних пацієнтів OR = 8,46. У Нр-позитивних пацієнтів до 40 років частота високого рівня градації гастриту за системою OLGA була нижчою і становила 6,9 %, проте значно зростала з віком і становила 23,0; 29,1 і 41,1 % для 40-,50- і 60-річних осіб відповідно. За системою OLGIM зареєстроване подібне співвідношення: 2,8 % — до 40 років і 30,1 % — для осіб, старших за 60 років. У той же час у групі Нр-негативних обстежених тяжкі зміни шлунка зустрічались значно рідше й становили 10,3 і 3,4 % системами OLGA і OLGIM відповідно в осіб, старших за 60 років. Такі дані підтверджують припущення щодо доцільності раннього визначення Нр-статусу пацієнта для проведення ерадикаційної терапії [22]. Предикторами високого ступеня ризику раку шлунка можуть бути низький рівень сироваткового пепсиногену, сімейний анамнез раку шлунка, генетична варіабельність H.pylori. Патогенний потенціал Helicobacter pylori на слизовій оболонці шлунка реалізується шляхом запуску цілого каскаду механізмів, серед яких накопичення в слизової оболонці вільних радикалів, збільшення концентрації нітросполук, зменшення концентрації в шлунковому соку аскорбінової кислоти, збільшення проліферації епітеліальних клітин. Ушкодження ДНК зумовлене надмірною активацією нейтрофілів з розривом її ланцюга реактивними формами кисню та окису азоту. Усі ці зміни можуть призвести до змін у структурі ДНК клітин, стимулюючи мутагенез і канцерогенез [23]. Хоча інфекція H.pylori є досить поширеною, саме генетична детермінованість формування токсигенних штамів зумовлює наступний послідовний розвиток пренеопластичних змін у слизовій оболонці шлунка. Так, CagA, токсин бактерії, давно вже визнаний онкогенним білком. Саме з його мутагенним потенціалом пов’язані більшість передракових змін. Крім того, варіабельність у гені CagA модулює наслідки інфікування бактерією слизової оболонки та сприяє зсуву патологічних змін або в бік формування виразки та ерозивних змін, або в бік розвитку та прогресування атрофічних змін [24–27]. Окрім того, дослідження N. Almeida зі співавт. (148 інфікованих пацієнтів) показали, що наявність CagA корелює з високим ступенем інтестинальної метаплазії, підвищеною активністю нейтрофілів, хронічним запаленням та стадією гастриту за системою OLGIM [28]. Такі дані стали підставою для уточнення теорії каскаду Correa і формування нового ланцюга розвитку пренеопластичних змін у слизовій оболонці шлунка (рис. 4).
/117.jpg)
Особливості імунної відповіді людини, зокрема експресія Toll-like рецепторів, також можуть бути важливим ланцюгом у послідовності розвитку преканцерозних змін. Так, доведено, що Toll-like рецептори мають значення для розпізнавання й наступної вродженої та адаптивної відповіді імунітету. TLR2, TLR4, TLR9 і TLR5 синергічно діють в імунній відповіді проти інфекції H.рylori. Було показано, що інфікування шлунка Нelicobacter pylori збільшує експресію Toll-like рецепторів у слизовій оболонці шлунка, тоді як паралельно відбувається зниження експресії їх інгібіторів, таких як Toll-взаємодіючий білок (TOLLIP) і рецептори, що активуються пероксисомними проліфераторами (PPAR). Останні відіграють значну роль у регуляції клітинного диференціювання. Визначення рівня Toll-like рецепторів, можливо, при подальшому вивченні служитиме біомаркерами ризику розвитку раку шлунка на тлі персистування Helicobacter pylori [29]. Іншими дослідження показано, що антигени бактерії, зокрема уреаза, здатні пригнічувати функцію Т-клітин. Це доведено здатністю лізатів бактерії пригнічувати проліферацію лімфоцитів у периферичній крові. Цікавим є факт, що феномен дисфункції Т-клітин спостерігається також при раку шлунка. Токсин CagA є посередником у розвитку дисфункції Т-клітин. Деякі дослідження показують, що пригнічення функції Т-клітин відбувається за рахунок пригнічення CD3+-клітин. Лабораторні дослідження на мишах, дефіцитних за Т-клітинами або інтерфероном гамма, показали, що при їх інфікуванні гелікобактерною інфекцію розвитку гастриту не відбувається. Імунна відповідь за Th 1-го типу зумовлює розвиток гастритичних змін, тоді як лінії мишей, які мали імунну відповідь за Th 2-го типу, мали дієвий імунний захист. Підвищена експресія інтерферону гамма й прозапального цитокіну IL-6 у слизовій оболонці шлунка значною мірою пов’язана з наявністю бактерій і значно зменшується після їх усунення. Усі ці дані підтверджують важливу роль характеру імунної відповіді людини на персистування хелікобактерної інфекції на слизовій оболонці в розвитку подальших патологічних змін [30].
Усвідомлення Helicobacter pylori як етіологічного фактора кожної стадії розвитку преканцерозних змін дозволяє визначитися щодо профілактики таких змін шляхом усунення етіологічного фактора. Первинна та вторинна профілактика раку шлунка починається зі стратифікації ризиків розвитку раку з визначенням груп високого ризику розвитку раку шлунка, що підлягають ретельному ендоскопічному нагляду та ерадикації інфекційного агента [31]. Відомо, що визначеною є необхідність проведення ерадикаційної терапії в пацієнтів із сімейним анамнезом раку шлунка незалежно від фенотипу гастриту [5]. Численні дослідники наголошують, що в країнах із захворюваністю на рак шлунка, вищою за 20 випадків на 100 000 на рік, необхідне проведення національного скринінгу на Helicobacter pylori як єдиний можливий фактор канцерогенезу, що піддається модифікації. Така програма вже активно проводиться в Японії. Схема лікування залежить від регіональних особливостей рівня резистентності бактерії до антибіотиків, оскільки суттєвими проблемами сучасної ерадикаційної терапії є зростаюча резистентність Helicobacter pylori до базових препаратів, рекомендованих для її проведення [32]. Так, якщо на перших етапах розробки підходів до лікування вчені зіткнулися з високим рівнем резистентності до метронідазолу, то на сьогодні проблемою вже постає резистентність до кларитроміцину. Основною причиною її зростання й до сьогодні є неконтрольоване призначення антибіотиків, а в нашій країні, зокрема, і широке включення макролідів у терапію респіраторних інфекцій. Важливим є той факт, що залишається незмінною чутливість хелікобактерної інфекції до амоксициліну, резистентність до якого майже не реєструється. Увага вчених спрямована на пошук інших схем та способів уникнення резистентності для досягнення оптимального рівня ерадикації. Зростання рівня резистентності до кларитроміцину унеможливлює широке застосування потрійних схем як терапії першої лінії, що виводить схеми другої лінії, зокрема ті, що включають субцитрат вісмуту, на перший план [33]. Цитопротективний ефект солей вісмуту показаний у дослідженнях як при індометацин-асоційованих гастропатіях, так і при впливі алкоголю за рахунок властивостей стимулювати синтез простагландину Е2 та бікарбонатів слизовою оболонкою шлунка [34–36]. Антибактеріальний ефект солей вісмуту реалізується за рахунок зменшення здатності патогенних бактерій до інвазії в епітеліальні клітини [37, 38]. Здійснюється такий ефект за рахунок пригнічення синтезу білка й клітинної стінки, зниження функції мембран і порушення синтезу АТФ у бактеріях [39]. Зокрема, відома здатність колоїдного субцитрату вісмуту (Де-Нол) знижувати адгезію H.рylori до слизової оболонки шлунка за рахунок інгібування таких ферментів, що продукуються бактерією, як протеази, ліпази, глюкозидази та фосфорилази. Колоїдний субцитрат вісмуту (Де-Нол) має властивість збільшувати секрецію глікопротеїнів, що збільшує захисні властивості слизової оболонки шлунка, а також формувати захисний бар’єр від руйнівної дії надмірної секреції HCl, зв’язуючись зі слизовою оболонкою шлунка [40]. Монотерапія вісмутом ефективна в Hр-позитивних пацієнтів, але вчених не задовольняє рівень елімінації бактерії. Так, на початку ери ерадикації Helicobacter рylori застосовували схеми монотерапії лікування солями вісмуту, що показували рівень ерадикації 65–78 %, з вірогідним зменшенням поліморфноклітинної інфільтрації в слизовій оболонці. Низка авторів зазначають, що частота рецидивів інфекції в пацієнтів після лікування колоїдним субцитратом вісмуту (Де-Нол) була значно нижчою, ніж у групі контролю [41, 42]. Синергічність дії солей вісмуту й антибіотиків дозволила застосовувати перші у комбінаціях для проведення більш ефективної ерадикації [43, 44]. Окрім того, комбінація солей вісмуту з антибіотиками значно зменшує рівень рецидивів гелікобактерної інфекції [45]. Так, початкове 7-денне лікування на ґрунті квадротерапії із солями вісмуту, що включає метронідазол, амоксицилін і пантопразол, є досить ефективною комбінацією у регіонах з резистентністю до метронідазолу з рівнем ерадикації 82,5 % [46]. Квадротерапія з вісмутом, що включає пантопразол, тетрациклін і метронідазол, також має перевагу над потрійною терапію за даними турецьких дослідників [47]. Іранські дослідники висловлюються про ефективність квадротерапії з вісмутом, пантопразолом, амоксициліном та кларитроміцином як терапії другої лінії, що надає бажаний рівень ерадикації у випадку неефективності початкового лікування [48]. Інше дослідження показало високий рівень ерадикації (96,6 %) при застосуванні солей вісмуту в комбінації з левофлоксацином, декслансопразолом та кларитроміцином. Така схема може стати альтернативою першій лінії ерадикаційної терапії в Таїланді [49]. У рандомізованому клінічному дослідженні в Ірані порівнювали ефективність модифікованої квадротерапії із субцитратом вісмуту, пантопразолом, амоксициліном, фуразолідоном та послідовної терапії: пантопразол з амоксициліном — 5 днів, кларитроміцин з тинідазолом — 5 днів. Рівень ерадикації при застосуванні обох схем майже однаковий — 88,7 і 89,1 %, при тому що послідовна терапія значно складніша для пацієнта [50]. На безпеку стандартної квадротерапії із субцитратом вісмуту як терапії першої лінії для пацієнтів із цукровим діабетом вказують М. Demir зі співавт., причому рівень ерадикації був достатнім в обох групах обстежених, з діабетом та без діабету, і сягав 85 і 87 % відповідно [51]. Вісмут-вмісна квадротерапія забезпечує більш високий рівень ерадикації порівняно з потрійною терапію за результатами дослідження А. Uygun зі спів-авт., — 82,3 проти 70,0 % [52]. У педіатричній практиці показана ефективність комбінації субцитрату вісмуту в 7-денній схемі з амоксициліном та метронідазолом, що надає можливість досягти 80,0% ефекту ерадикації [53]. Додавання субцитрату вісмуту до антибіотиків амоксициліну, кларитроміцину в поєднанні з омепразолом і подовження тривалості лікування до 14 днів дозволяє досягти високого рівня ерадикації (93,0 %), навіть за умов 18,0% рівня резистентності до кларитроміцину, за даними Q. Sun зі співавт. [54]. Аналізуючи результати різних схем лікування, інші автори доходять висновків: подовження схем лікування на базі препаратів вісмуту до 14 днів збільшує ефективність ерадикації більше ніж на 10 % [55].
Отже, додавання колоїдного субцитрату вісмуту (Де-Нол) до схем ерадикації є на сьогодні основним шляхом збільшення ефективності ерадикаційниїх схем H.pylori. Доступними варіантами є: додавання його до базової потрійної терапії із подовженням терміну лікування до 14 днів та застосування у схемах з метронідазолом як терапії першої лінії, особливо за умов резистентності до кларитроміцину понад 20,0 % [56].
Після успішної ерадикації пацієнти потребують ретельного нагляду. Рекомендації щодо тактики нагляду розроблені за участю Європейської спілки ендоскопістів (ESGE), Європейської групи з вивчення Helicobacter pylori (EHSG), Європейської спілки патологів (ESP), Португальської спілки ендоскопістів (SPED) у 2012 році. Так, пацієнтам з атрофією або інтестинальною метаплазією як в антральному відділі, так і в тілі шлунка необхідно запропонувати проведення ендоскопічного обстеження раз на три роки після встановлення діагнозу. Пацієнти з дисплазією низької градації повинні спостерігатися протягом року з проведенням ендоскопічної резекції при появі ендоскопічних ознак ураження. При дисплазії високої градації без видимих ендоскопічних ознак контроль з багатократною біопсією необхідно проводити в строк від 6 до 12 місяців [57]. Утім деякі автори вважають, що терміни спостереження за пацієнтами з високим рівнем градації ризику розвитку раку шлунка повинні бути визначені з урахуванням регіональних особливостей цієї тяжкої патології. Так, у Японії вважають за необхідне проводити скринінг передракових змін кожні 2 роки. При тяжкому ступені інтестинальної метаплазії спостереження повинно проводитися щороку, при цьому корейські дослідники на підставі аналізу низки досліджень визначають групи пацієнтів, яким ендоскопічне обстеження повинно проводитися першочергово та регулярно. Це пацієнти з поширенням інтестинальної метаплазії понад 20,0 %, пацієнти з неповною кишковою метаплазією, родичі першої лінії пацієнтів із раком шлунка та особи, які палять. Цій групі пацієнтів автори радять проводити ендоскопічне обстеження кожні 2 або 3 роки. Також на особливу увагу заслуговують пацієнти, старші за 40 років, для яких запропоновано систему скринінгу, що включає тестування на Helicobacter рylori, вивчення рівня пепсиногену, ендоскопічне дослідження кожні 2 роки пацієнтам без хелікобактерної інфекції та щорічно — після проведення ерадикації [19].
Отже, проблема своєчасної діагностики преканцерозних змін у слизовій оболонці шлунка не втрачає своєї актуальності вже протягом багатьох років. Нові методи діагностики значно розширюють можливості ідентифікації груп пацієнтів, які потребують ретельного нагляду для запобігання розвитку цієї тяжкої патології. Ерадикація Helicobacter pylori надає можливість корегувати єдиний на сьогодні фактор ризику розвитку раку шлунка, що піддається модифікації. Застосування колоїдного субцитрату вісмуту (Де-Нол) у схемах ерадикації є основним шляхом збільшення їх ефективності як при включенні до схем з метронідазолом як терапії першої лінії, так і при додаванні колоїдного субцитрату вісмуту (Де-Нол) до базової потрійної терапії з подовженням терміну лікування до 14 днів.
Список литературы
1. Correa P. Human Gastric carcinogenesis: A Multistep and Multifactorial Process — First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention / P. Correa // Cancer research. — 1992 Dec 15. — № 52. — P. 6735-6740.
2. Detection Rate of Helicobacter pylori Against a Background of Atrophic Gastritis and/or Intestinal Metaplasia / Y.J. Youn, K. Nayoung, P.Y. Soo [et al.] // Journal of Clinical Gastroentero–logy. — 2007. — Vol. 41, Is. 8. — Р. 751-755.
3. Gastric cancer risk in patients with premalignant gastric lesions: a nationwide cohort study in the Netherlands / de Vries A. C., van Grieken N. C., Looman C.W. [et al.] // Gastroenterology. — 2008. — № 134. — Р. 945-952.
4. Helicobacter pylori-negative Gastritis in Erosive Esophagitis, Nonerosive Reflux Disease or Functional Dyspepsia Patients / Peura D.A., Haber M.M., Hunt B. [et al.] // Journal of Clinical Gastroenterology. — 2010. — Vol. 44, Is. 3. — Р. 180-185.
5. Stolte M. The updated Sydney system: Classification and grading of gastritis as the basis of diagnosis and treatment / M. Stolte, A. Mei // Can. J. Gastroenterol. — 2001. — Vol. 15, № 9. — P. 591-598.
6. Sipponen P. The Sydney System for classification of gastritis 20 years ago / P. Sipponen, A.B. Price // Journal of Gastroenterology and Hepatology. — 2011. — № 26, Suppl. 1. — Р. 31-34.
7. Incidence of gastric cancer among patients with gastric precancerous lesions: observational cohort study in a low risk Western population // H. Song, I. G. Ekheden, Z. Zheng [et al.] // BMJ. — 2015. — Р. 351-357.
8. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994 / Dixon M.F., Genta R.M., Yardley J.H. [et al.] // Am. J. Surg. Pathol. — 1996. — № 20 (10). — Р. 1161-1181.
9. OLGA staging for gastritis: A tutorial / M. Rugge, P. Correa, F.Di Mario [et al.] // Digestive and Liver Disease. — 2008. — № 40. — Р. 650-658.
10. Gastritis: The histology report / M. Rugge, G. Pennelli, E. Pilozzi [et al.] // Digestive and Liver Disease. — 2011. — № 43S. — Р. 373-384.
11. Gastritis OLGA-staging and gastric cancer risk: a twelve-year clinico-pathological follow-up study / Rugge M., De Boni M., Pennelli G. [et al.] // Alimentary Pharmacology and Therapeutics. — 2010. — № 31. — P. 1104-1111.
12. The staging of gastritis with the OLGA system by using intestinal metaplasia as an accurate alternative for atrophic gastritis / L.G. Capelle, A.C. de Vries, J. Haringsma [et al.] // Gastrointestinal endoscopy. — 2010. — Vol. 71, № 7 — P. 1150-1158.
13. Operative link for gastritis assessment vs operative link on intestinal metaplasia assessment / M. Rugge, M. Fassan, M. Pizzi [et al.] // World Journal of Gastroenterology. — 2011. — № 17 (41). — P. 4596-4661
14. First-degree relatives of patients with early-onset gastric carcinoma show even at young ages a high prevalence of advanced OLGA/OLGIM stages and dysplasia / R. Marcos-Pinto, F. Carneiro, M. Dinis-Ribeiro [et al.] // Alimentary Pharmacology and Therapeutics. — 2012. — № 35 (12). — Р. 1451-1459.
15. Gastritis staging: interobserver agreement by applying OLGA and OLGIM systems / Sergejs Isajevs, Inta Liepniece-Karele, Dainius Janciauskas [et al.] // Virchows Arch. — Springer-Verlag Berlin Heidelberg, 2014. — 5 p.
16. Staging of intestinal- and diffuse-type gastric cancers with the OLGA and OLGIM staging systems / S.-J. Cho, I.J. Choi, M.-C. Kook [et al.] // Aliment Pharmacol Ther. — 2013. — № 38 (10). — Р. 1292-1302.
17. Impact of the angulus biopsy for the detection of gastric preneoplastic conditions and gastric cancer risk assessment / M. Varbanova, T. Wex, D. Jechorek [et al.] // J. Clin. Pathol. — 2015. — Рublished online.
18. The correlation of endoscopic and histological diagnosis of gastric atrophy / Eshmuratov A., Nah J.C., Kim N. [et al.] // Dig. Dis. Sci. — 2010. — 55 (5). — Р. 1364-1375.
19. Yoon H., Kim N. Diagnosis and Menegment of High Risk Group for Gastric Cancer // Gut and Liver. — 2015. — Vol. 1, № 9. — P. 5-17.
20. Diagnosis of Gastritis — Review from Early Pathological Evaluation to Present Day Management / I.L. Szabo, K. Cseko, J. Czimmer [et al.] // Current Topics in Gastritis — 2012. — 19 p.
21. Saka A., Yagi K., Nimura S. OLGA- and OLGIM-based staging of gastritis using narrow-band imaging magnifying endo–scopy // Dig. Endosc. — 2015. — № 27 (7). — Р. 734-741.
22. OLGA and OLGIM stage distribution according to age and Helicobacter pylori status in the Korean population. / Nam J.H., Choi I.J., Kook M.C. [et al.] // Helicobacter. — 2014. — № 19 (2). — P. 81-89.
23. Helicobacter pylori Infection on Levels of DNA Damage in Gastric Epithelial Cells / S.M. Everett, K.L.M. White, I.M. Drake [et al.] // Helicobacter. — 2002. — № 7. — Р. 271-280.
24. Helicobacter pylori cagA and vacA genotypes as predictors of progression of gastric preneoplastic lesions: a long-term follow-up in a high-risk area in Spain / C.A. Gonzalez, C. Figueiredo, C.B. Lic [et al.] // Am. J. Gastroenterol. — 2011. — № 106. — Р. 867-874.
25. Analysis of cagA in Helicobacter pylori strains from Colombian populations with contrasting gastric cancer risk reveals a biomarker for disease severity / J.T. Loh, C.L. Shaffer, M.B. Piazuelo [et al.] // Cancer Epidemiol. Biomarkers. Prev. — 2011. — № 20. — Р. 2237-2249.
26. Correa P. The gastric precancerous cascade / P. Correa, M.B. Piazuelo // J. Dig. Dis. — 2012. — № 13 (1). — Р. 2-9.
27. Association between cagA and vacA genotypes and pathogenesis in a Helicobacter pylori infected population from South-eastern Sweden / Karlsson A., Ryberg A., Dehnoei M.N. [et al.] // BMC Microbiol. — 2012. — № 2 (12). — Р. 129.
28. Correlation of Helicobacter pylori genotypes with gastric histopathology in the central region of a South-European country / Almeida N., Donato M.M., Romãozinho J.M. [et al.] // Dig. Dis. Sci. — 2015. — № 60 (1). — Р. 74-85.
29. Toll-Like Receptors as Biomarkers of Gastric Carcinogenesis: Implications for Diagnosis, Prognosis and Treatment / P. Pimentel-Nunes, J.B. Soares, M. Dinis-Ribeiro // Journal of Cancer Therapy. — 2013. — № 4. — Р. 1037-1047.
30. Zabaleta J. Multifactorial etiology of gastric cancer / J. Zabaleta // Methods Mol. Biol. — 2012. — № 863. — Р. 411-435.
31. Shiotani A. Eradication of gastric cancer is now both possible and practical / Shiotani A., Cen P., Graham D.Y. // Semin. Cancer Biol. — 2013. — № 23. — Р. 492-501.
32. Tepes B. Population based Helicobacter pylori screening and eradication: advances versus side effects / B. Tepes // Curr. Pharm. Des. — 2014. — № 20 (28). — Р. 4501-4509.
33. Mégraud F. The challenge of Helicobacter pylori resistance to antibiotics: the comeback of bismuth-based quadruple therapy / F. Mégraud // Therap. Adv. Gastroenterol. — 2012. — № 5 (2). — Р. 103-109.
34. Cytoprotective effect of bismuth subsalicylate in indome–thacin-treated rats is associated with enhanced mucus bismuth concentration / Tanaka S., Guth P.H., Carryl O.R. [et al.] // Aliment. Pharmacol. Ther. — 1997. — № 11 (3). — Р. 605-612.
35. Evaluation of effects of ethyl alcohol and bismuth subsalicylate on gastric mucosal barrier in man / Dy R.M., Lof J., DiBaise J.K. [et al.] // Dig. Dis. Sci. — 1999. — № 44 (2). — Р. 286-289.
36. Gastroduodenal mucosal prostaglandin generation in patients with Helicobacter pylori before and after treatment with bismuth subsalicylate / Avunduk C., Suliman M., Gang D. [et al.] // Dig. Dis. Sci. — 1991. — № 36 (4). — Р. 431-434.
37. Evidence that bismuth salts reduce invasion of epithelial cells by enteroinvasive bacteria / Gump D.W., Nadeau O.W., Hendricks G.M. [et al.] // Med. Microbiol. Immunol. — 1992. — № 181 (3). — Р. 131-143.
38. Manhart M.D. In vitro antimicrobial activity of bismuth subsalicylate and other bismuth salts / M.D. Manhart // Rev. Infect. Dis. — 1990. — № 12, Suppl. 1. — Р. 11-15.
39. Sox T.E. Binding and killing of bacteria by bismuth subsalicylate / Sox T.E., Olson C.A. // Antimicrob. Agents Chemo–ther. — 1989. — № 33 (12). — Р. 2075-2082.
40. Lee S.P. The mode of action of colloidal bismuth subcitrate / S.P. Lee // Scand. J. Gastroenterol. — 1991. — № 185. — Р. 1-6.
41. Chronic erosive gastritis — a therapeutic approach with bismuth / Malfertheiner P., Stanescu A., Baczako K. [et al.] // Scand. J. Gastroenterol. — 1988. — № 142. — Р. 87-92.
42. Wagstaff A.J. Colloidal bismuth subcitrate. A review of its pharmacodynamic and pharmacokinetic properties, and its therapeutic use in peptic ulcer disease / Wagstaff A.J., Benfield P., Monk J.P. // Drugs. — 1988. — № 36 (2). — Р. 132-157.
43. Lambert J.R. The actions of bismuth in the treatment of Helicobacter pylori infection / Lambert J.R., Midolo P. // Aliment. Pharmacol Ther. — 1997. — № 11, Suppl. 1. — Р. 27-33.
44. High cure rate of Helicobacter pylori infection using tripotassium dicitrato bismuthate, furazolidone andclarithromycin triple therapy for 1 week / Xiao S.D., Liu W.Z., Hu P.J. [et al.] // Aliment. Pharmacol. Ther. — 1999. — № 13 (3). — Р. 311-315.
45. Laine L. Is it time for quadruple therapy to be first line? / L. Laine // Can. J. Gastroenterol. — 2003. — № 17, Suppl. B. — Р. 33-35.
46. Seven-Day Bismuth-based Quadruple Therapy as an Initial Treatment for Helicobacter pylori Infection in a High Metronidazole Resistant Area / Vilaichone R.K., Prapitpaiboon H., Gamnarai P. [et al.] // Asian Pac. J. Cancer Prev. — 2015. — № 16 (14). — Р. 6089-6092.
47. Current Status of Five Different Regimens for Empiric First-Line Helicobacter pylori Eradication in Turkey / Gungor G., Baglıcakoglu M., Kayacetin E. [et al.] // Digestion. — 2015. — № 92 (2). — Р. 55-59.
48. Efficacy of Clarithromycin Containing Bismuth-Based Re–gimen as a Second-Line Therapy in Helicobacter pylori Eradication / Mokhtare M., Agah S., Fakheri H. [et al.] // Middle East J. Dig. Dis. — 2015. — № 7 (2). — Р. 75-81.
49. Prapitpaiboon H., Mahachai V., Vilaichone R. K. High Efficacy of Levofloxacin-Dexlansoprazole-Based Quadruple Therapy as a First Line Treatment for Helicobacter pylori Eradication in Thailand // Asian Pac. J. Cancer Prev. — 2015. — № 16 (10). — Р. 4353-4356.
50. A comparison between sequential therapy and a modified bismuth-based quadruple therapy for Helicobacter pylori eradication in Iran: a randomized clinical trial / Fakheri H., Taghvaei T., Hosseini V. [et al.] // Helicobacter. — 2012. — № 17 (1). — Р. 43-48.
51. Bismuth-based first-line therapy for Helicobacter pylori eradication in type 2 diabetes mellitus patients. Demir M., Göktürk S., Oztürk N. A. [et al.] // Digestion. — 2010. — № 82 (1). — Р. 47-53.
52. The efficacy of bismuth containing quadruple therapy as a first-line treatment option for Helicobacter pylori / Uygun A., Kadayifci A., Safali M. [et al.] // J. Dig. Dis. — 2007. — № 8 (4). — Р. 211-215.
53. Efficacy of bismuth-based triple therapy in children with abdominal pain and Helicobacter pylori gastritis / Shamaly H., Berkowitz D., Rosenthal E. [et al.] // J. Pediatr. Gastroenterol. Nutr. — 2000. — № 30 (2). — Р. 198-200.
54. High efficacy of 14-day triple therapy-based, bismuth-containing quadruple therapy for initial Helicobacter pylori eradication / Sun Q., Liang X., Zheng Q. [et al.] // Helicobacter. — 2010. — № 15 (3). — Р. 233-238.
55. Optimum duration of regimens for Helicobacter pylori eradication / Yuan Y., Ford A. C., Khan K. J. [et al.] // Cochrane Database Syst. Rev. — 2013.
56. Malfertheiner P. Bismuth Improves PPI-based Triple Therapy for H. Pylori Eradication / P. Malfertheiner // Nature reviews. Gastroenterology & Hepatology. — 2010. — Vol. 7. — P. 538-539.
57. Management of precancerous conditions and lesion in the stomach (MADS): guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter study group (EHSG), European Society of Pathology (ESP), and the Sociedade Portuguesa de Endoscopia Digestiva (SPED) / M. Dinis-Ribeiro, M. Areia, A.C. de Vries [et al.] // Endoscopy. — 2012. — № 44. — P. 74-94.
/113.jpg)
/115.jpg)
/117.jpg)

/114.jpg)
/115_2.jpg)