Украинский журнал хирургии 1-2 (28-29) 2015
Вернуться к номеру
Эффективность лечения холодовой травмы локальным отрицательным давлением
Авторы: Самойленко Г.Е., Андреев О.В. - Донецкий национальный медицинский университет им. М. Горького, г. Красный Лиман, Украина
Рубрики: Хирургия
Разделы: Клинические исследования
Версия для печати
Цель работы: оценить эффективность локального применения отрицательного давления
(VAC-терапии) при отморожениях и улучшить результаты лечения больных с холодовой травмой конечностей за счет комбинации с ранним хирургическим воздействием. Материал и методы. Под наблюдением находились 147 больных с холодовой травмой в возрасте от 16 до 79 лет (в среднем 44,0 ± 1,2 года), среди которых было 87 % мужчин и 13 % женщин. VAC-терапия (основная группа, VAC+) была применена у 29 больных, a у 118 лечение проводили без отрицательного давления (контрольная группа, VAC–). Результаты. Использование VAC-терапии как составляющей раннего хирургического лечения отморожений является эффективным мероприятием уже с первых суток после холодовой травмы и позволяет максимально сохранить ткани конечности, уменьшить объем некрэктомий и снизить число ампутаций при глубоких отморожениях, причем патогенетическая направленность декомпрессии тканей в реактивном периоде определяется улучшением микроциркуляции, предупреждением тромбообразования и вторичной инфекции, диктует необходимость использования VAC+ в случаях выполнения дермопластики и ограничивает назначение отрицательного давления при ампутациях стоп, а прогностическими критериями в отношении дальнейших лечебных мероприятий являются исходные показатели анатомической тяжести отморожений конечностей, С-реактивного протеина и активности креатинкиназы в сыворотке крови. Установлено более тяжелое течение патологического процесса в основной группе, о чем свидетельствуют достоверно большие изменения 19 исходных клинико-лабораторных и инструментальных показателей из 31. Пациенты с VAC+ и VAC– не различались между собой лишь по минутному объему крови, вегетативному индексу и периферическому сосудистому сопротивлению, показателям времени рекальцификации, эндотелиальной функции сосудов и физико-химическим адсорбционно-реологическим параметрам сыворотки. Выводы. Результаты лечебных мероприятий с использованием VAC-терапии при холодовой травме тесно связаны с клинико-лабораторным течением патологического процесса, а выделенные прогностические критерии позволят повысить качество медицинской технологии оказания помощи таким больным.
Мета роботи: оцінити ефективність локального застосування негативного тиску (VAC-терапії) при відмороженнях та поліпшити результати лікування хворих із холодовою травмою кінцівок за рахунок комбінації з раннім хірургічним втручанням. Матеріал і методи. Під наглядом перебувало 147 хворих із холодовою травмою віком від 16 до 79 років (в середньому 44,0 ± 1,2 року), серед яких було 87 % чоловіків і 13 % жінок. Застосування VAC-терапії (основна група, VAC+) було виконано 29 хворим, a 118 лікування проводили без негативного тиску (контрольна група, VAC–). Результати. Використання VAC-терапії як складової раннього хірургічного лікування відморожень є ефективним засобом вже з першої доби після холодової травми і дозволяє максимально зберегти тканини кінцівки, зменшити обсяг некректомій і знизити кількість ампутацій при глибоких відмороженнях, причому патогенетична спрямованість декомпресії тканин в реактивному періоді визначається поліпшенням мікроциркуляції, запобіганням тромбоутворенню і вторинній інфекції, диктує необхідність використання VAC+ у випадках виконання дермопластики й обмежує призначення негативного тиску в разі ампутації ступень, а прогностичним критерієм щодо подальших лікувальних заходів є початкові показники анатомічної тяжкості відмороження кінцівок, С-реактивного протеїну й активності креатинкінази в сироватці крові. Встановлено більш тяжкий перебіг патологічного процесу в основній групі, про що свідчать вірогідні зміни 19 початкових клініко-лабораторних та інструментальних показників з 31. Пацієнти з VAC+ і VAC– не відрізнялися між собою лише за хвилинним об’ємом крові, вегетативним індексом і периферійним судинним опором, показниками часу рекальцифікації, ендотеліальної функції судин й фізико-хімічними параметрами адсорбційно-реологічних властивостей сироватки. Висновки. Результати лікувальних заходів з використанням VAC-терапії при холодовій травмі тісно пов’язані з клініко-лабораторним перебігом патологічного процесу, а виділені прогностичні критерії дозволять підвищити якість медичної технології надання допомоги таким хворим.
Objective: to evaluate the effectiveness of topical application of negative pressure (VAC-therapy) for frostbites and to improve treatment outcomes in patients with cold injury to the extremities due to a combination with early surgical exposure. Material and methods. The study included 147 patients with cold injury aged 16 to 79 years (mean age 44.0 ± 1.2 years), among whom there were 87 % of men and 13 % of women. Application of VAC-therapy (study group, VAC+) was performed in 29 patients, and 118 subjects underwent treatment without negative pressure (control group, VAC–). Results. Using the VAC-therapy as a component of early surgical treatment of frostbites is an effective measure from the first days after a cold injury and allows to preserve maximally the tissues of the limbs, to reduce the volume of necrectomy and to decrease the number of amputations in deep frostbites, at that, pathogenetic orientation of tissue decompression in the reactive period is determined by the improvement of microcirculation, prevention of thrombosis and secondary infection, necessitates the use of VAC+ in the case of dermoplasty and limits the administration of negative pressure in foot amputation, and prognostic criteria for further treatment measures are baseline parameters of anatomic severity of frostbite of extremities, C-reactive protein and creatine kinase activity in the blood serum. There has been detected a more severe course of the pathological process in the study group, as evidenced by the significantly large changes in 19 initial clinical-laboratory and instrumental indicators out of 31. Patients with VAC+ and VAC– did not differ only in minute volume of the blood, vegetative index and peripheral vascular resistance, indicators of recalcification time, vascular endothelial function, physical and chemical adsorption and rheological parameters of the blood serum. Conclusions. The results of therapeutic interventions using VAC-therapy in cold injury are closely related to the clinical and laboratory course of the pathological process, and the selected prognostic criteria will improve the quality of medical technology to assist these patients.
травма, холод, отморожения, лечение, отрицательное давление.
травма, холод, відмороження, лікування, негативний тиск.
injury, cold, frostbites, treatment, negative pressure.
Статья опубликована на с. 45-50
Введение
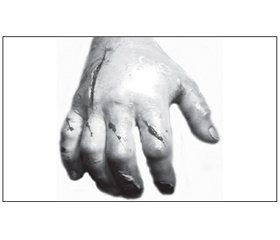
Материал и методы исследования
/46.jpg)
Результаты и обсуждение
/48.jpg)
Выводы
1. Banzon T.M. Frostbite and chilblains in upton sinclair's the jungle / T.M. Banzon, S.A. Norton // JAMA Dermatol. — 2015. — Vol. 151, № 4. — P. 421-426.
2. Cauchy E. Portable hyperbaric chamber and management of hypothermia and frostbite: an evident utilization / E. Cauchy, S. Leal, M.A. Magnan, H. Nespoulet // High. Alt. Med. Biol. — 2014. — Vol. 15, № 1. — P. 95-96.
3. Dwivedi D.A. Successful treatment of frostbite with hyperbaric oxygen treatment / D.A. Dwivedi, S. Alasinga, S. Singhal [et al.] // Indian J. Occup. Environ Med. — 2015. — Vol. 19, № 2. — P. 121-122.
4. Ezquerra-Herrando L. Amputation level after frostbite: role of bone scan. A case report / L. Ezquerra-Herrando, E. Corella-Abenia, J.M. Zamora-Rodriguez [et al.] // Cir. — 2013. — Vol. 81, № 4. — P. 353-356.
5. Finderle Z. Delayed treatment of frostbite injury with hyperbaric oxygen therapy: a case report / Z. Finderle, K. Cankar // Aviat. Space Environ Med. — 2012. — Vol. 73, № 4. – P. 392-394.
6. Gage M. J. Uses of negative pressure wound therapy in orthopedic trauma / M.J. Gage, R.S. Yoon, K.A. Egol, F.A. Liporace // Orthop. Clin. North Am. — 2015. — Vol. 46, № 2. — P. 227-234.
7. Higdon B. Deep frostbite treated with hyperbaric oxygen and thrombolytic therapies / B. Higdon, L. Youngman, M. Regehr, A. Chiou // Wounds. — 2015. — Vol. 27, № 8. — P. 215-223.
8. Hiza E.A. Effect of a dedicated orthopaedic advanced practice provider in a level i trauma center: analysis of length of stay and cost / E.A. Hiza, M.B. Gottschalk, E. Umpierrez [et al.] // J. Orthop. Trauma. — 2015. — Vol. 29, № 7. — P. 225-230.
9. Kemper T.C. Frostbite of both first digits of the foot treated with delayed hyperbaric oxygen: a case report and review of literature / T.C. Kemper, V.M. de Jong, H.A. Anema [et al.] // Undersea Hyperb. Med. — 2014. — Vol. 41, № 1. — P. 65-70.
10. McIntosh S.E. Wilderness medical society practice guidelines for the prevention and treatment of frostbite: 2014 update / S.E. McIntosh, M. Opacic, L. Freer [et al.] // Wilderness. Environ Med. — 2014. — Vol. 25, № 4. — P. 43-54.
11. Nygaard R.M. The Hennepin score: Quantification of frostbite management efficacy / R.M. Nygaard, A.B. Whitley, R.M. Fey, A.I. Wagner // J. Burn. Care. Res. — 2015. — Vol. 3, № 11. — P. 150-156.
12. Petrone P. In brief: Hypothermia / P. Petrone, J.A. Asensio, C.P. Marini // Curr. Probl. Surg. — 2014. — Vol. 51, № 10. — P. 414-415.
13. Roussel L.O. Tweens feel the burn: «salt and ice challenge» burns / L.O. Roussel, D.E. Bell // Int. J. Adolesc. Med. Health. — 2015. — Vol. 22, № 4. — P. 141-147.
14. Sporns P.B. Acute tonsillar cerebellar herniation in a patient with traumatic dural tear and VAC therapy after complex trauma / P.B. Sporns, S. Zimmer, U. Hanning [et al.] // Spine J. — 2015. — Vol. 15, № 7. — P. 13-16.
15. Taves J. Reducing amputation rates after severe frostbite / J. Taves, T. Satre // Am. Fam. Physician. — 2015. — Vol. 92, № 8. — P. 716-726.
16. Taylor M. What are the ethical issues in treating a patient with bilateral leg gangrene incapable of consenting to amputation secondary to psychiatric illness? / M. Taylor, D. McKay, M. Eid [et al.] // Clin. Orthop. Relat. Res. — 2015. — Vol. 473, № 12. — P. 3998-4003.
17. Woo E.K. Proposed treatment protocol for frostbite: a retrospective analysis of 17 cases based on a 3-year single-institution experience / E.K. Woo, J.W. Lee, G.H. Hur [et al.] // Arch. Plast. Surg. — 2013. — Vol. 40, № 5. — P. 510-516.

/47.jpg)
/48_2.jpg)