Резюме
Найбільш важливою й адекватною морфологічною ознакою ефективності неоад’ювантної терапії в комбінованому лікуванні хворих на інвазивний рак сечового міхура є ступінь пухлинної регресії. Мета дослідження — встановити поляризаційно-оптичні параметри колагенових волокон строми інвазивного перехідно-клітинного раку сечового міхура під впливом неоад’ювантної ендолімфатичної хіміо- та променевої терапії. Матеріал і методи. Шістнадцять пацієнтів з інфільтративним перехідно-клітинним раком сечового міхура, яким проводилася неоад’ювантна терапія, що включає ендолімфатичну хіміотерапію й променеве лікування, становили дослідну групу. Поляризаційна мікроскопія нами застосовувалася для вивчення гістофізичних властивостей колагенових волокон строми в перехідно-клітинному раку сечового міхура. Результати дослідження і висновки. Волокна строми пухлинних комплексів під впливом неоад’ювантної терапії зазнають вираженої перебудови і представлені в основному нативними фібрилами й мономерами колагену, тобто преколагеновими волокнами. Результати поляризаційно-мікроскопічного дослідження пухлинної тканини інвазивного перехідно-клітинного раку сечового міхура свідчать про ефективність даної терапії і виражений лікувальний патоморфоз з інтенсивною загибеллю тканини новоутворення, що сприятиме подальшому хірургічному лікуванню пацієнтів з інфільтративними формами перехідно-клітинного раку сечового міхура. Статистично значущі (р ≤ 0,001) зменшення щільності і зростання рівномірності розподілу клітинних інфільтратів (з 181,5 ± 11,3 до 17,6 ± 3,1 імунокомпетентних клітин на 1 мм2 строми пухлинних комплексів) з переважанням лімфоцитів (82,1 ± 2,4 %) у пацієнтів дослідної групи свідчать на користь оптимального застосування схеми неоад’ювантного лікування перехідно-клітинного раку сечового міхура, компонентами якого слугують ендолімфатична поліхіміо- і променева терапія.
Наиболее важным и адекватным морфологическим признаком эффективности неоадъювантной терапии в комбинированном лечении больных инвазивным раком мочевого пузыря является степень опухолевой регрессии. Цель исследования — установить поляризационно-оптические параметры коллагеновых волокон стромы инвазивного переходно-клеточного рака мочевого пузыря под влиянием неоадъювантной эндолимфатической химио- и лучевой терапии. Материал и методы. Шестнадцать пациентов с инфильтративным переходно-клеточным раком мочевого пузыря, которым проводилась неоадъювантная терапия, включающая эндолимфатическую химиотерапию и лучевое лечение, составили исследуемую группу. Поляризационная микроскопия нами применялась для изучения гистофизических свойств коллагеновых волокон стромы в переходно-клеточном раке мочевого пузыря. Результаты исследования и выводы. Волокна стромы опухолевых комплексов под влиянием неоадъювантной терапии подвергаются выраженной перестройке и представлены в основном нативными фибриллами и мономерами коллагена, то есть преколлагеновыми волокнами. Результаты поляризационно-микроскопического исследования опухолевой ткани инвазивного переходно-клеточного рака мочевого пузыря свидетельствуют об эффективности данной терапии и выраженном лечебном патоморфозе с интенсивной гибелью ткани новообразования, что способствует дальнейшему хирургическому лечению пациентов с инфильтративными формами переходно-клеточного рака мочевого пузыря. Статистически значимые (р ≤ 0,001) уменьшение плотности и рост равномерности распределения клеточных инфильтратов (с 181,5 ± 11,3 до 17,6 ± 3,1 иммунокомпетентных клеток на 1 мм2 стромы опухолевых комплексов) с преобладанием лимфоцитов (82,1 ± 2,4 %) у пациентов исследовательской группы, свидетельствует в пользу оптимального применения схемы неоадъювантного лечения переходно-клеточного рака мочевого пузыря, компонентами которого являются эндолимфатическая полихимио- и лучевая терапия.
The most important and adequate morphological manifestations of the effectiveness of neoadjuvant therapy in the combined therapy of patients with invasive bladder cancer is the degree of tumor regression.
The purpose of research is to establish polarization-optical parameters of the stroma collagen fibers of invasive transient cell cancer of the bladder under the influence of neoadjuvant endolymphatic chemotherapy and radiotherapy. Material and methods. The group of study consisted of sixteen patients with infiltrative transient cell bladder cancer who were undergone neoadjuvant therapy including endolymphatic chemotherapy and radiotherapy. We have used polarizing microscopy to study the histophysical properties of the stroma collagen fibers of transitional cell cancer of the bladder.
The findings and conclusions. The stromal fibers of tumor complexes were undergone the substantial restructuring under the influence of neoadjuvant therapy and consist of principally native fibrils and monomers of the collagen, that are procollagen fibers.
The results of polarizing microscopic examination of tumor tissue of invasive transitional cell cancer of the bladder show the effectiveness of this therapy and pronounced medical pathomorphosis with intensive tumors tissue death. That promotes further surgical treatment of patients with infiltrative form of transitional cell cancer of the bladder. The statistically significant (r ≤ 0.001) decrease in density and increase in the uniform of distribution of cellular infiltrates (with 181.5 ± 11.3 to 17.6 ± 3.1 immunocompetent cells per 1 mm2 of tumor stroma complexes) with a predominance of lymphocytes (82.1 ± 2.4 %) in patients of the study group evidence in favor of the optimal use of the scheme of neoadjuvant treatment of transitional cell cancer of the bladder in combination with endolymphatic multiple chemo- and radiotherapy.
Статтю опубліковано на с. 56-60
Актуальність
На сьогодні рак сечового міхура займає друге місце серед онкоурологічних захворювань і третє за смертністю. Захворюваність постійно зростає. За останні десять років приріст хворих на рак сечового міхура у країнах СНД становив понад 50 %. На частку інвазивного раку сечового міхура припадає до 30 % новоутворень. Лікування даної категорії хворих залишається одним із найбільш складних завдань урологічної онкології [4–6, 8, 9]. Це і хірургічне лікування, і комбіноване, включаючи органозберігаючу та органозамісну хірургію раку сечового міхура, хіміопроменеву терапію. Найбільш важливою й адекватною морфологічною ознакою ефективності неоад’ювантної терапії в комбінованому лікуванні хворих на інвазивний рак сечового міхура є ступінь пухлинної регресії [3, 7].
Мета дослідження — встановити поляризаційно-оптичні параметри колагенових волокон строми інвазивного перехідно-клітинного раку сечового міхура під впливом неоад’ювантної ендолімфатичної хіміо- та променевої терапії.
Матеріал і методи
Шістнадцять пацієнтів з інфільтративним перехідно-клітинним раком сечового міхура, яким проводилася неоад’ювантна терапія, що включає ендолімфатичну хіміотерапію й променеве лікування, становили дослідну групу. Ендолімфатичний шлях введення хіміопрепаратів дозволяє зберігати їх постійну тривалу високу цитостатичну концентрацію, що потенціює і підвищує ефект променевого лікування. У дослідній групі проведене морфологічне, у тому числі поляризаційно-оптичне дослідження тканини пухлини з кількісною оцінкою структурних змін під впливом проведеного лікування. Для об’єктивної оцінки лікувального патоморфозу як еталон якісних і кількісних вихідних показників нами вивчена тканина інфільтративних форм раку сечового міхура 10 хворих, яким до операції не проводилося лікування (контрольна група). Забір матеріалу проводився відразу після операції з видаленого препарату для кількісної характеристики змін, що відбуваються в тканині сечового міхура. Шматочки тканини операційного матеріалу фіксували в 10% розчині холодного нейтрального формаліну (pH 7,4) протягом 24 годин. Фіксовані у формаліні шматочки після дегідратації заливали у високоочищений парафін з полімерними добавками (Richard-Allan Scientific, США) при температурі не вище 60 °С. З парафінових блоків на ротаційному мікротомі Microm HM325 з системою переносу зрізів STS (Carl Zeiss, Німеччина) виготовляли серійні гістологічні зрізи товщиною 5 ± 1 мкм, які потім забарвлювали гематоксиліном та еозином, толуїдиновим синім при рН 2,6 і 5,3, ставили ШИК-реакцію з обробкою контрольних зрізів амілазою. Гістологічне дослідження здійснювалось за допомогою мікроскопа Hund H500 (Німеччина). Усі мікрофотографії виконані за допомогою цифрової відеокамери для мікроскопа DCM510 (USB 2.0) 5M pixels CMOS chip, з’єднаної з персональним комп’ютером, і зберігаються в базі даних комп’ютера ОЕМ IBM PC/АT Pentium. Мікрофотографування та морфометричне вивчення препаратів нами здійснено з використанням програми AnalySIS Pro 3.2 (фірма SoftImaging, Німеччина) згідно з рекомендаціями виробника програмного забезпечення. При кількісній оцінці ступеня патоморфозу, питомого об’єму паренхіми, строми, судин МГЦР, мітотичного індексу, відсотка патологічних мітозів ми ґрунтувалися на класичних принципах морфометрії, викладених у монографії Г.Г. Автанділова (2002) [1].
Поляризаційна мікроскопія нами застосовувалася для вивчення гістофізичних властивостей колагенових волокон строми в перехідно-клітинному раку сечового міхура. Дослідження проводилося в лінійно- та еліптично-поляризованому світлі. Кількісно визначали оптичні показники колагенових волокон (Г0 — оптична сила, або різниця проходження світлового променя) в незабарвлених препаратах, ГФ — фенольний індекс Ебнера, ГГАГ — індекс вмісту глікозаміногліканів, ГНМПС — індекс вмісту нейтральних мукополісахаридів). Для кількісного аналізу даних ми використовували морфометричні методи дослідження з комп’ютерною обробкою отриманих даних [2].
Результати та обговорення
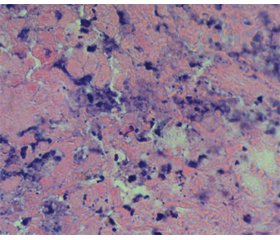
Мікроскопічно на значному протязі відзначається повна відсутність структури пухлинної тканини. Лише місцями в поверхневих відділах стінки сечового міхура виявляються невеликі обривки папілярних епітеліальних утворень, які за своєю гістологічною структурою відповідають високодиференційованому перехідно-клітинному епітелію. У більшості пухлинних комплексів відзначені великі вогнища коагуляційного некрозу: у центрі більшості комплексів структура пухлинних клітин практично не визначається, серед гомогенних еозинофільних мас виявляються фібриноїдний детрит і базофільні уламки ядер (рис. 1а). У частині комплексів виявляються тільки контури стінок некротизованих судин, у просвіті яких визначаються блідо-рожеві білкові маси й одиничні формені елементи крові. Навколо таких судин розташовується безліч клітин без чітких контурів, неправильної форми з еозинофільною, безструктурною цитоплазмою з округлими великими гомогенними, базофільними ядрами, які можна охарактеризувати як клітини, що перебувають у стадії некробіозу (рис. 1б).
/58.jpg)
У деяких частково збережених пухлинних комплексах виявляються атипові виродливі клітини, які лише віддалено нагадують клітини перехідно-клітинного або плоскоклітинного диференціювання. За своїми структурними характеристиками вони відповідають морфології клітин з ознаками променевого й хімічного патоморфозу. Вони дуже великі, частина з них гігантських розмірів, на кілька порядків більше, ніж клітини перехідно-клітинного епітелію. Конфігурація клітин дуже різноманітна, значна частина з них позбавлена чітких контурів. Цитоплазма в частині клітин базофільна, у деяких — насичено еозинофільна, розпушена, місцями брилчаста, місцями пластівчаста. У значній частині клітин у цитоплазмі виявляється безліч дрібних і великокраплинних оптично порожніх вакуолей. Ядра дуже великі.
У досліджуваній групі мікроскопічно по периферії великих вогнищ некротизованого перехідно-клітинного епітелію, ближче до збережених тканин стінки сечового міхура, виявляються великі поля грануляційної тканини. Ця грануляційна тканина має деякі відмінні риси від звичайної молодої грануляційної тканини. Вона представлена безліччю капілярів з різко ектазованим просвітом. Ендотелій капілярів набряклий, місцями десквамований. У просвіті деяких судин виявляються конглютинаційні й аглютинаційні тромби. Поліморфно-ядерні лейкоцити, круглі, епітеліоїдні й інші молоді фібробластичні клітини практично не виявляються. Лише на окремих ділянках виявляються вогнища пухкої дозріваючої сполучної тканини.
Волокнистий компонент строми інфільтративного перехідно-клітинного раку сечового міхура у пацієнтів дослідної групи на значному протязі некротизований. Збережені окремі колагенові волоконця у середині епітеліальних пухлинних комплексів, тонкі, звиті, еозинофільні, фуксинофільні при забарвленні за ван Гізоном, нерівномірно ШИК-позитивні, переважно орто–хроматичні при забарвленні толуїдиновим синім при рН 5,3, характеризуються дуже слабким блакитнуватим світінням.
Кількісні поляризаційно-оптичні параметри колагенових волокон строми перехідно-клітинного раку сечового міхура пацієнтів дослідної групи наведено в таблиці 1.
Вихідна оптична сила, або крок подвійного променезаломлення, а також фенольний індекс Ебнера колагенових волоконець строми перехідно-клітинного раку сечового міхура після ендолімфатичної хіміотерапії й променевого лікування характеризувалися дуже низькими показниками і в середньому в групі становили 2,9084 ± 0,0723 і 1,2008 ± 0,0329. З огляду на індекси вмісту нейтральних мукополісахаридів (1,3042 ± 0,0206) і глікозаміногліканів (1,3495 ± 0,0530) волокна строми пухлинних комплексів під впливом неоад’ювантної терапії зазнають вираженої перебудови й представлені в основному нативними фібрилами й мономерами колагену, тобто йдеться про юні преколагенові волокна.
Розподіл імунокомпетентних клітин у стромі перехідно-клітинного раку сечового міхура в пацієнтів дослідної групи більш рівномірний, характеризується невеликими скупченнями лімфоцитів навколо дрібних комплексів пухлинних клітин. Кількість імунокомпетентних клітин на 1 мм2 строми пухлинних комплексів у середньому становила 17,6 ± 3,1 (у контрольній групі — 181,5 ± 11,0). У складі імуноклітинних інфільтратів домінують лімфоцити (82,1 ± 2,4 %) і макрофаги (16,8 ± 3,9 %). Плазматичні клітини практично відсутні. У складі імуноклітинних інфільтратів контрольної групи домінують лімфоцити (71,6 ± 4,1 %), плазмоцити (14,8 ± 2,4 %) і макрофаги (13,8 ± 2,9 %). Тобто можна сказати, що виявлено виражене, статистично значуще (р ≤ 0,001) зменшення щільності і зростання рівномірності розподілу клітинних інфільтратів.
Висновки
1. Результати поляризаційно-мікроскопічного дослідження пухлинної тканини інвазивного перехідно-клітинного раку сечового міхура після застосування неоад’ювантної ендолімфатичної хіміотерапії й променевого лікування свідчать про ефективність даної терапії і виражений лікувальний патоморфоз з інтенсивною загибеллю тканини новоутворення, що сприятиме подальшому хірургічному лікуванню пацієнтів з інфільтративними формами перехідно-клітинного раку сечового міхура.
2. Статистично значуще (р ≤ 0,001) зменшення щільності і зростання рівномірності розподілу клітинних інфільтратів (з 181,5 ± 11,3 до 17,6 ± 3,1 імунокомпетентних клітин на 1 мм2 строми пухлинних комплексів) з переважанням лімфоцитів (82,1 ± 2,4 %) у пацієнтів дослідної групи свідчать на користь оптимального застосування схеми неоад’ювантного лікування перехідно-клітинного раку сечового міхура, компонентами якого слугують ендолімфатична поліхіміо- і променева терапія.
Список литературы
1. Автандилов Г.Г. Основы количественной патологической анатомии: учеб. пособие / Г.Г. Автандилов. — М.: Медицина, 2002. — 240 с.
2. Казаков В.Н. Поляризационная микроскопия в биологии и медицине : [монография] / В.Н. Казаков, В.Г. Шлопов. — Донецк : Каштан, 2008. — 320 с.
3. Мальцев А.В. Сравнительная оценка степени выраженности лечебного патоморфоза инвазивного переходно-клеточного рака мочевого пузыря при различных схемах неоадъювантной терапии / А.В. Мальцев, В.Г. Шлопов // Університетська клініка. — 2011. — Т. 7, № 2. — С. 155-158.
4. Молчанов Р.Н. Прогнозирование рецидивов опухолей мочевого пузыря с учетом факторов риска и особенностей лечения / Р.Н. Молчанов, О.Б. Блюсс // Медичні перспективи. — 2015. — Т. 20, № 1. — С. 49-55.
5. Ситдыкова М.Э., Зубков А.Ю., Нуриев И.Р. Органосохраняющее лечение инвазивного рака мочевого пузыря // Казанский медицинский журнал. — 2013. — № 4. — С. 501-505.
6. Apolo A.B., Vogelzang N.J., Theodorescu D. New and promi–sing strategies in the management of bladder cancer // Am. Soc. Clin. Oncol. Educ. Book. — 2015. — 35. — 105-12.
7. Histological variant as the significant predictor of survival in patients with lymph node positive urothelial carcinoma of the bladder / Kim H.S., Moon K.C., Jeong C.W., Kwak C., Kim H.H., Ku J.H. // Sci. Rep. — 2015 May 11.
8. Neoadjuvant chemotherapy in muscular invasive bladder cancer: Complications and consequences on cystectomy / Benadiba S., Gauthier H., Ploussard G., Mongiat-Artus P., Froger L., Basset V., Pashootan P., Chartier E., Dadoun D., Jacob F., Ravery V., Culine S., Desgrandchamps F. // Prog. Urol. — 2015 May 25.
9. Neoadjuvant or Adjuvant Chemotherapy for Bladder Cancer? / Hupe M.C., Kramer M.W., Kuczyk M.A., Mersebur–ger A.S. // Aktuelle Urol. — 2015 May. — 46(3). — 242-7.

/58.jpg)
/58_2.jpg)