Статтю опубліковано на с. 11-17
Респіраторні інфекції — поширена проблема, що виникає в клінічній педіатричній практиці. Довгий час препаратом вибору для терапії бактеріальних інфекцій дихальних шляхів у дітей і дорослих були пеніциліни, але з часом все більше стало з’являтися резистентних до цих антибіотиків штамів. Резистентність збудників інфекцій дихальних шляхів становить глобальну проблему в усьому світі. На сьогодні відмічається тенденція до стирання межі між госпітальними та позалікарняними штамами мікроорганізмів у зв’язку з розвитком стійкості до цілих груп антибіотиків та формуванням мультирезистентності. Найпоширенішим механізмом бактеріальної резистентності — близько 80 % усіх випадків — є ферментативне розщеплення антибіотика [9]. Резистентність мікроорганізмів може бути пов’язана й зі зниженням проникності зовнішніх структур бактеріальної клітини, що сприяє формуванню стійкості одночасно до декількох груп антибіотиків. Найчастіше причиною цього явища стає повна або часткова втрата поринових білків [1]. Стійкість може виникнути внаслідок мутацій. Найчастіше антибактеріальна резистентність поширюється шляхом горизонтального переносу генів під час трансдукції, трансформації або кон’югації. Причому обмін генами може відбуватися навіть між бактеріями різних видів. Набута таким чином стійкість поширюється дуже швидко за рахунок розмноження стійких штамів.
Однією з причин появи стійкості до протимікробних препаратів є необґрунтоване та неадекватне застосування антибактеріальних препаратів, унаслідок чого раніше чутливі штами стають резистентними. Стійкість бактерій до антибіотиків є основною причиною, що обмежує ефективність антибактеріальної терапії при інфекційних захворюваннях. Ефективна антибактеріальна терапія неможлива без визначення чутливості патогенів до протимікробних засобів, однак її починають ще до отримання результатів визначення чутливості патогенів до антибіотиків. Тому знати рівень резистентності патогенних бактерій до антимікробних препаратів вкрай важливо для проведення адекватної емпіричної терапії.
Метою даного дослідження було вивчення активності антибіотиків щодо патогенних та умовно-патогенних штамів мікроорганізмів, виділених у пацієнтів із бронхолегеневими захворюваннями.
Матеріали та методи дослідження
Бактеріологічний моніторинг збудників бронхолегеневих захворювань проведено в 332 дітей віком від 3 до 14 років, жителів м. Запоріжжя та Запорізької області, які перебували на лікуванні в Запорізькій обласній клінічній дитячій лікарні у 2013–2014 рр. Висів патогенів здійснювали на готові живильні середовища, виготовлені в заводських умовах: кров’яний агар колумбійський («Біомер’є», Франція), селективний шоколадний агар («Біомер’є», Франція). Чутливість до антибіотиків гемофілів визначалася диско-дифузним методом на шоколадному агарі з факторами росту, що був виготовлений компанією «Біомер’є» (Франція). Чутливість до пеніцилінів визначалася диско-дифузним методом з використанням оксацилінового диска (1 мкг). Визначення видів та чутливості до антибіотиків грампозитивних та грамнегативних бактерій проводилося на бактеріологічному аналізаторі Vitek 2 Compact («Біомер’є», Франція) з використанням програмного забезпечення AES: GlobalCLSI-based + Phenotypic: 19.04.2012. Чутливість до антибіотиків враховувалася відповідно до таблиць SLSI та EUCAST [21].
Результати дослідження
Етіологічна структура збудників респіраторних захворювань у дітей, які перебували під нашим спостереженням, подана в табл. 1.
Як випливає з наведених даних, бактерії роду Haemophilus відіграють основну роль в етіології інфекцій дихальних шляхів, при яких частка вказаних мікроорганізмів становить 52,7 % випадків.
/12.jpg)
Проведені дослідження чутливості патогенної мікрофлори до антибіотиків показали, що основна частина бактерій роду Haemophilus (92 %) була здатна до синтезу цефінази, що обумовлювало резистентність мікроорганізмів до амінопеніцилінів, карбоксипеніцилінів та уреїдопеніцилінів. У 24 % випадків виділені штами гемофільної палички проявляли стійкість до амоксициліну клавуланату, у 74 % штамів відмічена резистентність до ампіциліну. Набута резистентність до ампіциліну бактерій роду Haemophilus обумовлена продукцією плазмідних β-лактамаз ТЕМ-1 и ROB-1. Окрім ампіциліну, вказані ферменти частково гідролізують цефалоспорини І покоління, але вони не активні щодо препаратів ІІ–ІІІ покоління [19]. Останнім часом стали з’являтися дані про штами H.influenzae, що стійкі до ампіциліну та амоксициліну й не продукують β-лактамази [20]. Такі мікроорганізми отримали назву BLNAR (β-lactamase negative ampicillin-resistance). Їх стійкість пов’язана зі зміною пеніцилінозв’язуючих білків або зниженням проникності зовнішньої клітинної мембрани, у результаті чого вони стають резистентними до інгібіторозахищених пеніцилінів й окремих цефалоспоринів [18]. У випадках наявності капсульованих штамів Haemophilus мікроорганізми, що були виділені, мали високу чутливість до цефалоспоринів ІІ–ІІІ покоління. L-форми гемофільної палички у 63,6 % випадків мали набуту резистентність до всіх типів β-лактамаз, однак проявляли чутливість до фторхінолонів та левоміцетину й у 36,4 % випадків проявляли помірну чутливість до цефалоспоринів ІІ–ІІІ покоління на тлі високої чутливості до фторхінолонів та левоміцетину. Частота виявлення штамів Haemophilus influenzae, резистентних до макролідів, становила 89 %. Резистентність до макролідів пов’язують з наявністю у Haemophilus influenzae фонової активності механізмів активного виведення [4]. Переважна більшість штамів Haemophilus influenzae з мікробіологічної точки зору належать до «дикої» популяції, позбавленої додаткових детермінант резистентності до цих антибактеріальних препаратів. Однак in vivo при прийомі рекомендованих доз концентрації макролідів в органах і тканинах виявляються недостатніми для забезпечення ерадикації патогену [9].
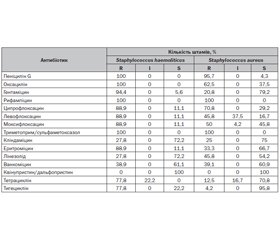
Проведена оцінка чутливості грампозитивних бактерій Staphylococcus haemoliticus та Staphylococcus aureus до дії антибактеріальних препаратів показала резистентність до пеніциліну, оксациліну/метициліну (табл. 2).
/13.jpg)
Стійкість стафілококів до β-лактамних антибактеріальних препаратів пов’язують або з продукцією β-лактамаз, або з наявністю додаткового пеніцилінзв’язуючого білка. Встановлення та диференціювання цих двох механізмів резистентності дозволяє надійно прогнозувати активність всіх β-лактамних антибіотиків без безпосередньої оцінки чутливості до кожного з цих препаратів [13]. Резистентність стафілококів до метициліну часто обумовлена іншими механізмами резистентності. Метицилінрезистентні стафілококи часто проявляють мультирезистентність [9]. Виявлено високу частоту резистентності даних мікроорганізмів до рифампіцину та фторхінолонів. Відповідальними механізмами стійкості стафілококів до рифампіцину є мутації гена, що кодує мРНК-полімеразу. Механізми стійкості до хінолонів у Staphylococcus повністю невідомі [1]. Стафілококи є природно резистентними до хінолонів першого покоління. Резистентність до фторхінолонів інших поколінь виникає при селекції резистентних мутантів. Вони проявляють перехресну резистентність до всіх аналогів препарату [9].
Резистентність до еритроміцину проявляли 88,9 % штамів Staphylococcus haemoliticus та 33,3 % штамів Staphylococcus aureus, що пов’язано з продукцією метилази, відповідальної за диметилювання специфічного аденіну на 23S РНК. Це спричиняє зміну в структурі РНК, знижуючи спорідненість до макролідів [9]. Резистентність до триметоприму/сульфаметоксазолу становила 100 %. Стійкість мікроорганізмів до цих двох компонентів формується за допомогою кількох механізмів: зміни ферментних мішеней (ди- та тетрагідрофолатредуктаз для триметоприму та дигідроптероатсинтази для сульфаніламідів) і гіперпродукування цих ферментів [9].
Серед протестованих антибіотиків найбільшу активність щодо Staphylococcus haemoliticus та Staphylococcus aureus мали кліндаміцин, тетрациклін, тигециклін та квінупристин/дальфопристин. Staphylococcus haemoliticus у 94,4 % випадків був стійкий до гентаміцину, що зумовлено набуттям інактивуючих ферментів. Гентаміцин зберігав активність щодо Staphylococcus aureus, хоча рівень резистентності становив 20,8 %. Нечутливість до ванкоміцину була встановлена у 38,9 % ізолятів Staphylococcus haemoliticus та 39,1 % штамів Staphylococcus aureus. Точний механізм резистентності стафілококів до ванкоміцину на сьогодні не встановлено, хоча його пов’язують зі збільшенням товщини клітинної стінки та концентрації пеніцилінзв’язуючих білків 2 та 2а [6]. Механізм розвитку стійкості стафілококів до лінезоліду, яку було виявлено у 27,8 % штамів Staphylococcus haemoliticus та 45,8 % штамів Staphylococcus aureus, пов’язаний з модифікацією рибосомальної мішені дії, що реалізується в мутаціях гена 23SrRNA [17].
Найбільші рівні резистентності було виявлено в умовно-патогенних збудників Klebsiella pneumoniае. Klebsiella pneumoniae не завжди має антибіотикорезистентність, але легко набуває цю властивість за допомогою плазмід [22].
Було зареєстровано високу частоту штамів, резистентних до цефтазидиму та цефотаксиму (70 %) (табл. 3), що в більшості випадків було обумовлено продукцією плазмідних β-лактамаз розширеного спектра (БЛРС). Незважаючи на те, що БЛРС пригнічуються тазобактамом, чутливість до піперациліну/тазобактаму не перевищила 26,7 %, що можна пояснити гіперпродукцією ферментів. Було зареєстровано значну поширеність штамів Klebsiella pneumoniaе, стійких і до не-β-лактамних антибіотиків.
/14.jpg)
Рівень резистентності до норфлоксацину становив 75 %. Антибактеріальна дія хінолонів обумовлена інгібуванням реплікації бактеріальної ДНК за допомогою впливу на ДНК-гіразу. Стійкість бактерій до хінолонів пов’язують зі змінами в генах, що приводять до зміни структури ДНК-гірази — ферменту, який викликає реплікацію бактеріальної ДНК, або знижують проникнення хінолонів через клітинну стінку грамнегативних бактерій. В обох випадках це відбувається внаслідок мутації хромосомних генів. Мутації, пов’язані зі структурними змінами в ДНК-гіразі, обумовлені дезорганізацією в гір-А- та гір-В-генах, що кодують функцію субодиниць гірази А і В [15].
Було встановлено 100% резистентність Klebsiella pneumoniaе до триметоприму/сульфаметоксазолу. Найбільш часто механізмом резистентності до сульфаніламідів у клінічних штамів Klebsiella pneumoniaе є плазмідна резистентність, обумовлена наявністю альтернативних сульфаніламідрезистентних варіантів дигідроптероатсинтетази [9].
Також встановлено низьку активність амікацину (50 %), гентаміцину (48,3 %) та тобраміцину (56,5 %) за рахунок наявності резистентних та помірно резистентних штамів. Основним механізмом, що визначає стійкість Klebsiella pneumoniaе до аміноглікозидів, є утворення аміноглікозидацетилтрансферазою специфічних ферментів ААС (3)-І та ААС (6')-І, що інактивують ці антибіотики. Модифікований у результаті реалізації зазначеного механізму антибіотик втрачає здатність зв’язуватися з рибосомами й пригнічувати біосинтез білка [16]. Найменша частота виявлення стійких штамів Klebsiella pneumoniaе було зареєстрована до меропенему (резистентність 7,1 %), ципрофлоксацину (резистентність 26,7 %) та левофлоксацину (резистентність 21,4 %).
Отже, аналіз антибіотикорезистентності дозволив виявити певні тенденції й найбільш перспективні антибактеріальні препарати для лікування інфекцій респіраторного тракту до визначення антибіотикочутливості їх збудників.
Встановлені дані є свідченням того, що на сучасному етапі оптимальними стартовими антибактеріальними препаратами емпіричної терапії бактеріальних інфекцій дихальних шляхів у дітей виступають цефалоспорини ІІІ покоління. При виборі препарату слід враховувати, що інфекційні процеси дихальних шляхів у більшості випадків є захворюваннями, які потребують амбулаторної допомоги. Тому переважно препаратами вибору виступають пероральні форми цефалоспоринів ІІІ покоління. У зв’язку з цим нашу увагу привернув препарат Цефодокс, що активний щодо грампозитивної і грамнегативної флори та проявляє стійкість до дії β-лактамаз.
Особливості фармакокінетики препарату забезпечують збереження необхідної концентрації діючої речовини в плазмі крові протягом 12 годин, що обумовлює можливість ерадикації збудників [8, 14]. Цефподоксиму проксетил — препарат, створений за технологією Prodrug, тобто це проліки, які стають активними лише в стінці тонкої кишки, де вони перетворюються на активну форму, тобто цефподоксим. Ця технологія дозволяє підвищити біодоступність препарату та мінімізує низку побічних дій, що притаманні антибактеріальним препаратам, — порушення мікробіоценозу шлунково-кишкового тракту. Крім того, технологія Prodrug дозволяє підвищити оральну абсорбцію препарату, захистити активну речовину від руйнування, вирішити питання захисту від дії соляної кислоти шлунка, забезпечити високу швидкість всмоктування. Після одноразового й багаторазового прийому препарату через 1,9–3,1 год досягається терапевтична концентрація 1,0–4,5 мг/л. Препарат добре розподіляється в органах і тканинах. У легеневій тканині протягом 3–6 годин концентрація препарату становить 0,6–0,9 — 0,5–0,8 мг/кг, це 70–80 % від концентрації в плазмі крові, у слизовій бронхів — 0,9 мг/кг (50 %), в альвеолярних клітинах — 0,1–0,2 мг/кг (10 %), а в плевральній і запальній рідині накопичується до 70–100 % від концентрації в плазмі крові [2]. Концентрація цефподоксиму в легеневій тканині через 6–8 годин вища за МПК90 для таких респіраторних збудників, як M.(B.)catarrhalis — у 2 рази, H.influenzae і S.pneumoniae — у 20 разів, S.pyogenes — приблизно в 70 разів [3]. Цефодоксу притаманний тривалий період напіввиведення. Цефодокс призначається перорально у вигляді таблеток або суспензії з розрахунку 10 мг на 1 кг маси тіла на добу. Розрахункова доза розділяється на 2 прийоми через 2 години після їжі протягом 7–10 днів. Слід зазначити, що на сучасному етапі відсутні специфічні диски та інші засоби для визначення чутливості флори саме для Цефодоксу, тому що зазначений препарат є проліками, які стають активними лише в стінці тонкої кишки, де вони перетворюються на активну форму. Тому чутливість флори визначали певною мірою емпірично, з урахуванням чутливості до загальної групи цефалоспоринів ІІІ покоління та власного досвіду, а також наявності доказової бази.
Власний досвід застосування цефподоксиму проксетилу в терапії дітей, хворих на пневмонію, гострий і рецидивуючий бронхіт, синусит, що викликані найбільш поширеними збудниками, у тому числі і Haemophilus influenzae, показав високу ефективність препарату, здатність до повної ерадикації патогену та його безпечність [10–12].
Пацієнтам, хворим на гострий синусит, як антибактеріальний препарат ми призначали цефподоксиму проксетил (Цефодокс) у віковому дозуванні (10 мг/кг маси тіла на добу у 2 прийоми, максимальна добова доза — 400 мг). Тривалість лікування становила 10 днів. Клінічні ознаки оцінювалися до початку дослідження, на 5-й і 11-й день від початку терапії. Тяжкість симптомів оцінювалася за декількома параметрами: лихоманка, закладеність носа, виділення з носа, риноскопічна картина (Рязанцев С.В. и соавт., 2009). Сума всіх балів становила загальний клінічний рахунок (ЗКР). Ступінь тяжкості розцінювався як тяжкий при рівні ЗКР понад 8 балів, як середньотяжкий — якщо ЗКР становив до 8 балів.
Клінічна ефективність терапії оцінювалася як «значне поліпшення» при повному зникненні ознак захворювання (зниження ЗКР не менше ніж на 90 % або ЗКР на 11-й день, що дорівнює 0); «поліпшення» — при частковому зникненні ознак захворювання без необхідності проведення подальшої антибактеріальної терапії (зниження ЗКР на 60 %); «без ефекту» — за відсутності позитивної динаміки (зниження ЗКР менше ніж на 60 %), що вимагає зміни антибактеріального препарату; «погіршення» — при прогресуванні ознак синуситу, що вимагають зміни антибактеріального препарату.
До початку лікування більшість хворих (74 дитини — 97,4 %) скаржилися на закладеність носа, головний біль, підвищену стомлюваність, субфебрилітет. У 49 (64,5 %) пацієнтів спостерігалися слизові виділення з носа, у 16 (21,1 %) — слизово-гнійні та в 11 (14,5 %) дітей — гнійні. У частини хворих дітей (47,4 %) батьки відзначали неприємний запах з рота. Риніт у 63 (82,9 %) дітей супроводжувався кашлем, що посилювався після сну. При пальпації й перкусії в 57 % пацієнтів відмічалася підвищена чутливість або болючість у ділянці передньої стінки верхньощелепної пазухи і/або передньої і нижніх стінок лобової пазухи. У всіх хворих діагноз синуситу був підтверджений при рентгенологічному дослідженні навколоносових пазух. За даними ЗКР у 55 (72,4 %) дітей захворювання розцінене як середньотяжке, а у 21 (27,6 %) пацієнта воно мало тяжкий перебіг. У клінічному аналізі крові в більшості дітей (66 пацієнтів — 86,8 %) в перший день дослідження спостерігалися незначні зміни у вигляді лейкоцитозу, зсуву лейкоцитарної формули вліво, збільшення швидкості осідання еритроцитів.
Застосування Цефодоксу приводило до поліпшення стану хворих з перших днів лікування: вже на 2–3-й день прийому препарату нормалізувалася температура тіла, зникали головні болі, з 3–5-го дня терапії поліпшувалося носове дихання, зменшувалися прояви кашлю.
На тлі лікування Цефодоксом спостерігалися значне зменшення ринореї та зміна характеру виділень з носа. На 5-й день терапії в жодного хворого не було гнійних виділень з носа, слизово-гнійні виділення зберігалися лише в 7 (9,2 %) хворих, зменшилася кількість дітей із серозними виділеннями з носа до 16 (21,1 %). У 53 (69,7 %) пацієнтів на 5-й день терапії Цефодоксом виділення з носа були відсутні. Дані риноскопії на 5-й день терапії також свідчили про позитивну динаміку: зменшилися гіперемія й набряклість слизової оболонки порожнини носа, а у 26 (34,2 %) пацієнтів риноскопічна картина відповідала нормі. При обстеженні на 11-й день від початку терапії в 72 дітей (94,7 %) риноскопічна картина нормалізувалася, виділення з носа відсутні, і лише у 4 (5,3 %) спостерігалися слизові виділення й зберігався помірний набряк слизової оболонки порожнини носа, їм було продовжено курс лікування до 14 днів з клінічним одужанням. При лабораторному дослідженні на 11-ту добу в усіх дітей нормалізувалися показники в аналізах периферичної крові.
Застосування в терапії дітей, хворих на гострий бактеріальний та рецидивуючий бронхіти, цефалоспорину ІІІ покоління Цефодоксу вже з перших днів терапії сприяло позитивній динаміці клінічної картини. На 2–3-й день прийому препарату відбувалося покращення загального стану: зменшувалися симптоми інтоксикації, нормалізувалася температура тіла, поліпшувалися сон, настрій, апетит. На тлі нормалізації загального стану з 3–4-го дня аускультативна картина в легенях характеризувалась зменшенням кількості хрипів з повним їх зникненням на 5–7-й день терапії. Одночасно відбувалося зменшення інтенсивності й полегшення кашлю та покращення реологічних характеристик мокротиння. На 5–7-й день терапії Цефодоксом спостерігалася й позитивна динаміка гематологічних показників з повною нормалізацією гемограми на 8–10-й день лікування.
Діти, хворі на пневмонію, отримували ступінчасту терапію: з 1-го дня госпіталізації внутрішньовенно цефалоспорини ІІІ покоління, з 4-го дня за наявності позитивної клінічної динаміки призначався Цефодокc перорально. Добова доза, поділена на 2 прийоми через кожні 12 годин, Цефодоксу становила 10 мг/кг. Тривалість антибактеріальної терапії — 10–14 днів. Ефективність антибіотикотерапії оцінювалася за динамікою скарг, клініко-лабораторних показників та даних рентгенологічного дослідження.
Аналіз результатів проведеного лікування дітей, хворих на пневмонію, показав наявність позитивної динаміки та нормалізацію клінічного стану до закінчення курсу терапії в усіх пацієнтів. Температура тіла знижувалася наприкінці 2–3-го дня, а до 7-го дня лікування вона була в межах норми у всіх дітей. Одночасно зникали прояви астенічного синдрому: діти були більш активними, підвищувався апетит, зменшувалися слабкість, загальне нездужання. Нормалізація фізикальних змін в легенях відмічалася в середньому на 8–12-й день лікування. Після закінчення терапії задишки не спостерігалося в жодному випадку. Майже у всіх (92 %) дітей на 10–14-й день лікування зникав кашель, у 8 % пацієнтів кашель хоча і залишався, але був незначним і не супроводжувався погіршенням загального стану та самопочуття дитини. Контрольна рентгенограма органів грудної клітки в групі хворих на пневмонію показала значне зменшення інфільтративної тіні на 5–6-й день терапії та повне зникнення вогнища пневмонічної інфільтрації легенів на 10–12 день терапії
На 5–7-й день терапії Цефодоксом хворих на пневмонію дітей спостерігалася позитивна динаміка гематологічних показників, повна нормалізація гемограми відбувалася на 8–10-й день лікування. У всіх хворих, які отримували Цефодокс, при проведенні контрольного мікробіологічного дослідження після закінчення курсу терапії патогенна флора в значущих концентраціях не висівалася. У жодному випадку не спостерігалося клінічних ознак порушень мікробіоценозу кишечника, що підтверджувалося мікробіологічними дослідження калу.
Крім того, накопичена велика доказова база ефективності застосування цефподоксиму проксетилу в терапії бактеріальних респіраторних захворювань у дітей. Перш за все це вітчизняне проспективне дослідження «Цеф-ПРОСТО», у якому було показано високу ефективність препарату (88 % — висока та 10,2 % — помірна ефективність) у лікуванні бактеріальних захворювань органів дихання у дітей, а також доведено високий рівень безпеки препарату [5]. У проспективному дослідженні «Центр» було показано, що ефективність застосування препарату Цефодокс становила 93,1 % у хворих на позагоспітальну пневмонію [7].
Слід відзначити добру переносимість препарату Цефодокс, приємний смак та зручність у дозуванні. Побічних ефектів у хворих, які перебували під спостереженням, не відзначено.
Відсутність ефекту при застосуванні цефалоспоринів ІІІ покоління з високим ступенем вірогідності виступає свідченням наявності резистентної мікрофлори, що потребує застосування інших препаратів з урахуванням даних про антибіотикорезистентність.
Висновки
1. На сучасному етапі відбувається зміна мікробного спектра та зростання резистентності основних збудників респіраторних інфекцій до антибактеріальних препаратів.
2. Основу адекватної етіотропної терапії бактеріальних захворювань органів дихання в дітей становить емпірична стартова антимікробна терапія з урахуванням передбачуваного збудника та його можливої антибіотикорезистентності.
3. Застосування цефалоспорину ІІІ покоління Цефодокс як стартової антибактеріальної терапії захворювань органів дихання у дітей є раціональним та ефективним, він може бути використаний як препарат вибору.
Список литературы
1. Белоусов Ю.Б. Клиническая фармакология и фармакотерапия (руководство для врачей) / Ю.Б. Белоусов, В.С. Моисеев, В.К. Лепахин. — М.: Универсум, 2006. — 920 с.
2. Бережной В.В. Опыт использования препарата «Цефодокс» в комплексной терапии гнойных синуситов у детей / В.В. Бережной, В.Г. Козачук, И.Б. Орлюк [и др.] // Современная педиатрия. — 2007. — № 3. — С. 88-92.
3. Волосовец А.П. Цефодокс (цефподоксима проксетил): трехлетний анализ клинического использования в педиатрии / А.П. Волосовец, С.П. Кривопустов, О.Л. Дзюба [и др.] // Современная педиатрия. — 2009. — № 4. — С. 34-38.
4. Волосовец А.П. Результаты многоцентрового исследования «Цеф-ПРОСТО» (цефподоксима проксетил в стартовой терапии внебольничной пневмонии у детей) в Украине / А.П. Волосовец, А.Е. Абатуров, Л.В. Беш и др. // Современная педиатрия. — 2011. — № 2(36). — С. 107-112.
5. Выделение, идентификация и определение чувствительности к антибиотикам Haemophilus influenzae (Метод. рекомендации для микробиологов) // Клин. микробиол. антимикроб. химиотерапия. — 2000. — Т. 2, № 2. — С. 93-109.
6. Дехнич А.В. Выявление резистентности к метициллину и другим бета-лактамным антибиотикам методом скрининга: Методическое пособие / А.В. Дехнич. — М., 1998.
7. Дядык А.И. Опыт применения цефподоксима у больных с внегоспитальными пневмониями (Результаты проспективного открытого исследования «ЦЕНТР») /А.И. Дядык, А.Э. Багрий, Н.Л. Суровцева [и др.] // Ліки України. — 2009. — № 8. — С. 73-75.
8. Диференційоване застосування антибактеріальних препаратів в педіатрії (за матеріалами IX Всеукраїнської науково-практичної конференції «Актуальні питання педіатрії») // Новости медицины и фармации. — 2007. — № 21–22. — С. 230-231.
9. Жель Ф. Від антибіотикограми до рецепта / Ф. Жель, М. Шомара, М. Уебер [та ін.] // Логос. — 2007. — С. 87-89.
10. Леженко Г.О. Досвід застосування Цефодоксу в лікуванні позалікарняних пневмоній та рецидивуючих бронхітів у дітей / Г.О. Леженко, О.Є. Пашкова // Здоровье ребенка. — 2010. — № 4. — С. 29-31.
11. Леженко Г.О. Обґрунтування вибору тактики фармакотерапії гострих синуситів у дітей / Г.О. Леженко, О.Є. Пашкова, Л.І. Пантюшенко // Современная педиатрия. — 2012. — № 3. — С. 95-98.
12. Леженко Г.О. Роль Haemophilus influenzae у формуванні інфекційної патології в дітей / Г.О. Леженко, О.Є. Пашкова, Л.І. Пантюшенко // Здоровье ребенка. — 2013. — № 1. — С. 67-72.
13. Методические указания по определению чувствительности микроорганизмов к антибактериальным препаратам. Государственное санитарно-эпидемиологическое нормирование Российской Федерации. Методические указания. МУК 4.2. 1890-04. — М., 2004.
14. Нові перспективи використання пероральних цефалоспоринов в педіатрії. За матеріалами V Конгресу педіатрів України, 15–17 жовтня, м. Київ // Здоров’я України. — 2008. — № 24/1. — С. 36-37.
15. Практическое руководство по антиинфекционной химиотерапи / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. — Смоленск: МАКМАХ, 2007. — 464 с.
16. Семенов В.М. Микробиологические и биологические аспекты резистентности к антимикробным препаратам / В.М. Семенов, Т.И. Дмитраченко, И.В. Жильцов // Медицинские новости. — 2004. — № 2. — С. 10-17.
17. Bouza E. Linezolid: pharmacokinetic characteristics and clinical studies / E. Bouza, P. Munoz // Clin. Microbiol. Infect. — 2001. — Vol. 7 (Suppl. 4). — P. 75-82.
18. Burry A. Susceptibility of β-lactamasee producting and nonproducting ampicillin-resistance strains of Haemophilus influenzaе to ceftibuten, cefaclor, cefuroxime, cefixime, cefotaxime and amoxicillin clavulanic acid / A. Burry, P. Fuchs, M. Pfaller // Antimicrob. Agents Chemother. — 1993. — Vol. 37. — P. 14-18.
19. Hoban D. The PROTEKT surveillance study: antimicrobial susceptibility of Haemophilus influenza and Moraxella catarrhalis from community-acquired respiratory tract infections / D. Hoban, D. Felmingham // J. Antimicrob. Chemother. — 2002. — Suppl. S1. — P. 49-59.
20. Jones R. 1994–95 survey of Haemophilus influenza susceptibility to tenorally administered agents / R. Jones, M. Jacobs, J. Washington, M.A. Pfaller // Diagn. Microbiol. Infect. Dis. — 1997. — Vol. 27. — P. 75-83.
21. Routine internal quality control as recommended by EUCAST. Version 3.1, valid from 2013-01-01.
22. Struelens M.J. European NDM-1 Survey Participants: New Delhi metallo-beta-lactamase 1-producing Enterobacteriaceae: emergence and responsein Europe / M.J. Struelens, D.L. Monnet, A.P. Magiorakos [et al.] // Euro Surveill. — 2010. — Vol. 15 (46). — P. 19716.

/12.jpg)
/13.jpg)
/14.jpg)